

贵州高考化学三年(2020-2022)模拟题分类汇编-5铝及其化合物,铁及其化合物
展开
这是一份贵州高考化学三年(2020-2022)模拟题分类汇编-5铝及其化合物,铁及其化合物,共21页。试卷主要包含了单选题,实验题,工业流程题等内容,欢迎下载使用。
一、单选题
1.(2020·贵州铜仁·统考一模)下列实验设计能达到实验目的的是
A.AB.BC.CD.D
2.(2020·贵州黔东南·模拟预测)化学与生活密切相关。下列说法正确的是( )
A.利用二氧化硅与碳酸钙常温反应制备陶瓷
B.纺织业利用氢氧化钠的强氧化性将其作为漂洗的洗涤剂
C.利用明矾的水溶液除去铜器上的铜锈,因Al3+水解呈酸性
D.“丹砂(主要成分为硫化汞)烧之成水银,积变又还成丹砂”中发生的反应为可逆反应
3.(2022·贵州遵义·统考三模)化学与生产、生活密切相关,下列物质的性质、用途都正确且有相关性的是
A.AB.BC.CD.D
4.(2022·贵州·统考模拟预测)能正确表示下列变化的离子方程式是
A.向次氯酸钙中通入过量的二氧化碳气体:Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓
B.向硝酸铝溶液中滴加足量氢氧化钡溶液:Al3+ +4OH-=AlO+2H2O
C.向氯化铜溶液中通入硫化氢气体:S2- +Cu2+= CuS↓
D.碳酸镁与稀硫酸反应:CO+2H+=CO2↑+H2O
5.(2022·贵州毕节·统考二模)下列离子方程式书写正确的是
A.向含Mn2+的溶液中加入NH4HCO3生成MnCO3:Mn2++2HCO=MnCO3↓+CO2↑+H2O
B.同浓度同体积的NH4HSO4溶液与NaOH溶液混合:NH+OH-=NH3·H2O
C.将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=2HClO+SO
D.向明矾溶液中滴加Ba(OH)2溶液,使沉淀的物质的量最大时:Al3++SO+3OH-+Ba2+=BaSO4↓+Al(OH)3↓
6.(2021·贵州毕节·统考二模)中华传统文化中蕴含着很多化学知识,下列说法正确的是
A.“煮豆燃豆萁,豆在釜中泣”中“豆萁”的主要成分纤维素在人体内最终水解为葡萄糖
B.“薪柴之灰,令人以灰淋汁,取碱浣衣”,“薪柴之灰”不可与铵态氮肥混合施用
C.“火药乃焰硝、硫黄、杉木炭所合”,火药发生爆炸时,生成无色的SO2、NO2和CO2
D.“白墙黛瓦马头墙,回廊挂落花格窗”中“黛瓦”的青黑色是因为含有氧化铁的缘故
7.(2020·贵州铜仁·三模)化学与生活密切相关,下列有关说法不正确的是
A.食用油反复加热会产生稠环芳香烃等有害物质
B.食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是吸水,防止食品变质
C.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
D.在新冠疫情期间用于消毒的医用酒精中乙醇的浓度为75%
8.(2020·贵州铜仁·二模)下列实验操作能达到实验目的的是
A.AB.BC.CD.D
二、实验题
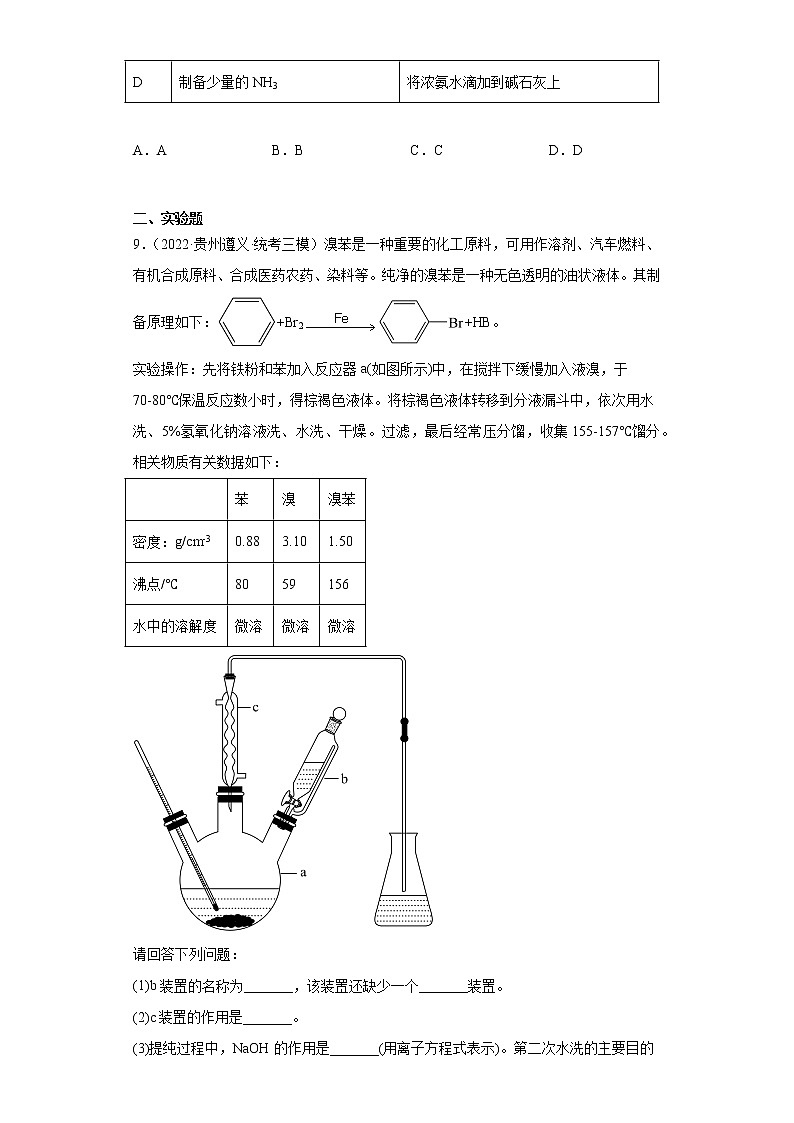
9.(2022·贵州遵义·统考三模)溴苯是一种重要的化工原料,可用作溶剂、汽车燃料、有机合成原料、合成医药农药、染料等。纯净的溴苯是一种无色透明的油状液体。其制备原理如下:+Br2+HB。
实验操作:先将铁粉和苯加入反应器a(如图所示)中,在搅拌下缓慢加入液溴,于70-80℃保温反应数小时,得棕褐色液体。将棕褐色液体转移到分液漏斗中,依次用水洗、5%氢氧化钠溶液洗、水洗、干燥。过滤,最后经常压分馏,收集155-157℃馏分。相关物质有关数据如下:
请回答下列问题:
(1)b装置的名称为_______,该装置还缺少一个_______装置。
(2)c装置的作用是_______。
(3)提纯过程中,NaOH的作用是_______(用离子方程式表示)。第二次水洗的主要目的是_______。
(4)最后仍要分馏的目的是_______。
(5)a中发生的无机反应化学方程式是_______。
(6)锥形瓶中盛有AgNO3溶液,其现象是_______。
(7)本次实验取用110mL苯,溴足量,在制粗溴苯的过程中,苯的利用率是84%,在粗溴苯提纯过程中,溴苯损失了4%,则可得溴苯多少_______克(列出计算式即可)。
10.(2022·贵州贵阳·一模)铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如图:
实验室中可用FeSO4(由铁粉和稀硫酸反应制得)和NH4HCO3用如图装置模拟上述流程中的“转化”环节。
回答下列问题:
(1)配制溶液所用的蒸馏水须先除去其中溶解的氧气,具体方法是___________。
(2)装置A用于制备FeSO4,实验过程中,欲将生成的FeSO4溶液与装置B中的NH4HCO3溶液混合,操作方法是关闭___________,打开___________(填“K1”、“K2”或“K3”);装置B中生成FeCO3的离子方程式为___________。
(3)转化过程中温度不超过35℃,主要原因是___________;“过滤”环节,不需要使用下列仪器中的___________(填仪器名称)。
(4)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为___________;检验产品中是否含Fe3+需要的试剂有稀H2SO4和___________(填化学式)。
(5)取干燥后的FeCO3样品(含少量FeOOH)37.47g,与炭混合后焙烧,最终得到还原铁粉18.48g,计算样品中FeCO3的质量分数为___________%(计算结果取整数)。
11.(2021·贵州毕节·统考二模)Fe(OH)2的制备实验是实验研究的热点,某化学学习小组设计了下列方法制备氢氧化亚铁。
方法一:用如图所示装置(夹持仪器省略)制备氢氧化亚铁。
实验步骤如下:
I.检查装置气密性后,关闭K2、K5,打开K1、K3、K4,使装置A中产生的气体进入装置B中,排尽B中空气。
II.待B中空气排尽后,关闭K3,打开K2,将A中溶液压入B中并观察现象。
III.关闭K1、K2,打开K5,使C中气体通入B中并观察现象。
回答下列问题:
(1)仪器a的名称是___________,B中长玻璃管的作用___________。
(2)H2O2的电子式___________。
(3)装置A中金属离子的检验方法___________。
(4)步骤III装置B中的现象是,其发生反应的化学方程式为___________。
方法二:用铁和石墨作电极材料,通过电解法制备氢氧化亚铁,装置如图所示。
(1)铁与电源的___________(填“正”或“负”)极相连。
(2)阴极发生的电极反应方程式___________。
(3)在标准状况下,当阴极产生 11.2L 气体时,理论上生成___________g Fe(OH)2。
三、工业流程题
12.(2022·贵州毕节·统考二模)镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、Al2O3、SiO2和铁的氧化物为原料,采用酸溶法制取硫酸镍和MgSO4●7H2O,工业流程如图所示。
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水,已知Ksp[Ni(OH)2]=1.0×10-15。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“浸取”时需将矿样研磨的目的是___________,“滤渣1”的成分___________(填化学式)。
(2)滤液1中加入H2O2的作用___________(用反应离子方程式表示)。
(3)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是___________
(4)“滤液1”中是否存在Fe3+,可用___________ (填试剂名称) 检验,检验存在Fe3+的实验方法是___________。
(5)“沉镍”中pH调为8.5,则滤液中Ni2+的浓度为___________ml·L-1
(6)操作V是___________、过滤、洗涤。
(7)NiSO4在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式___________。
13.(2021·贵州毕节·统考二模)某化工厂利用软锰矿(主要成分为MnO2,另含有少量Fe2O3、CaO、CuO、SiO2等杂质)脱除燃煤尾气中的SO2,同时制得电池材料MnO2.工艺流程如下:
(1)滤渣1的成分是___________(填化学式),提高软锰矿酸浸速率的措施有___________(任答一条)。
(2)写出脱硫过程中二氧化锰转化为硫酸锰的化学反应方程式___________。
(3)加入碳酸锰的作用___________。
(4)写出高锰酸钾与硫酸锰发生反应的离子方程式___________。
(5)实验室检验钾离子的操作方法是_____
(6)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,欲使铁离子沉淀完全,应调节溶液pH不低于___________。(设=a,结果用含a的代数式表示)。
14.(2021·贵州·统考一模)以菱铁矿(主要成分FeCO3,还含有CaCO3和SiO2等杂质)为原料制备多功能水处理剂高铁酸钾(K2FeO4)的工艺流程如下:
已知:①K2FeO4可溶于水、微溶于浓KOH溶液;
②FeO在强碱性溶液中稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
回答下列问题:
(1) K2FeO4中Fe元素的化合价是___________ ; 滤渣的主要成分有___________。
(2)“氧化1”过程所发生反应的离子方程式为___________;设计方案验证“氧化1”所得的溶液已经不再含有Fe2+___________
(3)NaClO的电子式为___________ ; “ 氧化2”过程中生成了Na2FeO4和NaCl写出该过程中发生的氧化还原反应的离子方程式___________
(4)提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用___________(填字母序号)和异丙醇。
a.H2SO4溶液 b.KOH浓溶液 c.Fe2(SO4)3溶液
(5)加饱和KOH溶液转化为K2FeO4后的溶液中,所含的阴离子除FeO和OH-外,一定还含有____。
(6)实验室也可按照如图所示的装置模拟电解法制备K2FeO4,其中阳极的电极反应式是_______。
15.(2021·贵州六盘水·统考一模)工业上用生物堆浸法处理低品位黄铜矿(主要成分是CuFeS2)制备绿矾和胆矾,其主要工艺流程如图:
已知:①T.f细菌在1.0
相关试卷
这是一份上海高考化学三年(2020-2022)模拟题分类汇编-52铁及其化合物(5),共15页。试卷主要包含了单选题,工业流程题,实验题等内容,欢迎下载使用。
这是一份上海高考化学三年(2020-2022)模拟题分类汇编-49铁及其化合物(2),共25页。试卷主要包含了单选题,实验题,填空题,工业流程题等内容,欢迎下载使用。
这是一份上海高考化学三年(2020-2022)模拟题分类汇编-47铝及其化合物(5),共13页。试卷主要包含了单选题,工业流程题,填空题等内容,欢迎下载使用。









