


2023枣庄滕州高一下学期期中化学试题含答案
展开保密★启用前
2022~2023学年第二学期期中质量检测
高一化学
2023.04
说明:
1.本试卷分为选择题和非选择题两部分,考试时间90分钟,满分100分。
2.选择题答案用2B铅笔涂在答题卡上,非选择题用0.5mm黑色中性笔作答,答案必须写在答题卡各题目指定区域内的相应位置。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27
一、选择题(本题包括20小题,每小题3分,共60分;每小题只有一个选项符合题意)
1.2022年12月,中国航天员乘组完成首次在轨交接,中国航天员“天宫”会师创造历史。下列说法不正确的是( )
A.航天器使用的太阳能电池帆板的主要成分是Si
B.运载火箭的燃料偏二甲肼(化学式)为共价化合物
C.天和核心舱的霍尔发动机燃料原子核中含77个中子
D.航天员的耳机使用的双层蛋白质皮革属于新型无机非金属材料
2.下列说法正确的是( )
A.、、是三种不同的核素
B.和互为同位素
C.、互为同素异形体
D.同一元素形成的不同微粒具有相同的化学性质
3.同一短周期元素X、Y、Z、W形成的最高价含氧酸的酸性依次增强,下列有关叙述正确的是( )
A.单质沸点:X<Y<Z<W B.气态氢化物的稳定性:X>Y>Z>W
C.原子序数:X>Y>Z>W D.最高正价:X<Y<Z<W
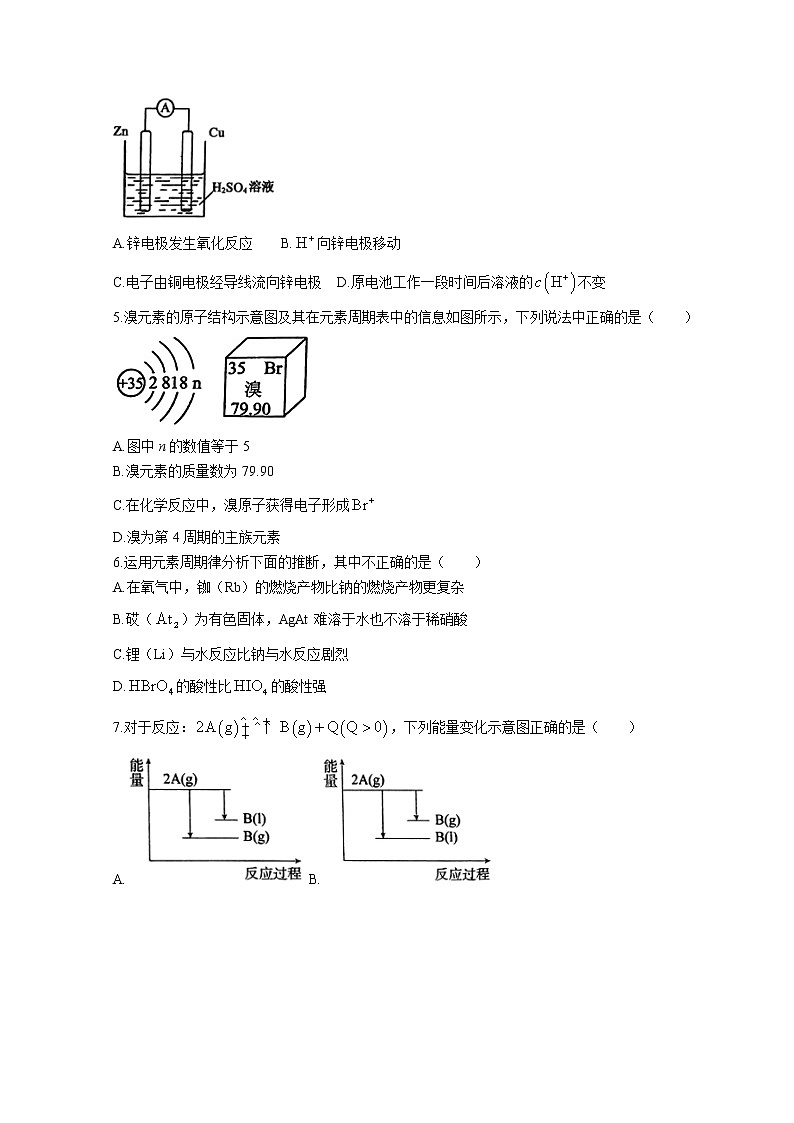
4.化学电源应用广泛。某原电池装置如图所示,下列说法正确的是( )
A.锌电极发生氧化反应 B.向锌电极移动
C.电子由铜电极经导线流向锌电极 D.原电池工作一段时间后溶液的不变
5.溴元素的原子结构示意图及其在元素周期表中的信息如图所示,下列说法中正确的是( )
A.图中n的数值等于5
B.溴元素的质量数为79.90
C.在化学反应中,溴原子获得电子形成
D.溴为第4周期的主族元素
6.运用元素周期律分析下面的推断,其中不正确的是( )
A.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂
B.砹()为有色固体,AgAt难溶于水也不溶于稀硝酸
C.锂(Li)与水反应比钠与水反应剧烈
D.的酸性比的酸性强
7.对于反应:,下列能量变化示意图正确的是( )
A. B.
C. D.
8.下列化学用语中书写正确的是( )
A.氮气的电子式: B.的结构示意图:
C.溴化钠的电子式: D.中子数为8的氧原子:
9.下列关于化学键的叙述中正确的是( )
A.化学键通常是指相邻的两个或多个原子之间强烈的相互作用
B.两个原子之间的相互作用叫做化学键
C.化学键存在于原子之间,也存在于分子之间
D.离子键是阴、阳离子之间的相互吸引力
10.2022年诺贝尔化学奖颁给了在“点击化学”领域做出贡献的科学家。我国科研人员发现了一种安全、高效的点击化学试剂。下列关于元素F、S、O、N的说法错误的是( )
A.简单气态氢化物中最稳定的是HF
B.元素非金属性最强的是F
C.F原子半径比N原子半径大
D.O元素在周期表中的位置是第2周期第VIA族
11.如图表示1~18号元素(原子)的结构或性质随核电荷数递增的变化。无法由该图中曲线获知的是( )
A.电子层数 B.原子半径 C.最高化合价 D.最外层电子数
12.不能作为卤族元素(氯、溴、碘)非金属性递变规律的判断依据的是( )
A.氢卤酸的酸性 B.单质的氧化性
C.卤化氢的热稳定性 D.与氢气化合的难易程度
13.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A.由与,得m+a=n-b
B.X,Y一定不是同周期元素
C.的还原性一定大于
D.若X的原子半径大于Y,则气态氢化物的稳定性一定大于
14.下列关于元素周期表的说法正确的是( )
A.副族元素都是金属元素 B.主族元素都是短周期元素
C.在元素周期表中,每一纵行就是一个族 D.元素周期表中每个长周期均包含32种元素
15.如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液面左边低于右边,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )
A.过氧化钠 B.氧化钠 C.钠 D.氯化钠
16.以下验证元素的金属性、非金属性强弱的实验,所用物品不合理的是( )
A.比较钾、钠:Na、K、
B.比较镁、铝:溶液、溶液、NaOH溶液
C.比较硫氯:浓硫酸、高氯酸、pH试纸
D.比较溴、碘:溴水、KI-淀粉试纸
17.空气吹出法是目前“海水提溴”的主要方法之一,其工艺流程如图示。下列说法不正确的是( )
A.步骤③说明具有挥发性
B.步骤④中可用亚硫酸钠溶液代替
C.步骤④⑤是为了溴富集
D.步骤②中氧化理论上消耗3.36L氯气
18.化学是以实验为基础的科学。如图(部分夹持装置省略)所示的实验方案正确的是( )
A | B | C | D |
分离和固体 | 获得的溶液 | 证明非金属性强弱:Cl>C>Si | 观察KCl的焰色试验的现象 |
19.科学家已获得了气态分子,其结构为正四面体(如图所示)。已知断裂1molN—N键吸收167kJ能量,断裂1molN≡N键吸收942kJ能量,下列说法正确的是( )
A.属于一种新型的化合物
B.(g)=4N(g)的过程中释放1002kJ能量
C.和互为同素异形体,转化为属于化学变化
D.1mol转化为时要吸收882kJ能量
20.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是( )
A.Y的最高价氧化物对应的水化物具有强酸性
B.对应的简单气态氢化物的稳定性:Y<Z
C.元素X、Z和W能形成多种化合物
D.对应的简单离子的半径:X<W
二、主观题(本题包括4题,共40分)
21.(10分)1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。如图是元素周期表的一部分,回答下列问题。
B | C | N | O | F |
Al | Si | P | S | Cl |
Ga | Ge | As | Se | Br |
In | Sn | Sb | Te | I |
(1)周期表呈现的短周期元素中,次外层电子数等于其他电子层电子数之和的元素是______(写原子结构示意图);上述周期表呈现的元素中,金属性最强的元素在周期表中处于第______周期第______族。
(2)Sn的最高正价为______,写出Cl的最高价氧化物对应水化物的化学式______。
(3)比较微粒半径大小:Al ______F;______(选填“>”或“<”)。
(4)元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。
①以下关于碱金属,说法不正确的是______。
A.随电子层数增多,原子半径逐渐增大
B.随着核电荷数的增加,离子的氧化性逐渐增强
C.钾与氧气或水反应比钠的反应剧烈,也比铷、铯的反应更剧烈
D.原子易失去电子,呈现+1价
②原子数相同、价电子总数相同的粒子互称为等电子体。Y、Q是上述周期表中短周期元素,元素相关信息见下表。
Q | 与H可形成的10电子结构分子 |
Y | 带两个负电荷的负离子与氖原子结构相同 |
硼元素与Y、Q形成互为等电子体负离子:、,则m值为______。
22.(10分)某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
实验I:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。已知A装置的烧瓶里装有大理石,分液漏斗里装有稀,B装置中装有饱和碳酸氢钠溶液,装置C中装有溶液,试回答:
(1)A中反应的离子方程式为___________________,C中可观察到的现象是________________________。
(2)B装置的作用是________________________。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是____________,由此得出碳、硅、氮三种元素非金属性的强弱顺序是____________。
实验II:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。
(4)写出B装置中发生反应的离子方程式:__________________。
(5)C装置的作用是________________________。
(6)实验结论:、单质的氧化性强弱______,Cl、Br元素非金属性的强弱______。
23.(6分)现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随有能量变化,能量、速率与限度是认识和研究化学反应的重要视角。
(1)已知破坏1molH—H、1molO=O、1molH—O时分别需要吸收436kJ、498kJ、465kJ的能量。右图表示、转化为水反应过程的能量变化,则b表示的能量为______。
(2)氢氧燃料电池是用于驱动电动汽车的理想能源。右图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
①电池的负极反应物为______。
②电池工作时向______移动(填“正极”或“负极”)。
③电池工作一段时间后电解质溶液的pH______(填“增大”“减小”或“不变”)。
24.(14分)海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:
(1)提碘的原料一般选择海带或海藻,是因为________________________。
(2)在实验室里把有机碘化物转化为碘离子往往需要灼烧操作,灼烧海带需要在______中进行。
(3)若从绿色化学角度考虑,①处选不好的原因是________________________。
(4)操作I中,实验室可用如图仪器将富集到有机溶液X,该步操作的名称为______;右图中所选用的有机溶剂可以是______(选填编号)。
a.酒精 b.醋酸 c.四氯化碳 d.苯
(5)操作I中具体实验步骤为:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水跟5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗.上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层。
实验步骤的正确顺序为______→______→______→A→H→______→______→______。
(6)为寻找氯水的替代品,某同学设计了如下实验来证明能否代替氯水。实验操作:将作为氧化剂滴加入溶液A中,取少量反应后的溶液于试管中,____________,则证明能代替氯水。请写出此反应的离子方程式__________________。
山东省枣庄市滕州市2023-2024学年高一上学期期中考试化学试题含答案: 这是一份山东省枣庄市滕州市2023-2024学年高一上学期期中考试化学试题含答案,共19页。试卷主要包含了试卷时长90分钟,满分100分,1mlFe在0, 现需配制1L含浓度均为0等内容,欢迎下载使用。
山东省枣庄市薛城区、滕州市2023-2024学年高一上学期期中考试化学试题(含答案): 这是一份山东省枣庄市薛城区、滕州市2023-2024学年高一上学期期中考试化学试题(含答案),共11页。试卷主要包含了5~1等内容,欢迎下载使用。
2024枣庄滕州高一上学期期中考试化学PDF版含答案: 这是一份2024枣庄滕州高一上学期期中考试化学PDF版含答案,文件包含山东省枣庄市滕州市2023-2024学年高一上学期期中考试化学pdf、高一化学答案pdf等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。












