



中考化学二轮复习中考秘籍课件第05讲 中考化学流程图题的解法与技巧 (含答案)
展开
这是一份中考化学二轮复习中考秘籍课件第05讲 中考化学流程图题的解法与技巧 (含答案),共36页。PPT课件主要包含了具体操作,题型3石灰石工业,题型4制碱工艺等内容,欢迎下载使用。
工业流程图题(生产实际分析)的内容往往与生产、生活实际联系密切,因此从题干部分看一般都是采取流程图的模式。解题方法是阅读完流程图后结合相关信息回答问题。 (1)流程图的形式各异,有的以操作名称作为框图形成流程的主线,有的以物质作框,有的以设备作框,但每一题都固定以上一种形式作框,从近几年的试题看常见的是以操作名称为主线,物质随着操作流程发生变化。 (2)这类题目中通常还包含简单的实验设计,实验一般为制备或对样品的定性定量分析实验。
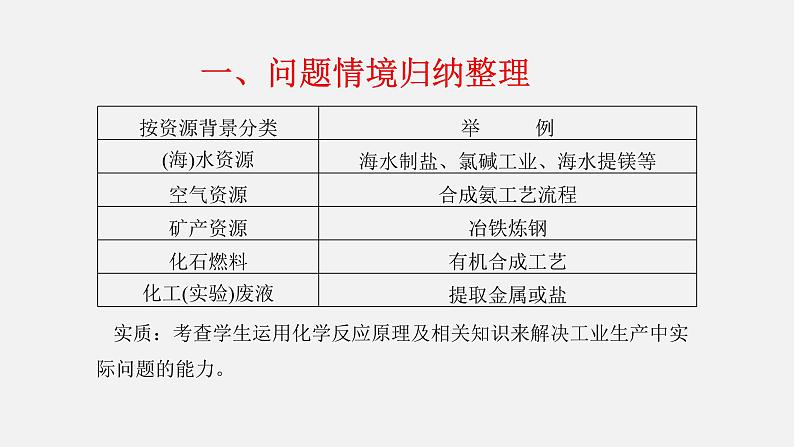
一、问题情境归纳整理
实质:考查学生运用化学反应原理及相关知识来解决工业生产中实际问题的能力。
1.考查内容(1)化学反应原理。(2)元素化合物知识。(3)实验操作及名称。(4)物质除杂、分离。(5)流程中的物质转化和循环。2.特点(1)情境真实。(2)框图信息新颖。(3)问题设计广泛。(4)综合性强。(5)思维容量大。
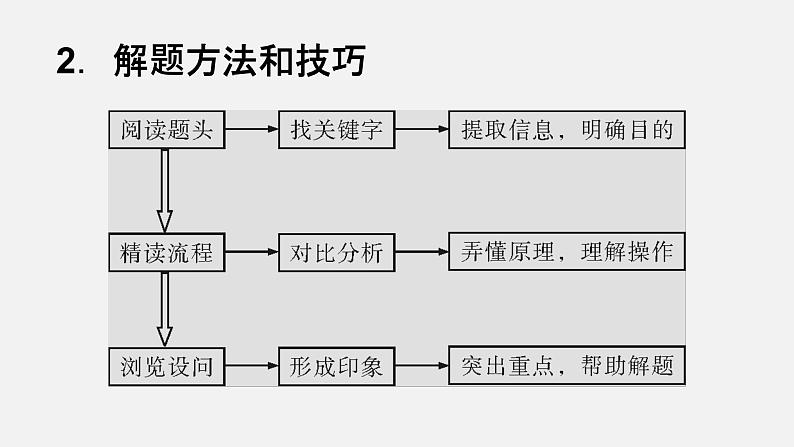
三.题型的结构、解法和思路
1.题型结构题头(引入信息)→题干(提取信息,应用解题)→题尾(得出结论或产品)。
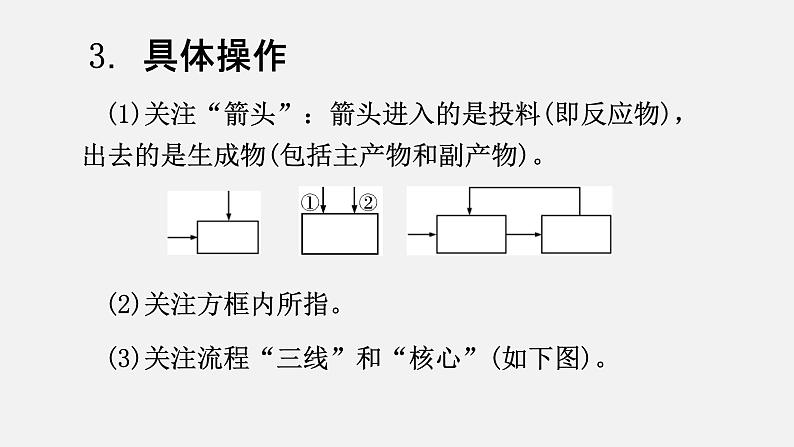
(1)关注“箭头”:箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物)。
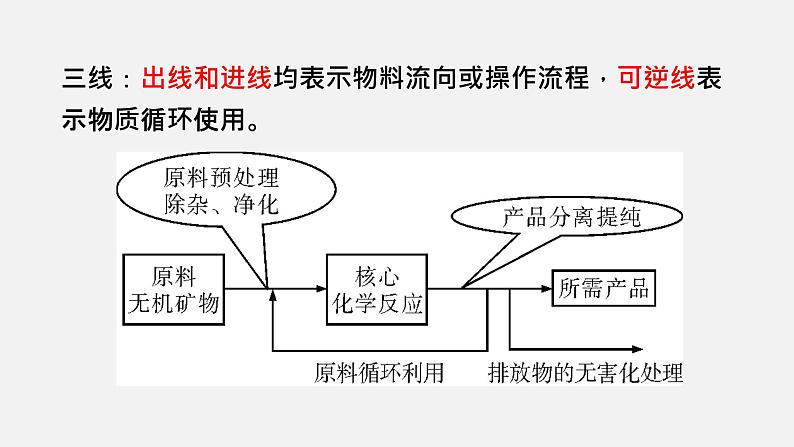
(2)关注方框内所指。(3)关注流程“三线”和“核心”(如下图)。
三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环使用。
题型1 海水资源的利用
[解题指引]实质是考查混合物的除杂、分离、提纯的有关实验基础知识、基本操作和技能。当遇到这类题目时,要求考生一定要认真在流程(图)中找出得到的主要物质是什么,混有的杂质有哪些;认真分析当加入某一试剂后,能与什么物质发生反应,生成了什么产物,要用什么样的方法才能将杂质除去。只有这样才能明白每一步所加试剂或操作的目的。
[例1](2019•遵义)海洋是人类宝贵的自然资源,海水“制盐”体现了人类利用化学科学征服和改造自然的智慧。通过晾晒海水,可以得到粗盐,粗盐中含有不溶性杂质(如泥沙等)和可溶性杂质(如MgCl2、CaC12等),工业上以粗盐为原料制取精盐,其生产流程如图所示
请回答下列问题:(1)操作b中玻璃棒的作用是 。(2)加入Na2CO3溶液除去的离子是 (填离子符号),加入NaOH溶液发生反应的化学方程式为 ;(3)滤液中溶质的主要成分是 (填化学式),加入足量稀盐酸的目的是 。(4)如果称量Ⅰ中称得粗盐的质量为3g,称量Ⅱ中称得精盐的质量为3.1g,则下列分析正确的是 (填字母) A.精盐的产率为103.3% B.蒸发操作中可能有水分没有蒸干 C.除杂过程中有NaCl生成 D.溶解操作中粗盐没有完全溶解
【答案】(1)引流。(2)Ca2+;MgCl2+2NaOH=2NaCl+Mg(OH)2↓。(3)NaCl;除去过量的氢氧化钠和碳酸钠。(4)BC。 【解析】(1)操作b是过滤,玻璃棒的作用是引流。(2)加入Na2CO3溶液除去的离子是Ca2+,加入NaOH溶液,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,发生反应的化学方程式为:MgCl2+2NaOH=2NaCl+Mg(OH)2↓。
(3)滤液中溶质的主要成分是NaCl,加入足量稀盐酸的目的是除去过量的氢氧化钠和碳酸钠。(4)A.精盐的产率不可能为103.3%,该选项说法不正确;B.蒸发操作中可能有水分没有蒸干,该选项说法正确;C.除杂过程中有NaCl生成,该选项说法正确;D.溶解操作中粗盐没有完全溶解,会导致精盐质量偏小,该选项说法不正确。
题型2 空气资源——合成氨工艺流程
[例2](2019•石景山区二模)利用天然气制氨加工成尿素[CO(NH2)2]的主要流程如图。
(1)水电解反应的化学方程式为 。(2)氨合成过程发生反应的基本反应类型是 。(3)生成尿素反应的化学方程式为:2NH3 +CO2═CO(NH2)2+H2O.若34 kg NH3完全转化,可生产尿素 kg。【答案】(1)2H2O ═══2H2↑+ O2↑; (2)化合反应;(3)60。
【解析】(1)水电解反应是水在通电条件下生成氢气和氧气,对应的化学方程式为2H2O ═══2H2↑+ O2↑。(2)氨合成过程发生反应是氮气和氢气生成氨气,为多变一,符合化合反应的特征,属于基本反应类型的化合反应。(3)若34 kg NH3完全转化,生产尿素的质量为x 2NH3 +CO2═CO(NH2)2+H2O 34 60 34kg x x=60kg
[解题指引] 首先从石灰石作为原料出发,获取要制备的物质,写出主要的化学方程式或制备原理,观察是否有副产物,如果有,则剩余的步骤就是分离和提纯操作。
[例3](2019•海淀区一模)工业上用石灰石等物质为原料制备轻质碳酸钙,主要流程如图所示。
(1)碳化塔中发生反应的化学方程式为 。(2)下列说法正确的是 。 A.窑气是纯净物 B.浆池的作用之一是分离生石灰中的杂质 C.得到的轻质碳酸钙比石灰石中碳酸钙的纯度高【答案】(1)CO2+Ca(OH)2=CaCO3↓+H2O;(2)BC。
【解析】(1)碳化塔中二氧化碳与氢氧化钙溶液生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O。(2)A.窑气中含有二氧化碳、空气的成分,属于混合物,故说法错误。B.浆池能分离出废渣,浆池的作用之一是分离生石灰中的杂质,故说法正确。C.石灰石中含有较多的杂质,得到的轻质碳酸钙,比石灰石中碳酸钙的纯度高,故说法正确。
[例4](2020•门头沟区一模)现代工业常以氯化钠、二氧化碳、氨气(NH3)为原料制备碳酸钠,主要流程如图:
注:晶浆中主要含有NaHCO3固体、NaCl溶液、NH4Cl溶液;母液是含有NaCl、NH4Cl的溶液。(1)溶解池中,NaCl溶于水的过程中需不断搅拌,其目的是 。(2)煅烧炉中发生反应的基本反应类型为 。(3)整个流程中,可以循环使用的物质有 。【答案】加速溶解;分解反应;二氧化碳、水。
【解析】(1)溶解池中,NaCl溶于水的过程中需不断搅拌,其目的是加速溶解。
(2)煅烧炉中碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,发生反应的基本反应类型为分解反应。
(3)整个流程中,可以循环使用的物质有二氧化碳、水。
[解题指引]这类实验题主要包括污水处理工业、金属回收工业、新产品的制取等,综合性很强,常常通过物质的制备,混合物的分离、提纯,物质的回收利用,流程设计是否合理等方面设计试题。这类综合实验题,通过认真分析,可以化解为几个相对独立又相互联系的小实验、小操作来进行解答。由各个小实验确定各步操作方法,又由各个小实验之间的关系确定操作的先后顺序。
[例5](2019•北京)利用电石渣[主要成分为Ca(OH)2、MgO]制备硫酸钙的主要工艺流程如图:
已知:MgO难溶于水;MgSO4易溶于水; CaSO4微溶于水。
(1)反应器中搅拌的目的是 。
(2)反应器中发生的反应主要有MgO+H2SO4=MgSO4+H2O和 。
(3)上述流程中,用于分离提纯的设备有 。
【答案】(1)使反应物充分接触,加快反应速率;
(2)Ca(OH)2+H2SO4=CaSO4+2H2O;(3)过滤器、洗涤槽。
【解析】(1)反应器中搅拌的目的是:使反应物充分接触,加快反应速率;
(2)氢氧化钙和硫酸反应生成硫酸钙和水,化学方程式为:Ca(OH)2+H2SO4=CaSO4+2H2O;
(3)反应中生成的硫酸钙微溶于水,通过过滤和洗涤可以得到纯净的硫酸钙,所以用于分离提纯的设备有:过滤器、洗涤槽。
[例6](2019•荆门)氯碱工业以粗盐(主要成分是NaCl,含少量泥沙、CaCl2、MgCl2)为原料,生产氯气和氢氧化钠,模拟流程如图:
(1)试剂A与试剂B的组合为 (填序号)①KOH ②NaOH ③K2CO3 ④Na2CO3(2)操作A需使用玻璃棒,玻璃棒的作用是 。(3)流程中Mg元素必须转化成 (填化学式)才能完全除去。(4)写出电解NaCl溶液的化学方程式 。(5)该工业副产品H2目前还不能作为燃料被广泛应用,其理由 (答一条即可)。
【答案】(1)②④。(2)引流。(3)Mg(OH)2。(4)2NaCl+2H2O2 ═══ NaOH+H2↑+Cl2↑。(5)不易储存。【解析】(1)试剂A与试剂B的组合为氢氧化钠、碳酸钠,分别除去氯化镁、氯化钙。(2)操作A(过滤)需使用玻璃棒,玻璃棒的作用是引流。
(3)流程中Mg元素必须转化为Mg(OH)2才能完全除去。(4)电解NaCl溶液生成氢氧化钠、氯气和氢气,反应的化学方程式:2NaCl+2H2O2 ═══ NaOH+H2↑+Cl2↑。(5)该工业副产品H2目前还不能作为燃料被广泛应用,其理由是不易储存、不安全、制取价格较高等。
[例7](2019•江西)2020年奥运会奖牌制作原料来自于电子垃圾中提炼出来的金属。从废线路板中提炼贵重金属和制备硫酸铜晶体的一种工艺流程如图:
已知:在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。(1)操作①的名称是 ;(2)提炼出的贵重金属可制作奖牌,其成分是 ;(3)调节pH的主要目的是除去滤液中 (填金属离子符号);(4)写出粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应的化学方程式: 。
【答案】(1)过滤;(2)金或铂;(3)Al3+和Fe3+;(4)Cu+H2O2+H2SO4=CuSO4+2H2O。【解析】(1)操作①得到固体和液体,所以是 过滤;(2)提炼出的贵重金属可制作奖牌,其中有金或铂,所以其成分是金或铂;(3)调节pH,根据生成固体氢氧化铝和氢氧化铁,所以主要目的是除去滤液中 Al3+和Fe3+;
(4)根据信息“在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。”,可知粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应生成硫酸铜和水,对应的化学方程式为 Cu+H2O2+H2SO4=CuSO4+2H2O。
相关课件
这是一份中考化学二轮复习中考秘籍课件第08讲 中考化学计算题的解法与技巧 (含答案),共37页。PPT课件主要包含了不纯物的计算,题型4综合的计算等内容,欢迎下载使用。
这是一份中考化学二轮复习中考秘籍课件第07讲 中考化学实验探究题的解法与技巧 (含答案),共48页。PPT课件主要包含了实验探究的基本环节,解题思路,解题时注意的问题,主要探究类型等内容,欢迎下载使用。
这是一份中考化学二轮复习中考秘籍课件第06讲 中考化学推断题的解法与技巧 (含答案),共53页。PPT课件主要包含了解推断题的重要技巧,做推断题的思考方法,知识储备,推断题的解题思路,智慧闯关,题型2框图型推断题,表格型等内容,欢迎下载使用。








