

辽宁省凌源市凌源实高2022-2023学年高二下学期4月月考化学试题(Word版含答案)
展开
这是一份辽宁省凌源市凌源实高2022-2023学年高二下学期4月月考化学试题(Word版含答案),共12页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。
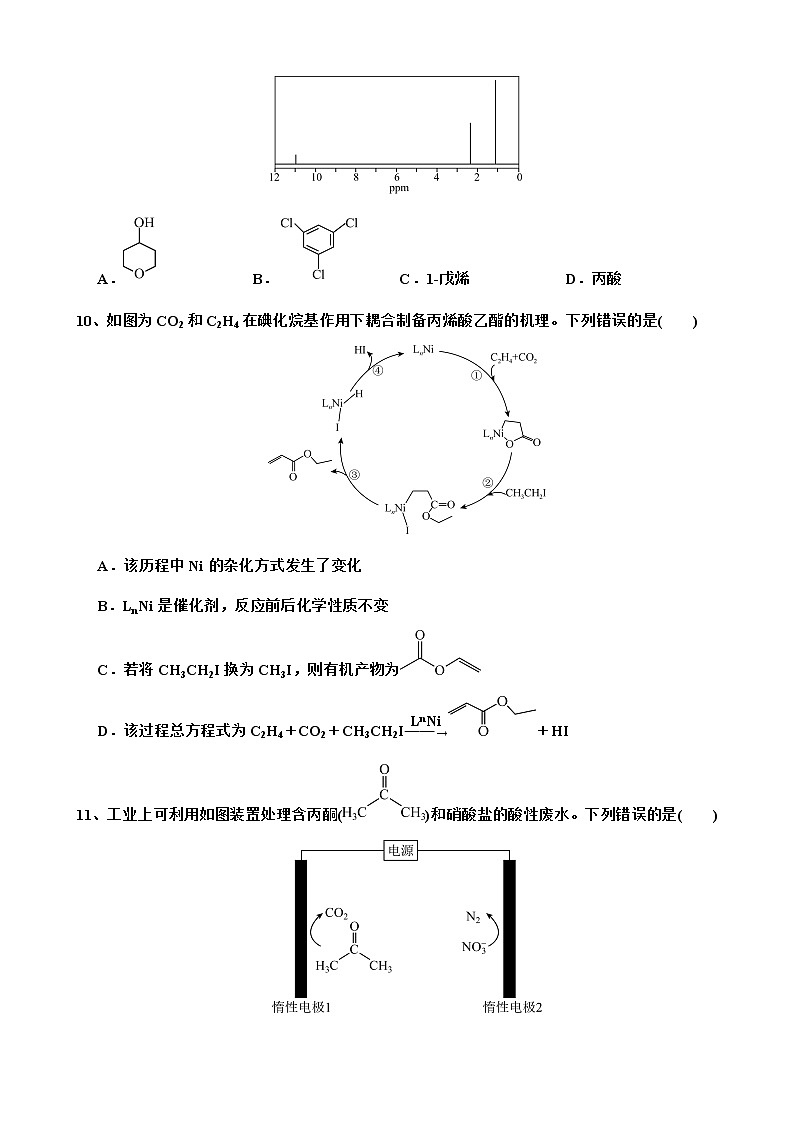
凌源实高2022-2023学年高二下学期4月月考化学试卷可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 Ti-48 Fe-56一、选择题(每题3分,共45分,每小题有且仅有一个正确选项)1、辽宁省历史久远,物产丰富。下列说法中正确的是( )A.老龙口白酒中所含的乙醇属于烃类B.高锰酸钾溶液能氧化乙烯,可用浸泡过高锰酸钾溶液的硅藻土保鲜丹东草莓C.辽宁省将积极推进钢铁材料技术创新,其自主研发的耐蚀钢属于新型无机非金属材料D.冰封的辽河河面融化过程属于吸热反应2、下列实验装置正确或操作能达到目的的是( ) 图甲 图乙 图丙 图丁A.图甲:蒸馏时的接收装置 B.图乙:苯甲酸的重结晶C.图丙:除去实验室所制乙烯中的少量SO2 D.图丁:证明乙炔可使溴水褪色3、抗癌药阿霉素与环糊精在水溶液中形成超分子包合物,增大了阿霉素的水溶性,控制了阿霉素的释放速度,从而提高其药效。下列说法错误的是( )A.阿霉素分子中碳原子的杂化方式为sp2、sp3B.红外光谱法可推测阿霉素分子中的官能团C.阿霉素分子含有羟基、羧基和氨基D.阿霉素分子中,基态原子的第一电离能最大的元素为N4、下列有机物命名错误的是( )A.2,2-二甲基丙烷 B.2-甲基-4-乙基-1-己烯 C.3-甲基-1-丁烯 D.1,2-二溴-3-丁烯5、下列有关物质的性质规律正确的是( )A.键角:ClO<ClO<ClOB.酸性:CH3COOH>CCl3COOH>CF3COOHC.乙醇在水中的溶解度小于丁醇(CH3CH2CH2CH2OH),可以用相似相溶原理解释D.噻吩()相对分子质量大于吡咯(),故噻吩的沸点高于吡咯6、下列有关化合物结构与性质的论述错误的是( )A.B3N3H6(无机苯)的结构与苯相似,其中形成大π键的电子全部由N提供B.根据原子半径推知,F-F键的键能大于Cl-Cl键,F2化学性质更稳定C.NH3的成键电子对间排斥力较大,所以NH3的键角比PH3大D.BF3和SO2中B、S杂化轨道类型相同,二者VSEPR模型均为平面三角形7、下列关于有机物的分离提纯的说法中正确的是( )A.碘在酒精中的溶解度大,可用酒精将碘水中的碘萃取出来B.分液操作时,先把上层液体从上口倒出去,再把下层液体从下口放出来C.将工业酒精直接蒸馏可以获得无水酒精D.在重结晶法提纯苯甲酸实验中,为减少苯甲酸的损失,一定要趁热过滤8、下列不属于与 H2发生1:1加成产物的是( )A. B. C. D.9、某有机物的1H核磁共振氢谱图如图所示,该有机物可能是( )A. B. C.1-戊烯 D.丙酸10、如图为CO2和C2H4在碘化烷基作用下耦合制备丙烯酸乙酯的机理。下列错误的是( )A.该历程中Ni的杂化方式发生了变化B.LnNi是催化剂,反应前后化学性质不变C.若将CH3CH2I换为CH3I,则有机产物为D.该过程总方程式为C2H4+CO2+CH3CH2I+HI11、工业上可利用如图装置处理含丙酮()和硝酸盐的酸性废水。下列错误的是( )A.丙酮中的官能团名称为酮羰基B.惰性电极1上发生氧化反应C.惰性电极2上的电极反应式为2NO+10e-+12H+===N2↑+6H2OD.相同时间内,阴极和阳极产生的气体物质的量之比为8:3012、沃斯田铁是钢铁的一种层片状的显微组织,通常是γ-Fe中固溶少量碳的无磁性固溶体,因铁原子构成的八面体间隙较大,可以容纳更多的碳,其立方晶胞如图所示。设NA表示阿伏加德罗常数的值,下列有关沃斯田铁的说法错误的是( )A.化学式为FeCB.Fe周围等距且最近的Fe有12个C.6.8g晶体中含有Fe原子构成的八面体空隙数目为0.4NAD.设晶胞参数为anm,晶体的密度为g/cm313、以废旧锌锰电池中的黑锰粉[含有MnO2、MnO(OH)、NH4Cl和少量ZnCl2、炭黑、氧化铁等]为原料制备MnCl2,实现锰再利用的工艺流程如下,下列说法正确的是( )A.“过程Ⅰ”的加热操作在实验室用到的仪器主要有酒精灯、蒸发皿、泥三角、三脚架等B.“溶液a”的主要成分为可溶于水的ZnCl2C.“过程Ⅲ”得到的MnCl2溶液蒸发结晶即可获得MnCl2‧4H2OD.“过程Ⅱ”中锰转化反应的离子方程式为MnO2+H2O2+2H+Mn2++2H2O+O2↑14、下列实验操作能达到实验目的的是( )选项实验目的实验操作A测定氯水的pH将待测液滴在湿润的pH试纸上,与标准比色卡对照B比较Ksp(AgCl)与Ksp(AgI)大小向AgCl悬浊液中滴加几滴0.1mol/LNaI溶液,观察现象C电解法制备氯气将电源两极分别与两铁片相连,再将铁片插入饱和食盐水中D润洗滴定管用标准液润洗滴定管后,将润洗液全部从滴定管上口倒出15、室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是( )A.Kb2的数量级为10-8B.X(OH)NO3水溶液显碱性C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)=c(X2+)+c(H+)二、填空题(共4个小题,共55分)16、氮族元素是一类重要元素,广泛应用于生产生活,特别是在医药、纳米材料制备中。(1)氮化硼(BN)是由氮原子和硼原子所构成的晶体。工业上制备氮化硼的一种方法为BCl3(g)+NH3(g)===BN(s)+3HCl(g)。形成BCl3时,基态B原子价电子层上的电子先激发再杂化,激发时B原子的价电子轨道表示式可能为________(填标号)。A. B. C. D.(2)肼(N2H4)和偏二甲肼[(CH3)2NNH2]均为无色液体,属于同系物,是常用的火箭推进剂,其熔沸点如表,二者熔沸点差异较大的主要原因是______________________________________________________________________________________________________________________。物质肼偏二甲肼熔点1.4℃-58℃沸点113.5℃63.9℃(3)Al掺杂的氮化钛晶胞结构如图所示。距离Ti最近的Al有________个,已知阿伏加德罗常数的值为NA,若晶体的密度为ρg/cm3,该晶胞的边长为__________________pm(列出算式)。(4)吡啶()是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。+ MPy EPy VPy phen①MPy的分子式为___________,分子中的大π键可用π表示,则吡啶中大π键表示为___________。②MPy→ Epy的反应类型为________________。③邻二氮菲(phen,结构如图)中的N与吡啶中N的杂化方式一致,邻二氮菲通过N原子与Fe2+形成稳定的配合物[Fe(phen)3]2+,该配合物的特征颜色可测定Fe2+的浓度。[Fe(phen)3]2+中Fe2+的配位数为________;实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,试分析原因是______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。17、一种从阳极泥(主要成分为Cu、Ag、Pt、Ag2Se、Se和Cu2S等)中回收Se和贵重金属的工艺流程如图所示。回答下列问题:已知:该工艺中萃取与反萃取原理为:2RH+Cu2+R2Cu+2H+(1)已知Ag为47号元素,Ag在元素周期表中的位置为____________________________。(2)“焙烧”产生的SO2与SeO2的混合烟气可用水吸收制得单质Se,该反应的化学方程式为_______________________________________________________________________________;过滤所得粗硒可采用减压蒸馏的方法提纯单质硒,采用减压蒸馏的目的是______________________________________________________________________________________________。(3)“酸浸氧化”中通入氧气的目的是_______________________________________________;“反萃取剂”最好选用_______________(填化学式)。(4)沉银时加入NaCl,可将Ag转化为AgCl,再用硫代硫酸盐溶液浸出银元素。已知:①AgCl+2S2O[Ag(S2O3)2]3-+Cl- K1=6.66×103②Ag++2S2O[Ag(S2O3)2]3- K2=3.7×1013溶液中c(Cl-)>_______________mol/L时,可使所得浸出液中c(Ag+)<10-5mol/L。(5)“滤液Ⅳ”中含有Na2SO3和Na2S2O3,则“还原”中发生反应的离子方程式为___________________________________________________________________________。(6)研究发现,硫代硫酸盐浸出金的过程是电化学催化腐蚀过程,催化机理模型如图所示:图中表示金粒负极的电极反应式为_________________________________________________。浸金过程中的催化剂是_________________________(填化学式)。18、乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以合成诸多化合物。 (1)乙炔的电子式为____________________________。(2)以乙炔为原料可制氯丁橡胶,其过程包括如下反应: 氯丁橡胶①已知A的分子式为C4H4,A的结构简式为______________________________。②用系统命名法为B命名,则B的名称为_______________________________。 ③B→氯丁橡胶的反应的化学方程式为_____________________________________________。(3)聚丙烯腈俗称人造羊毛,以乙炔为原料制聚丙烯腈的过程包括如下反应:①M的化学式为___________________;②C的结构简式为_______________________,分子中碳原子的杂化方式为_______________。19、甲醇是重要的化工原料,也是目前推广的车用燃料。已知:①2CH4(g)+O2(g)2CO(g)+4H2(g) ΔH1=-71.0 kJ/mol②CO(g)+2H2(g)CH3OH(g) ΔH2=-90.5 kJ/mol(1)反应CH4(g)+O2(g)CH3OH(g)的ΔH=____________ kJ/mol。(2)在某温度下,向体积为1 L的恒容密闭容器中充入CO与H2的混合气体,发生反应②。测得平衡混合物中CH3OH(g)的体积分数[φ(CH3OH)]与起始投料比Z[Z=]的关系如图。 ①当Z=2时,CO的平衡转化率a=____________。②当Z=2,平衡时压强为1 MPa,该温度下平衡常数KP=______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。③当Z=3时,反应达到平衡状态后,CH3OH的体积分数可能是图中的_______(填“C”"“D”或“E")点。(3)CH4在新型铱基电催化剂作用下,转化为甲醇。其工作原理如图所示,写出生成甲醇的电极反应式______________________________________________________,维持电流强度为4.288A,电池工作30 min,理论上消耗CH4的质量为_________。(已知F=96480 C/mol)(4)研究表明,CO2和H2在一定条件下也可以合成甲醇,涉及的主要反应为反应I:CO2(g)+3H2(g)CH3OH(g)+H2O(g);反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)①维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:(甲醇的选择性=×100%)T(K)CO2实际转化率(%)甲醇选择性(%)54312.342.355315.339.1表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是_____________________________________________________________________________________。②向V L恒容密闭容器中充入a mol CO2和b mol H2,在一定温度和催化剂作用下合成甲醇,达到平衡时测得CO2的转化率为x,甲醇的选择性为y,则该温度下,反应I的平衡常数为 _________________________________。(列出计算表达式) 化学试卷答题卡一、选择题(每题3分,共45分,每小题有且仅有一个正确选项)题号123456789101112131415答案 二、填空题(共4个小题,共55分)16、(1) ________。(2) ______________________________________________________________________。(3) ________,______________________________。(4)①______________,________________。②________________。③________; _________________________________________________________________________________________________________________________________________________________________________________________________________________________。17、(1) ________________________________。(2)__________________________________________________________________________; ___________________________________________________________________________。(3)___________________________________________ ______________;______________。(4)_______________。(5)__________________________________________________________________________。(6)_______________________________________________________________________。__________________________________________。18、(1) ________________________。(2)①______________________________。②_______________________________。③_________________________________________________________________________。(3)①_______________;②__________________________,_______________________。19、(1)________________。(2)①_______________________。②______________________。③_______________。(3)_________________________________________________________,___________。(4)_________________________________________________________________________。(5)____________________________________。
相关试卷
这是一份辽宁省凌源市2022-2023学年高二下学期期末联考化学试题(含解析),共22页。试卷主要包含了单选题,实验题,工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。
这是一份辽宁省凌源市2022-2023学年高二下学期4月联考化学试题(Word版含答案),共11页。试卷主要包含了本试卷分选择题和非选择题两部分,本卷命题范围,可能用到的相对原子质量,下列关于和的说法错误的是,实验室用检验的离子方程式为等内容,欢迎下载使用。
这是一份2022-2023学年辽宁省凌源市高二11月月考化学 Word版,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。








