

吉林省2022-2023学年高一下学期周测一化学试卷(含答案)
展开吉林省2022-2023学年高一下学期周测一化学试卷
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1、某地盐湖中含有大量的以及少量杂质,欲在实验室模拟从该盐湖水中获得纯净的,设计了如下步骤:
①取盐湖水于烧杯中
②加入过量溶液
③在滤液中加入盐酸至不再产生气泡
④加入过量溶液
⑤加入过量溶液
⑥过滤
⑦转移溶液至蒸发皿,蒸发溶液至有大量晶体出现
其中正确的操作步骤是( )
A.①②③④⑤⑥⑦ B.①⑤④②⑥③⑦ C.①④②⑤⑥③⑦ D.①②⑤④③⑥⑦
2、化学与生活密切相关。下列有关说法正确的是( )
A.S粉可除去温度计破碎时洒落的
B.可用作计算机芯片
C.具有氧化性,可用作食品抗氧化剂
D.电池体积很小,所含污染物有限,可随意丢弃
3、俗话说“一场雷雨一场肥”,其中蕴含的化学知识如下:①(吸热反应)、②、③,硝酸再与土壤中的矿物质作用转化成农作物可利用的硝酸盐。下列有关说法错误的是( )
A.反应①属于氮的固定
B.反应①中既是氧化产物又是还原产物
C.反应①中反应物的总键能小于生成物的总键能
D.由反应③可知不可用排水法收集
4、下列物质能使高锰酸钾溶液褪色,且褪色原理相同的是( )
①活性炭
②溶液
③
④稀硫酸
⑤溶液
A.②③⑤ B.②③④ C.①②④ D.①③⑤
5、设为阿伏加德罗常数的值。下列说法中正确的是( )
A.1的溶液中,含的数目为
B.6.4gCu与足量S粉充分反应,转移的电子数目为0.2
C.46g由与组成的混合气体中含N原子的数目为
D.标准状况下,将2.24L通入足量水中,生成的HClO分子的数目为0.1
6、图是硫元素的价类二维图。下列说法正确的是( )
A.a的电离方程式为
B.溶液d久置空气中,pH将减小
C.g对热均稳定
D.铜与e的浓溶液共热,所得气体通入溶液中,生成白色沉淀
7、“空气变面包,氨功不可没”。下列说法正确的是( )
A.易液化,故液氨可作喷泉实验
B.氨气是碱性气体,不能选择浓硫酸干燥,可用干燥
C.氨遇到浓盐酸、浓硫酸都会发生反应,产生白烟
D.合成氨是人工固氮重要途径
8、铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和、NO的混合气体,将这些气体与1.68L(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入3溶液至恰好完全沉淀,消耗NaOH溶液的体积是( )
A.100mL B.60mL C.80mL D.10mL
9、中国的量子通信、5G技术在世界上处于领先地位。下列说法不正确的是( )
A.“北斗”全球导航卫星计算机的芯片材料是高纯度二氧化硅
B.光导纤维被广泛应用于光缆通讯,其成分是二氧化硅
C.高温结构陶瓷是制作导弹、火箭的理想材料
D.玻璃、水泥、陶瓷属于硅酸盐产品
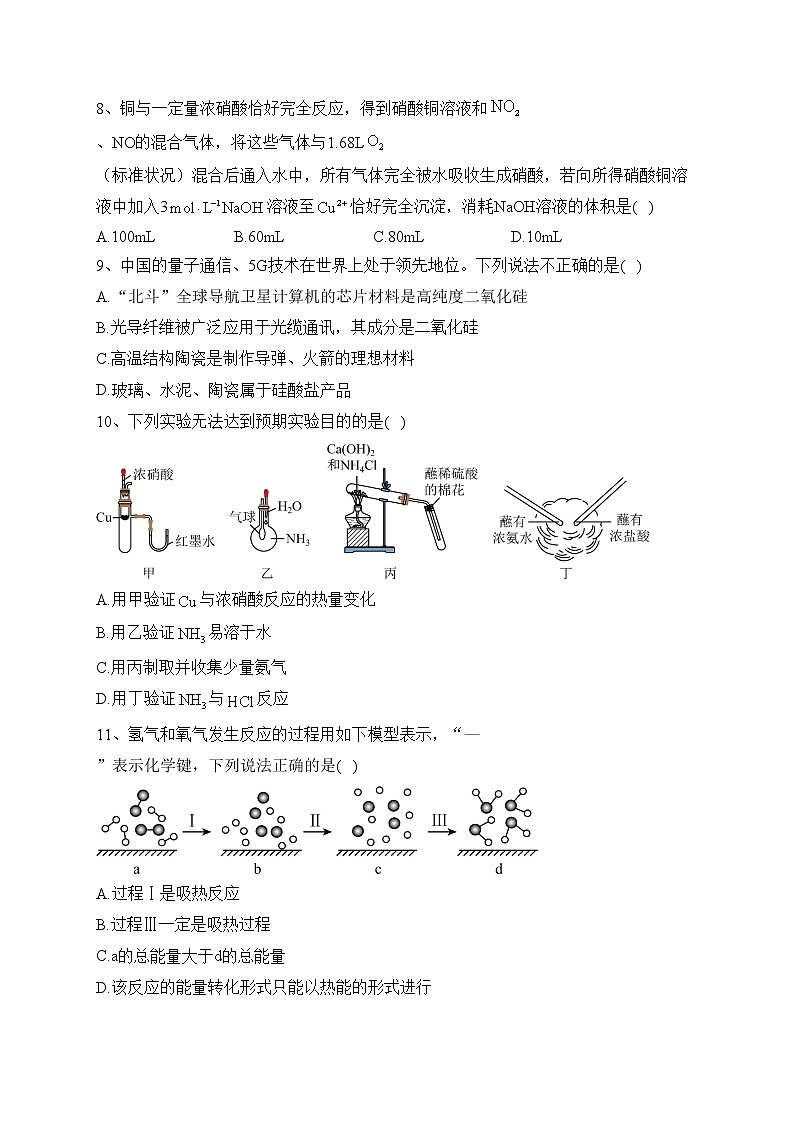
10、下列实验无法达到预期实验目的的是( )
A.用甲验证与浓硝酸反应的热量变化
B.用乙验证易溶于水
C.用丙制取并收集少量氨气
D.用丁验证与反应
11、氢气和氧气发生反应的过程用如下模型表示,“—”表示化学键,下列说法正确的是( )
A.过程Ⅰ是吸热反应
B.过程Ⅲ一定是吸热过程
C.a的总能量大于d的总能量
D.该反应的能量转化形式只能以热能的形式进行
12、某科研机构研发的NO—空气质子交换膜酸性电池工作原理如下图所示(已知:Pt电极对电极反应有催化作用);当该电池工作一段时间后,下列叙述正确的是( )
A.“多孔”电极对化学反应速率没有影响
B.具有催化作用的电极能提高电极反应的活化能
C.Pt(B)电极的电极反应式为
D.若有生成,则有向Pt(B)电极区域移动
13、恒温、恒容的密闭容器中进行反应:A(g)+B(g)C(g),若反应物的浓度从2降到0.8需20 s,那么反应物浓度由0.8降到0.2所需的反应时间( )
A.10s B.大于10s C.小于10s D.无法判断
14、把下列四种X溶液分别加入四个盛有盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应其中反应最快的是( )
A.10℃的X溶液 B.20℃的X溶液
C.20℃的X溶液 D.10℃的X溶液
15、在催化剂的作用下与氢气作用制取的反应机理如图所示,下列说法正确的是( )
A.催化剂不参与反应过程
B.是中间产物
C.该过程的总反应是
D.的过程是放热过程
二、填空题
16、如图为原电池装置示意图:
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,做负极的分别是__________。
a.铝片 铜片
b.铜片 铝片
c.铝片 铝片
d.铜片 铜片
(2)若A为Pb,B为,电解质为溶液,工作时的总反应式为。写出B电极反应式:______________________________;该电池工作时,A电极的质量将__________(填“增加”、“减小”或“不变”)。若该电池反应消耗了0.1 mol,则转移电子的数目为__________。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入和,该电池为甲烷燃料电池,写出A电极反应式:______________________________。该电池工作一段时间后,溶液的碱性将__________(填“增加”、“减弱”或“不变”)
17、Ⅰ.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图:
(1)该反应的化学方程式为_____________________,从反应开始到10s时,Y的转化率为_______,如果想加快该反应速率,可采取的措施有______________。(写两条)
Ⅱ.把0.5mol X气体和0.6mol Y气体混合于2L的恒容密闭容器中,使它们发生如下反应:4X(g)+5Y(g)nZ(g)+6W(g),2min末生成0.6mol W,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算:
(2)前2min内用X的浓度变化表示的平均反应速率为_______;
(3)2min末时Y的浓度为_______;
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的_______倍。
Ⅲ.工业上用CO生产燃料甲醇,一定条件下发生反应:,反应过程中的能量变化情况如图所示。曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。
(5)计算当反应生成1.5mol(g)时,能量变化值是___________kJ。
(6)推测反应是___________(填“吸热”或“放热”)反应。
参考答案
1、答案:B
解析:除杂质分别采用、NaOH和,为了保证杂质除尽,除杂试剂应过量,同时为了不引入杂质必须保证溶液在溶液之前加入(否则会引入新的杂质钡离子),将钙离子、镁离子和硫酸根离子转化为沉淀之后过滤除去,加入适量的盐酸除去过量的氢氧根和碳酸根离子,最后蒸发结晶,由此可知正确的操作步骤是①⑤④②⑥③⑦,故选B。
2、答案:A
解析:A.将S粉撒到水银的表面,其可以和水银发生化学发应,减少水银蒸发,故A正确;
B.单质可用作计算机芯片,故B错误;
C.二氧化硫是国内外允许使用的一种食品添加剂,在食品工业中发挥着护色、防腐、漂白和抗氧化的作用,起抗氧化作用过程中表现出还原性,故C错误;
D.废旧电池不能随意丢弃,故D错误;
故答案选A。
3、答案:C
解析:A.闪电能使空气里的氮气转化为一氧化氮,属于自然固氮,故A正确;
B.中,既是氧化产物又是还原产物,故B正确;
C.为吸热反应,反应物的总键能大于生成物的总键能,故C错误;
D.能与水反应,所以不能用排水法收集,故D正确;
故答案选C。
4、答案:A
解析:①活性炭具有吸附性,能吸附有色离子或分子,因此可以使高锰酸钾褪色;②溶液具有强的还原性,可与高锰酸钾发生氧化还原反应使其褪色;③具有强的还原性,可与高锰酸钾发生氧化还原反应使其褪色;④稀硫酸不能使高锰酸钾溶液褪色;⑤具有强的还原性,可与高锰酸钾发生氧化还原反应使其褪色;由此可知褪色原理相同的是②③⑤;
故选:A。
5、答案:C
解析:A.溶液的体积未知,无法计算含的数目,A错误;B.6.4gCu物质的量为0.1mol,与足量S粉充分反应生成,则转移的电子数目为0.1,B错误;C.与的最简式均为,46g的物质的量为1mol,则含N原子的数目为,C正确;D.氯气与水反应为可逆反应,则标准状况下,将2.24L即1mol通入足量水中,生成的HClO分子的数目小于0.1,D错误;故选C。
6、答案:B
解析:
7、答案:D
解析:A.易液化,故液氨可作制冷剂,故A错误;
B.氨气与发生络合反应,不能用干燥氨气,故B错误;
C.氨气遇到浓盐酸发生反应生成氯化铵,产生白烟,氨气和硫酸反应生成硫酸铵,硫酸不挥发,不能产生白烟,故C错误;
D.氮气和氢气反应生成氨气,合成氨是人工固氮重要途径,故D正确;
选D。
8、答案:A
解析:1.68L 标准状况下的物质的量为n()==0.075mol,、NO的混合气体与1.68L(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸,根据电子转移守恒,Cu提供的电子物质的量等于氧气获得电子的物质的量,等于反应产生结合的的物质的量,根据元素守恒可得n(NaOH)=0.075mol×4=0.30mol,由于NaOH溶液的浓度是3mol/L,故需要氢氧化钠溶液的体积是V==0.1L=100mL;
答案选A。
9、答案:A
解析:A.计算机的芯片材料是高纯度硅,而二氧化硅用于生产光纤,A不正确;B.光导纤维能对光进行全反射,用于生产光缆,主要成分是二氧化硅,B正确;C.高温结构陶瓷的耐高温性能好,且抗腐蚀能力强,是制作导弹、火箭的理想材料,C正确;D.玻璃、水泥、陶瓷的主要成分都是硅酸盐,它们属于传统硅酸盐产品,D正确;故选A。
10、答案:C
解析:A.观察到U形管左边的红墨水向下移动,说明Cu与浓硝酸反应能放出热量,A项正确;
B.气球会迅速膨胀变大,说明易溶于水,B项正确;
C.氨气密度小于空气,应该用向下排空气法收集,C项错误;
D.蘸有浓氨水和浓盐酸的玻璃棒靠近能生成白烟,说明和HCl发生了反应,D项正确。
答案选C。
11、答案:C
解析:A.过程Ⅰ分子化学键断裂形成原子,属于吸热过程,A错误;
B.过程Ⅲ为新化学键形成的过程,是放热过程,B错误;
C.氢气燃烧放热,则a的总能量大于d的总能量,C正确;
D.该反应可通过燃料电池,实现化学能到电能的转化,不一定只能以热能的形式进行,D错误;
故答案为:C。
12、答案:D
解析:A.“多孔”电极有利于增大气体的接触面积,增大反应速率,选项A错误;
B.具有催化作用的电极能降低电极反应的活化能,选项B错误;
C.Pt(B)电极的电极反应式为,选项C错误;
D.Pt(A)电极为负极,失电子发生氧化反应,其电极反应式为:,若有1mol生成,则有向Pt(B)电极区域移动,选项D正确;
答案选D。
13、答案:B
解析:由题意可知,反应物的浓度由降到需要20s,平均反应速率,假设以的反应速率计算反应物的浓度由降到所需反应时间,,但随着反应的进行,反应物的浓度减小,化学反应速率逐渐减小,则反应物的浓度由降到的平均反应速率小于,所用时间应大于10s,故选B。
14、答案:B
解析:计算出稀释后的四种溶液中X的物质的量,由于最后溶液的体积都为50mL,则X的物质的量越大,X的浓度越大,而一般情况下,反应物浓度越大、温度越高,反应速率越快。A中X的物质的量为;B中X的物质的量为;C中X的物质的量为;D中X的物质的量为。显然四种情况下,X的浓度:A=B>C>D,而温度:B=C>A=D,故B的反应速率最快。
15、答案:C
解析:
16、答案:(1)b
(2);增加;0.1
(3);减弱
解析:(1)铝片和铜片用导线相连,插入浓硝酸中,Cu作负极、Al作正极;铝片和铜片用导线相连,插入烧碱溶液中,Al作负极、Cu为正极,
故答案为:b;
(2)若A为Pb,B为,电解质为溶液,工作时的总反应式为,则B电极为正极,正极反应式为,该电池在工作时,A电极上生成,质量将增加,由电池反应可知消耗2mol转移2mol电子,则若该电池反应消耗了0.1 mol,则转移电子的数目为0.1;
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入和,该电池即为甲烷燃料电池,A电极为负极,负极反应式为;由于消耗氢氧根离子,该电池工作一段时间后,溶液的碱性将减弱。
17、答案:(1)X+Y2Z;79.0%;升高温度或者增大压强
(2)0.1mol/(L·min)
(3)0.05mol/L
(4)
(5)136.5
(6)吸热
解析:(1)X、Y物质的量先减少后不变,X、Y是反应物,Z物质的量先增多后不变,Z是生成物,且该反应是可逆反应,10s内X、Y、Z的物质的量变化分别为0.79mol、0.79mol、1.58mol,物质的量变化比等于系数比,所以该反应的化学方程式为X+Y2Z,从反应开始到10s时,Y的转化率为;根据影响反应速率的因素,想加快该反应速率,可采取的措施有升高温度或者增大压强;
(2)根据反应方程式,2min末生成0.6mol W,则反应消耗0.4molX,前2min内用X的浓度变化表示的平均反应速率为mol/(L·min);
(3)根据反应方程式,2min末生成0.6molW,则反应消耗0.5molY,2min末时Y的浓度为0.05mol/L;
(4)2min末生成0.6mol W,以W的浓度变化表示的反应速率为mol/(L·min) ,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),则n=2, ,恢复到反应前温度,压强比等于物质的量比,体系内压强是反应前压强的倍。
吉林省2022-2023学年高一下学期周测化学试卷(含答案): 这是一份吉林省2022-2023学年高一下学期周测化学试卷(含答案),共14页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
2022-2023学年吉林省辉南县第六中学高二下学期周测(六)化学试题含答案: 这是一份2022-2023学年吉林省辉南县第六中学高二下学期周测(六)化学试题含答案,共8页。试卷主要包含了单选题,推断题等内容,欢迎下载使用。
2020邯郸大名中学高一(清北班)下学期6月第二周周测化学试题含答案: 这是一份2020邯郸大名中学高一(清北班)下学期6月第二周周测化学试题含答案,共19页。












