









所属成套资源:新人教版化学选择性必修1课件PPT+教案全册
- 《盐类的水解》第二课时课件PPT+教学设计 课件 23 次下载
- 《盐类的水解》第三课时课件PPT+教学设计 课件 24 次下载
- 《沉淀溶解平衡》第一课时课件PPT+教学设计 课件 25 次下载
- 《沉淀溶解平衡》第二课时课件PPT+教学设计 课件 25 次下载
- 《原电池》第一课时课件PPT+教学设计 课件 30 次下载
高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学ppt课件
展开
这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学ppt课件,文件包含《盐类的水解》第四课时课件pptx、《盐类的水解》第四课时教学设计docx等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
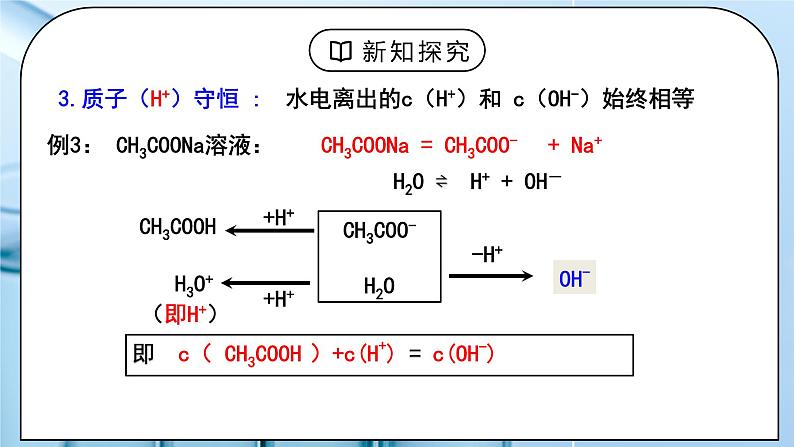
(人教版高中化学选择性必修1)《盐类的水解》第四课时 教学设计课题名《盐类的水解》第四课时教材分析本节内容在学习了盐类水解的应用之后,主要要求学生掌握溶液中存在的三大守恒:电荷守恒、物料守恒、质子守恒,比较溶液中微粒浓度的大小关系。这些内容都是高考的常考点,也是学生容易丢分的题型。教学目标宏观辨识与微观探析:根据电解质的电离、弱离子的水解,判断溶液中微粒的种类。证据推理与模型认知:书写溶液中存在的三大守恒:电荷守恒、物料守恒、质子守恒,比较溶液中微粒浓度的大小关系。教学重点 溶液中存在的三大守恒、比较溶液中微粒浓度的大小关系。教学难点 溶液中存在的三大守恒、比较溶液中微粒浓度的大小关系。教学方法讲解,举例教学准备教师准备:PPT学生准备:预习课本教学过程一、新课导入1.电解质的电离、弱离子的水解教师:要求学生复习回顾电解质的电离、弱离子的水解。学生:回顾电解质的电离、弱离子的水解的知识。[设计意图]根据电解质的电离、弱离子的水解,能判断溶液中微粒的种类。为学习溶液中存在的三大守恒、溶液中微粒浓度的大小关系比较做准备。二、探究新知1.一、溶液中的守恒关系教师:1.电荷守恒 :本质:溶液呈电中性规律:在溶液中所有阳离子所带的正电荷总数=所有阴离子所带的负电荷总数所有阳离子的电荷浓度之和 = 所有阴离子的电荷浓度之和解题关键:①准确判断溶液中的离子的种类;②注意每个粒子所带的电荷数,即Rn+的电荷浓度为nc(Rn+)例1:Na2CO3溶液中: 阳离子:Na+ 、H+ 阴离子:OH– 、 CO32– 、 HCO3– ∵ 正电荷总数 = 负电荷总数 c(Na+)+c(H+)=c(HCO3-)+c(OH-)+ 2c(CO32-)思考:碳元素存在于哪几种微粒中?这些微粒和钠离子物质的量之间有什么关系?物料守恒(原子守恒) 溶液中某一元素的原始浓度等于该元素在溶液中各种存在形式的浓度之和解题关键:①抓住电解质化学式中特定元素的原子间的定量关系;②找出特定元素原子在溶液中的所有存在形式例2:0.1 mol / L Na2CO3 溶液中:c (CO32–) + c (HCO3–) + c (H2CO3) = 0.1mol / Lc (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]3.质子(H+)守恒 : 水电离出的c(H+)和 c(OH-)始终相等例3: CH3COONa溶液:c( CH3COOH )+c(H+) = c(OH-)例4. Na2S溶液的质子守恒:c(HS- )+c(H+) +2c(H2S)=c(OH-)质子守恒可由物料守恒和电荷守恒联合求得学生:练习1:写出下列溶液中的电荷守恒式:(1)CH3COONa溶液(2)NH4Cl溶液:(3)NaHCO3溶液(4)Na2CO3和K2SO3的混合溶液 练习2:写出CH3COONa、NaHCO3溶液中的物料守恒式。NaHCO3溶液的质量守恒:c (Na+)=c (HCO3–) + c (CO32–) + c (H2CO3)练习3:写出NaHCO3溶液中的质子守恒式。[设计意图]让学生学会书写电荷守恒、物料守恒、质子守恒2.二、水溶液中的离子浓度大小的比较教师:1.单一溶液(1)弱酸或弱碱溶液① 弱电解质电离是微弱的如: NH3 · H2O 溶液中:c (NH3 · H2O)> c (OH–)> c (NH4+)> c (H+) ② 多元弱酸电离是分步,主要决定第一步如:H2S溶液中:c (H2S)> c (H+)> c (HS–)> c (S2–)> c (OH–)(2)可水解的盐(正盐)溶液① 水解是微弱的如:NH4Cl 溶液中:c (Cl–)> c (NH4+)> c (H+)> c (NH3·H2O)> c (OH–)② 多元弱酸水解是分步,主要决定第一步如:Na2CO3 溶液中:c (Na+)> c (CO3–)> c (OH–)> c (HCO3–)> c (H+)(3)强碱弱酸的酸式盐溶液显酸性:NaHSO3、NaH2PO4溶液 (以电离为主)显碱性:NaHCO3、Na2HPO4、NaHS溶液(以水解为主)理论依据:电离、水解都是微弱的电离、水解都以第一步为主考虑水的额外电离(4)不同溶液中同一离子浓度大小的比较例5:等物质的量的下列溶液中,NH4+的浓度由大到小的顺序是①NH4Cl ②NH4HCO3 ③ NH4HSO4 ④ NH4NO3 ⑤(NH4)2SO4 ⑥(NH4)2Fe(SO4) ⑦(NH4)2CO3 解题关键:其他离子对平衡移动的影响⑥>⑤>⑦>③>①=④>②2.两种溶液混合(1)只混合不反应——等浓度的弱酸或弱碱与其盐溶液等体积混合思考:浓度均为0.1mol/L的CH3COOH与CH3COONa混合溶液中存在哪些微粒?这些微粒的浓度从大到小该如何排序?解题关键:分析水解程度与电离程度的相对大小,才能判断不水解离子与水解离子浓度的相对大小c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。(2)只混合不反应——等浓度的两种盐溶液等体积混合例6:等浓度的Na2CO3溶液和NaHCO3溶液等体积混合后,溶液中的:离子浓度大小关系: 电荷守恒: 物料守恒:质子守恒: (2)混合后反应—— 两溶液恰好反应完例7:在10 mL 0.1mol·L-1NaOH溶液中加入同体积、同浓度CH3COOH溶液,反应后溶液中各微粒的浓度大小顺序?相当于盐溶液c (Na+)>c (Ac-)>c (OH-)>c (H+)(2)混合后反应—— 两溶液未反应完例8:把0.02 mol·L-1 CH3COOH溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( ) A、c(CH3COO -)>c(Na+) B、c(CH3COOH)>c(CH3COO -) C、2c(H+)=c(CH3COO -)-c(CH3COOH) D、c(CH3COOH) + c(CH3COO -)=0.01 mol·L-1学生:练习4:写出下列浓度均为0.1mol/L的混合溶液中离子浓度的大小顺序NH3·H2O与NH4Cl溶液 (已知Kb =1.75 ×10-5 )HClO与NaClO溶液 (PH=8)HCN与NaCN溶液 (已知Ka =6.2 ×10-10 )练习5:将0.4 mol/LNH4Cl溶液和0.2 mol/LNaOH溶液等体积混合后,溶液中下列微粒的物质的量关系正确的是( ) A 、c(NH4+)=c(Na+)=c(OH-)>c(NH3·H2O) B、 c(NH4+)=c(Na+)>c(NH3·H2O) >c(OH-)>c(H+) C、 c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O) D、 c(NH4+)>c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)练习6:用均为0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中 c (CH3COO–) > c (Na+),对该混合溶液的下列判断正确的是( ) A. c (OH–) > c (H+) B. c (CH3COOH) + c (CH3COO– ) = 0.2 mol/LC. c (CH3COOH) > c (CH3COO– ) D. c (CH3COO– ) + c (OH– ) = 0.2 mol/L 练习7:硫化氢的水溶液中存在动态平衡:H2SH++HS-;HS- H++S2-;H2O H++OH-。在物质的量浓度为0.1 mol·L-1的H2S溶液中,下列各离子浓度的关系正确的是( )A.c(H+)=c(HS-)+2c(S2-)+c(OH-)B.2c(H+)=2c(HS-)+c(S2-)+2c(OH-)C.c(H+)=c(HS-)+2c(S2-)D.c(H+)=2c(S2-)+c(OH-)[设计意图]让学生会比较溶液中离子浓度大小。板书设计一、溶液中的守恒关系1.电荷守恒:分别找出阴、阳离子,算出所带电荷总数,注意所带电荷数2.物料守恒:找出原子比例关系,列出存在形式3.质子守恒:找出原子比例关系,列出存在形式二、水溶液中的离子浓度大小的比较1.单一溶液2.两种溶液混合课后作业 练习册上相关习题教学反思亮点:本节课举出典型例子讲解了溶液中存在的三大守恒:电荷守恒、物料守恒、质子守恒,也详细列举了判断溶液中离子浓度的大小的几种类型。课堂教学建议:本节课内容多难度大,教师应根据学生的具体情况选择例题和练习题让学生学习。
相关课件
这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学课件ppt,文件包含《盐类的水解》第三课时课件pptx、《盐类的水解》第三课时教学设计docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教学课件ppt,文件包含《盐类的水解》第二课时课件pptx、《盐类的水解》第二课时教学设计docx等2份课件配套教学资源,其中PPT共20页, 欢迎下载使用。
这是一份高中化学第三节 盐类的水解教学ppt课件,文件包含《盐类的水解》第一课时课件pptx、《盐类的水解》第一课时教学设计docx等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。











