


预测卷02-【大题精做】冲刺2023年高考化学大题突破+限时集训(浙江专用)
展开预测卷02
(满分:52分 建议用时:55分钟)
17.(10分) 含硫物质在自然界中分布非常广泛,与我们的生活密切相关。回答下列问题:
(1)基态S原子核外电子的空间运动状态有 _______种。
(2)P、S、Cl第一电离能由大到小的顺序为_______, 化合物磺酰氯SO2Cl2的空间构型为_______,键角∠OSCl_______∠ClSCl (填“>”“<”或“=”)。
(3)SF6是一种无色、无毒、不燃的稳定气体。SF6中心原子的价层电子对数为_______,下列对SF6中心原子杂化方式推断合理的是_______ (填标号)。
A.sp2 B.sp3 C.sp3d D.sp3d2
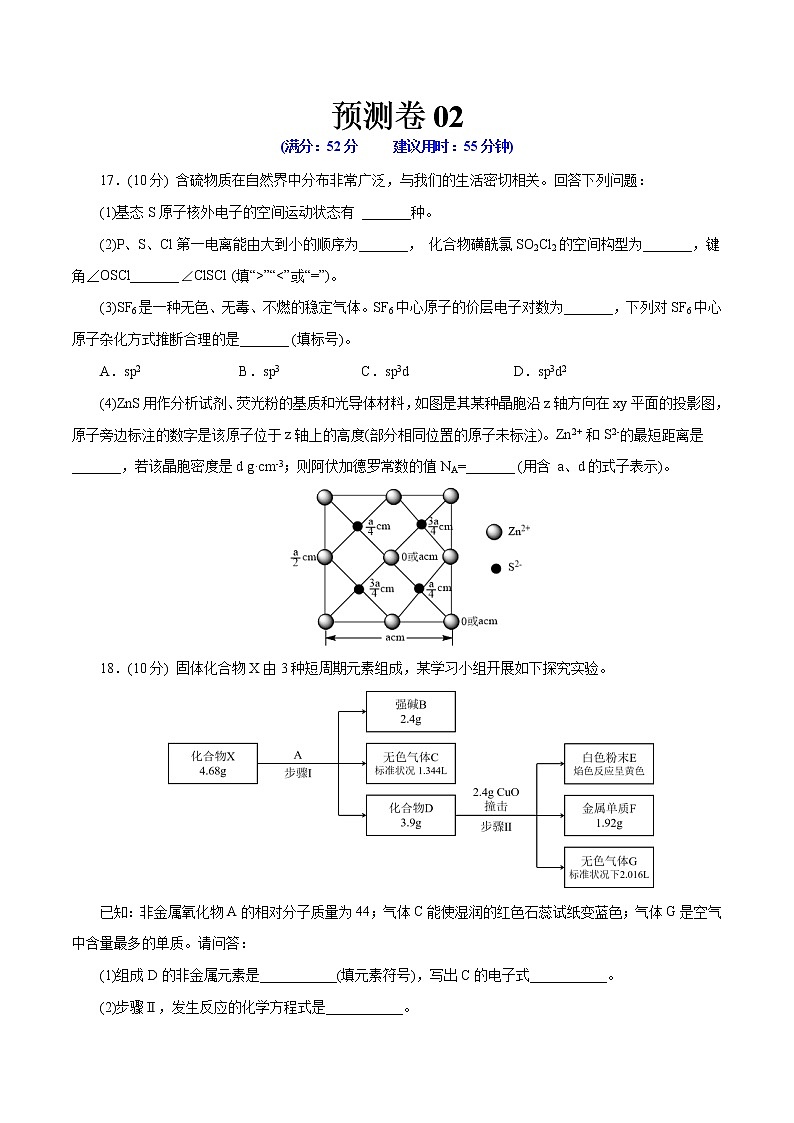
(4)ZnS用作分析试剂、荧光粉的基质和光导体材料,如图是其某种晶胞沿z轴方向在xy平面的投影图,原子旁边标注的数字是该原子位于z轴上的高度(部分相同位置的原子未标注)。Zn2+ 和S2-的最短距离是_______,若该晶胞密度是d g·cm-3;则阿伏加德罗常数的值NA=_______ (用含 a、d的式子表示)。
18.(10分) 固体化合物X由3种短周期元素组成,某学习小组开展如下探究实验。
已知:非金属氧化物A的相对分子质量为44;气体C能使湿润的红色石蕊试纸变蓝色;气体G是空气中含量最多的单质。请问答:
(1)组成D的非金属元素是___________(填元素符号),写出C的电子式___________。
(2)步骤Ⅱ,发生反应的化学方程式是___________。
(3)工业上制备X是将金属单质与液态C反应得到,写出该反应的化学方程式为___________。
(4)某同学将擦亮的单质F投入装有足量浓硫酸的大试管中,微热,有黑色和白色的固体析出,但无气体产生(已知,黑色固体由2种元素组成,金属元素质量分数为80%,难溶于水和稀硫酸,可溶于硝酸)。请设计实验验证黑色固体的组成元素___________。
19.(10分)含铁化合物是重要的基础材料。
请问答:
(1)已知:3Fe(s)+4H2O(g) Fe3O4(s)+H2(g) ΔH=-151.2kJ·mol−1 ,。△G=△H-T△S,当时,正反应是自发的,此时的逆转温度为___________K。
(2)高炉炼铁中发生的基本反应之一为:FeO(s)+CO(g) Fe(s)+CO2(g)
①在1100℃时,K=0.263,若此时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,判断反应速率(正)___________(逆),理由是___________。
②下列说法不正确的是___________。
A.须采用高温高压的反应条件使FeO还原为
B.粉碎FeO能增大接触面积从而提高反应速率
C.平衡时提高CO气体的分压有利于提高Fe的产量
D.加入CaCO3(s)后因分解产生CO2必使平衡逆向移动
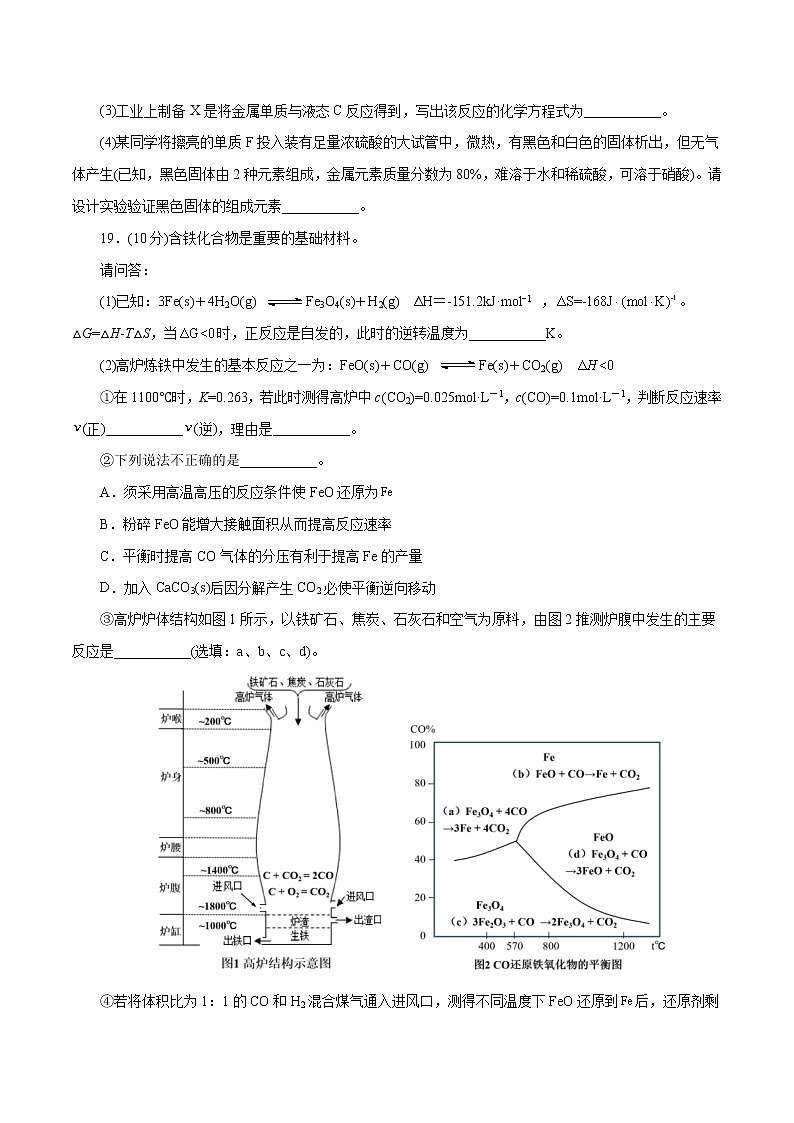
③高炉炉体结构如图1所示,以铁矿石、焦炭、石灰石和空气为原料,由图2推测炉腹中发生的主要反应是___________(选填:a、b、c、d)。
④若将体积比为1:1的CO和H2混合煤气通入进风口,测得不同温度下FeO还原到后,还原剂剩余的物质的量n值如下:
还原剂 | 600℃ | 700℃ | 800℃ | 900℃ | 1000℃ | 1100℃ | 1200℃ |
H2 | 4.18 | 3.34 | 2.94 | 2.60 | 2.32 | 2.30 | 2.25 |
CO | 1.66 | 2.50 | 2.90 | 3.24 | 3.52 | 3.54 | 3.59 |
请结合表格中的数据说明CO和H2分别还原FeO的倾向性大小是___________。
(3)一定条件下,FeCl2或FeCl3都可以催化分解H2O2。总反应都是2H2O2=2H2O+O2↑。请写出用FeCl3催化的离子方程式。①___________;②___________。
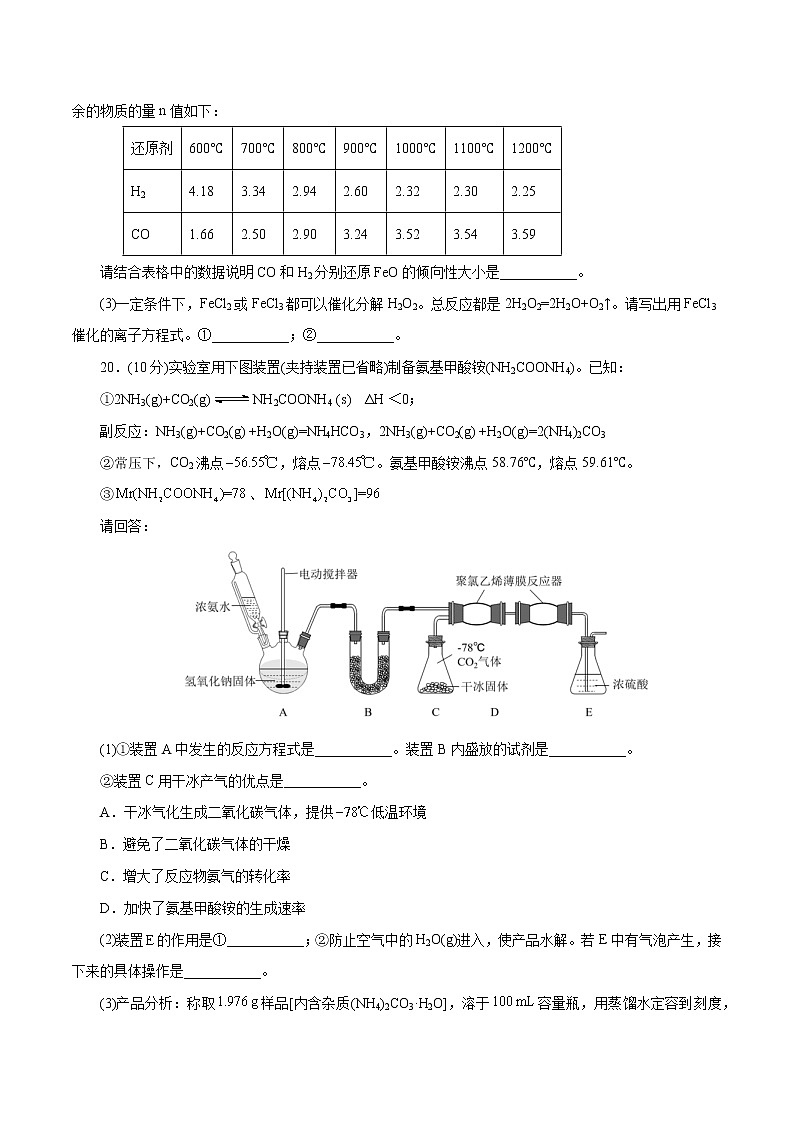
20.(10分)实验室用下图装置(夹持装置已省略)制备氨基甲酸铵(NH2COONH4)。已知:
①2NH3(g)+CO2(g)NH2COONH4 (s) ΔH <0;
副反应:NH3(g)+CO2(g) +H2O(g)=NH4HCO3,2NH3(g)+CO2(g) +H2O(g)=2(NH4)2CO3
②常压下,CO2沸点,熔点。氨基甲酸铵沸点58.76℃,熔点59.61℃。
③、
请回答:
(1)①装置A中发生的反应方程式是___________。装置B内盛放的试剂是___________。
②装置C用干冰产气的优点是___________。
A.干冰气化生成二氧化碳气体,提供低温环境
B.避免了二氧化碳气体的干燥
C.增大了反应物氨气的转化率
D.加快了氨基甲酸铵的生成速率
(2)装置的作用是①___________;②防止空气中的H2O(g)进入,使产品水解。若E中有气泡产生,接下来的具体操作是___________。
(3)产品分析:称取样品[内含杂质(NH4)2CO3·H2O],溶于容量瓶,用蒸馏水定容到刻度,每次取试样于锥形瓶中进行滴定。已知:
NH2COONH4+H2O=(NH4)2CO3
(NH4)2CO3+BaCl2=2NH4Cl+BaCO3↓
4NH4Cl+6HCHO=(CH2)6N4+ 4HCl
NaOH+HCl= NaCl+H2O,为避免碳酸钡的溶解,采用盐酸回滴过量的氢氧化钠标准液,然后计算氨基甲酸铵的氨含量。
实验数据如下表:
加入物质的量() | 25.000 |
回滴消耗盐酸物质的量() | 12.925 |
氨基甲酸铵纯度为___________。
(4)氨基甲酸铵(易分解)固体分解的标准平衡常数,其中P为系统总压,。针对测定实验装置图,从下列选项选择合适操作(操作不能重复使用)并排序:
_________________________________
a.将少量样品装入等压计中,在U形管中加入适量的硅油作液封
b.记录压差计两臂读数、恒温槽读数
c.开动真空泵,使体系呈620Pa负压,恒温10分钟
d.调整活塞1处于d位置,通过毛细管放入空气,使等压计U形管左臂压力始终略大于右臂压力,以保证反应向正方向进行。
e.反复操作,接近分解平衡时,调整等压计两边液面相平
f.将等压计接到真空系统,调整活塞1处于b位置,调节恒温槽温度为30.0℃
21.(12分) 某研究小组以水杨酸甲酯为起始原料,按下列路线合成癌症治疗中抗呕吐、恶心的药物——盐酸阿扎司琼,其路线如下:
回答下列问题:
(1)写出B的结构简式___________
(2)下列说法正确的是___________
A.反应①可用FeCl3作为催化剂
B.反应③④⑤⑥均发生取代反应
C.C2H2OCl2最多能与3molNaOH反应
D.盐酸阿扎司琼的分子式是C17H20Cl2N3O3
(3)写出C→D的化学方程式___________
(4)写出化合物G同时符合下列条件的同分异构体的结构简式:___________
a.分子组成比多一个“CH2”
b.分子中含有2个五元环,且两个五元环有一条边重合
c.1H-NMR谱检测表明G分子中H的环境有3种
(5)写出以甲醇与甲苯为原料合成原料水杨酸甲酯的路线______(用流程图表示,无机试剂任选)
预测卷05-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用): 这是一份预测卷05-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用),文件包含预测卷05原卷版docx、预测卷05解析版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。
预测卷04-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用): 这是一份预测卷04-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用),文件包含预测卷04原卷版docx、预测卷04解析版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
预测卷02-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用): 这是一份预测卷02-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用),文件包含预测卷02原卷版docx、预测卷02解析版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。












