
还剩11页未读,
继续阅读
山西省运城市2023届高三下学期第二次模拟调研测试理综化学试题
展开
这是一份山西省运城市2023届高三下学期第二次模拟调研测试理综化学试题,共14页。试卷主要包含了单选题,工业流程题,实验题,原理综合题,有机推断题等内容,欢迎下载使用。
山西省运城市2023届高三下学期第二次模拟调研测试理综化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学与生产、生活密切相关。下列说法错误的是
A.长时间高温蒸煮可杀死“甲流”病毒 B.可用氢氟酸溶蚀玻璃生产磨砂玻璃
C.5G、6G技术离不开制备光缆的晶体硅 D.石灰石是制造玻璃和水泥的主要原料之一
2.下列有关物质结构与性质的比较正确的是
A.基态原子未成对电子数:Cr> Mn> As
B.酸性:CH3COOH>CH2ClCOOH>CH2FCOOH
C.键角:SeO3< <
D.沸点:AsH3> PH3>NH3
3.有机物M(结构简式为( )是合成花椒毒素的重要中间体,下列说法错误的是
A.电负性:F>O>N>C B.第一电离能:N>O>C
C.M中碳原子的杂化方式有2种 D.M可以形成分子间氢键
4.由主族元素X、Y、Z、W组成的化合物ZX4W(YX4)3具有良好的储氢性能,其中,X、Y、Z是短周期元素, 与均为10电子数微粒,四种元素的原子序数之和为33。下列有关说法错误的是
A.X与Y、Z均可形成多种化合物 B.非金属性:Z> Y> >X
C.X、W元素可形成离子化合物 D.原子半径:W> Y> Z> >X
5.吲哚衍生物具有广泛又重要的生物活性。现有甲、乙两种吲哚衍生物,二者之间可相互转化,其结构简式如图所示:
下列关于甲,乙的说法正确的是
A.甲、乙的化学式不相同 B.甲、乙中所含有官能团种类相同
C.甲、乙在酸碱溶液均能稳定存在 D.甲、乙均能与H2发生加成反应
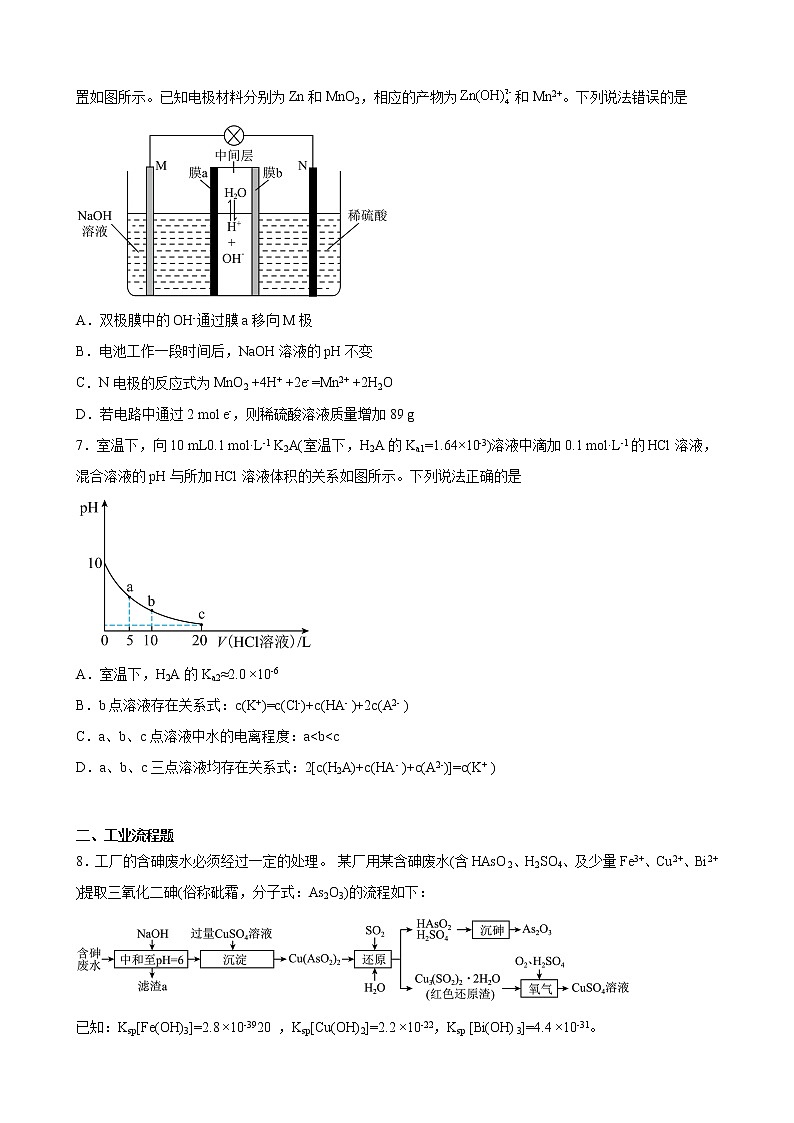
6.我国科研人员利用双极膜技术构造出一类具有高能量密度、优异的循环性能的新型水系电池,模拟装置如图所示。已知电极材料分别为Zn和MnO2,相应的产物为和Mn2+。下列说法错误的是
A.双极膜中的OH-通过膜a移向M极
B.电池工作一段时间后,NaOH溶液的pH不变
C.N电极的反应式为MnO2 +4H+ +2e- =Mn2+ +2H2O
D.若电路中通过2 mol e-,则稀硫酸溶液质量增加89 g
7.室温下,向10 mL0.1 mol·L-1 K2A(室温下,H2A的Ka1=1.64×10-3)溶液中滴加0.1 mol·L-1的HCl溶液,混合溶液的pH与所加HCl溶液体积的关系如图所示。下列说法正确的是
A.室温下,H2A的Ka2≈2.0 ×10-6
B.b点溶液存在关系式:c(K+)=c(Cl-)+c(HA- )+2c(A2- )
C.a、b、c点溶液中水的电离程度:a
D.a、b、c三点溶液均存在关系式:2[c(H2A)+c(HA- )+c(A2-)]=c(K+ )
二、工业流程题
8.工厂的含砷废水必须经过一定的处理。 某厂用某含砷废水(含HAsO2、H2SO4、及少量Fe3+、Cu2+、Bi2+ )提取三氧化二砷(俗称砒霜,分子式:As2O3)的流程如下:
已知:Ksp[Fe(OH)3]=2.8 ×10-3920 ,Ksp[Cu(OH)2]=2.2 ×10-22,Ksp [Bi(OH)3]=4.4 ×10-31。
回答下列问题:
(1)滤渣a的成分是___________(写化学式)。
(2)“沉淀”时,CuSO4溶液必须过量的原因是_________________。
(3)写出“还原”时Cu(AsO2)2与H2O、SO2发生反应的化学方程式:_____________。
(4)红色还原渣(不溶于水)“氧化”时反应的离子方程式为___________。
(5)“沉砷”后废水中残留的砷可用PFS(聚铁)进一步去除,用石灰乳调节废水的pH值,通入空气,PFS用量[以表示]、终点pH值与砷去除率的关系如图所示。PFS除砷的最佳条件是_________。
(6) 当废水中砷质量浓度为5.0g·L-1时,若实验取75 L含砷废水,制得475.2 gAs2O3,则As元的素回收率为________。
(7)砷化镓(GaAs)为第三代半导体,其立方晶胞结构如图所示。已知晶胞参数为a nm,阿伏加德罗常数值为NA,则砷化镓晶体密度为____________g· cm-3。
三、实验题
9.为探究某铁硫簇化合物(用FexSy表示)的组成,某化学兴趣小组设计了如图所示的实验装置测定样品中铁、硫的含量:
已知: i.样品的主要成分为FexSy,含少量不溶于水、盐酸,且不参与装置C中反应的杂质;
ii. Mn2+在稀溶液中近乎无色。
实验步骤:
①按图连接装置,进行气密性检查,然后装入相应的药品;
②通入氧气并加热,装置C中固体逐渐转变为红棕色;
③待固体完全转化后,取装置D中的溶液6 mL于锥形瓶中,用0.1 mol·L-1的H2C2O4(草酸)溶液滴定。滴定共进行3次,平均消耗草酸溶液5.0 mL(假设装置D中溶液体积反应前后不变);
④取装置C中的残留固体于烧杯中,加入稀盐酸,充分搅拌后过滤;
⑤向滤液中加入足量氢氧化钠溶液,出现沉淀。过滤后取滤渣灼烧,得0.32 g固体。
回答下列问题:
(1)A为O2发生装置,则试剂a、试剂b可以分别是__________。
(2)装置E中品红溶液的作用是______________。
(3)写出草酸溶液滴定酸性高锰酸钾溶液时反应的离子方程式:__________。(→ Mn2+)。
(4)为防止尾气污染,装置F中应加入的试剂是___, 步骤⑤中灼烧滤渣应在____进行(填仪器名称)。
(5)若实验完成时装置E中品红溶液无变化,根据上述实验所得数据,可确定该铁硫簇化合物的化学式为_____,写出该铁硫簇化合物与O2反应的化学方程式:_________。
(6)下列操作,可能导致x:y的值偏小的是_____________(填字母)。
a.步骤⑤灼烧滤渣不够充分
b.配制草酸标准液时,定容操作俯视刻度线
c.滴定时,草酸溶液不小心滴到锥形瓶外几滴
d.放出草酸的滴定管尖嘴部分滴定前无气泡,滴定终点时有气泡
四、原理综合题
10.加深对含氮氧化物的研究,有利于为环境污染提供有效决策。回答下列问题:
(1)已知:2NO(g) +O2(g)2NO2(g) ΔH1=-114 kJ·mol-1;
C(s)+O2(g)CO2(g) ΔH2= - 393.5 kJ·mol-1;
2NO(g)N2(g)+O2(g) ΔH3=-181 kJ·mol -1。
C(s)与NO2(g)反应生成N2(g)和CO2(g)的热化学方程式为___________;关于该可逆反应,改变下列条件,一段时间后,正反应速率增大的是_____ (填字母)。
A.恒温下,缩小反应容器体积
B.恒容下,降低反应温度
C.恒温恒容下,通入一定量的N2
D.恒温恒容下,将CO2移出容器
(2)T °C时,存在如下平衡:2NO2(g)N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为:v正= k正c2 (NO2),v逆=k逆c(N2O4) (k正、k逆为速率常数,仅与温度有关),且lg v正~lg c(NO2)与lg v逆~lg c(N2O4)的关系如图所示。
①表示v正的直线是____ (填“A”或“B")。
②T °C时,该反应的平衡常数K=____________。
③T °C时,向刚性容器中充入一定量NO2,平衡后测得c(NO2)为0.1 mol·L-1,平衡时NO2的转化率为____________(保留一位小数)。平衡后v逆=________(用含a的表达式表示)。
④上题③中的反应达到平衡后,其他条件不变,继续通定量入一的NO2,NO2的平衡浓度将________ (填“增大”“减小”或“不变”)。
(3)为减少汽车尾气中NOx的排放,某研究小组在实验室以耐高温催化剂催化NO转化为N2,测得NO转化为N2的转化率随温度变化情况如图所示。结合(1)中的反应,若不使用CO,温度超过775K,发现NO转化为N2的转化率降低,其可能的原因是_______________;用平衡移动原理解释加入CO后,NO转化为N2的转化率增大的原因:__________。
五、有机推断题
11.辣椒素酯具有抗氧化、抗炎和抗肿瘤等功效,其一种合成路线如下:
已知: I. A分子中含有两种不同环境的氢,且个数之比为9:1;
Ⅱ. ,其中R1、R2为氢或烃基。
回答下列问题:
(1)G中官能团的名称为_____________。
(2)C→D、G→H的反应类型分别为________________、__________________。
(3)B的结构简式为_______________。
(4)写出E→F第1步反应的化学方程式:______________________。
(5)1 mol J在氢氧化钠溶液中水解最多消耗__________mol NaOH。
(6)I的同分异构体中符合下列条件的有_________种(不考虑立体异构) ,其中核磁共振氢谱中有四组峰的有机物的结构简式为____________________(任写一种)。
①含有苯环; ②只含一种含氧官能团; ③1 mol该有机物可与3 mol NaOH反应。
参考答案:
1.C
【详解】A.长时间高温蒸煮可使病毒中的蛋白质变性,从而杀死病毒,故A正确;
B.氢氟酸能和二氧化硅反应,可用氢氟酸溶蚀玻璃生产磨砂玻璃,故B正确;
C.二氧化硅可以用来制备光缆,故C错误;
D.水泥制造的原理是对石灰石、粘土等原料进行破碎、混合、烧制等一系列工艺过程,石灰石是制造玻璃和水泥的主要原料之一,故D正确;
故选C。
2.A
【详解】A.Cr基态原子的价电子排布是3d54s1,未成对电子有6个;Mn基态原子的价电子排布是3d54s2,未成对电子有5个;As基态原子的价电子排布是4s24p3,未成对电子有3个;基态原子未成对电子数:Cr>Mn>As,故A正确;
B.饱和一元羧酸烃基上的氢原子被卤素取代后,因为卤素原子有吸引电子作用,降低了羧基碳原子上的电子云密度,使氢容易电离,卤代乙酸中卤素原子个数越多、卤素原子的非金属性越强, 酸性越强,则酸性:CH3COOH
C.SeO3中心原子价层电子对数为3+=3,且没有孤电子对,中心原子杂化方式为sp2,空间构型为正三角形,键角为120°;中心原子价层电子对数为4+=4,且没有孤电子对,中心原子杂化方式为sp3,空间构型为正四面体形,键角为109°28′;中心原子价层电子对数为3+=4,且有一个孤电子对,中心原子杂化方式为sp3,空间构型为三角锥形,键角为107°;键角:SeO3>>,故C错误;
D.一般情况下,对于结构相似的化合物而言,相对分子质量越大其沸点越高,但是NH3分子间存在氢键,沸点增高,出现了反常的现象,即沸点NH3>AsH3>PH3,故D错误;
故选A。
3.C
【详解】A.同周期元素(惰性气体元素除外)从左到右电负性逐渐增大,所以电负性:F>O>N>C,故A正确;
B.同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,第一电离能:N>O>C,故B正确;
C.M中存在羰基、-C≡N和-CH3,M中碳原子的杂化方式有sp、sp2、sp3共3种,故C错误;
D.M中含有亚氨基(-NH-),可以形成分子间氢键,故D正确;
故选C。
4.B
【分析】ZX4W(YX4)3为储氢材料,同时和均为10电子微粒,则X为H、Z为N、Y为B。四种元素序数之和为33,则W为Ca。
【详解】A.X与Y、Z均能形成多种化合物,A项正确;
B.从离子化合价来看,中H为正价,Z为负价,则非金属性:Z>X。中X为负价,Y为正价,则非金属性:X>Y。所以非金属性:Z>X>Y,B项错误;
C.X与W形成CaH2(含Ca2+和H-)为离子化合物,C项正确;
D.电子层越多半径越大,同电子层核电荷数越多半径越小:W>Y>Z>X,D项正确;
故选B。
5.D
【详解】A.由甲乙结构式可知,二者分子式相同都是C15H14N2O3,故A错误;
B.甲中含有羟基而乙中没有,故B错误;
C.甲和乙中都含有酯基,在碱性溶液中会发生水解反应,二者都不能在碱溶液中稳定存在,故C错误;
D.甲、乙均含有碳碳双键,能与H2发生加成反应,故D正确;
故选D。
6.B
【详解】A.由题给信息Zn生成Zn(OH),MnO2生成Mn2+可知,M极为Zn电极,N电极材料为MnO2,即M极为负极,N极为正极,OH-移向负极,A项正确;
B.负极的电极反应式为Zn+4OH--2e-=Zn(OH),每转移2 mol e-,有2 molOH-移向NaOH溶液,而消耗4molOH-,NaOH溶液的pH变小,B项错误;
C.N电极材料为MnO2,MnO2在正极得到电子生成Mn2+,电极方程式为:MnO2 +4H+ +2e- =Mn2+ +2H2O,故C正确;
D.若电路中通过2 mol e-,双极膜中有2 mol H+移向硫酸溶液,同时溶解1 mol MnO2,稀硫酸溶液质量增加2mol1g/mol+1mol87g/mol=89g,D项正确;
故选B。
7.D
【详解】A.由图可知,0.1 mol·L-1 K2A溶液的pH为10,溶液中c(OH-)= c(HA-),则H2A的Kh1=,则H2A的Ka2≈1.0 ×10-7,故A错误;
B.b点加入10mL0.1 mol·L-1的HCl溶液,溶质为KHA和KCl且物质的量浓度相等,根据HA-的水解常数和电离常数分析Kh2=,即电离程度大于水解程度,c(H+)>c(OH-),根据电荷守恒得到关系式c(H+)+c(K+)=c(Cl-)+c(HA- )+2c(A2- )+c(OH-),则c(K+)
C.c点溶液中pH最小,溶质为KCl和H2A,b点溶液中溶质为KHA、KCl,a点溶液为K2A、KHA、KCl,H2A的电离抑制水的电离,K2A水解促进水的电离,则c水的电离程度最小,a点水的电离程度最大,a、b、c点溶液中水的电离程度:c
D.根据物料守恒a、b、c三点溶液存在关系式:2[c(H2A)+c(HA- )+c(A2-)]=c(K+ ),故D正确;
故选D。
8.(1)Fe(OH)3、Cu(OH)2、Bi(OH)3
(2)为了使砷完全沉淀
(3)3Cu(AsO2)2+ 3SO2 +6H2O=Cu3(SO3)2 ·2H2O+ 6HAsO2 + H2SO4
(4)2Cu3(SO3)2·2H2O+4H+ + 3O2=6Cu2+ +4 +6H2O
(5)终点pH值为8,PFS用量为4或
(6)96%
(7)
【分析】含砷废水(含HAsO2、H2SO4、及少量Fe3+、Cu2+、Bi2+ )中加入NaOH溶液调节pH=6,由已知数据和后续除杂过程中不在设置步骤除去Fe3+、Cu2+、Bi2+可知,该步骤中Fe3+、Cu2+、Bi2+转化为Fe(OH)3、Cu(OH)2、Bi(OH)3沉淀,过滤后存在于滤渣a中除去,滤液中加入过量CuSO4溶液将AsO转化为Cu(AsO)2沉淀,再用SO2还原Cu(AsO)2得到HAsO2和H2SO4,经过沉砷得到As2O3,以此解答。
【详解】(1)由分析可知,滤渣a的成分是Fe(OH)3、Cu(OH)2、Bi(OH)3。
(2)“沉淀”时,为了使砷完全沉淀,CuSO4溶液必须过量。
(3)“还原”时Cu(AsO2)2与H2O、SO2反应生成Cu3(SO3)22H2O、HAsO2和H2SO4,化学方程式为3Cu(AsO2)2+ 3SO2 +6H2O=Cu3(SO3)2 ·2H2O+ 6HAsO2 + H2SO4。
(4)Cu3(SO3)22H2O (不溶于水)“氧化”时和O2、H2SO4溶液反应得到CuSO4溶液,O元素由0价下降到-2价,S元素由+4价上升到+6价,根据得失电子守恒和电荷守恒配平离子方程式为:2Cu3(SO3)2·2H2O+4H+ + 3O2=6Cu2+ +4 +6H2O。
(5)PFS除砷时,去除率最高时的条件是终点pH值为8,PFS用量为4或。
(6)当废水中砷质量浓度为5.0g·L-1时,若实验取75 L含砷废水,根据As守恒,理论上生成As2O3的质量为495g,As元素的回收率为 =96%。
(7)由晶胞结构可知,每个晶胞含有8=4个Ga和4个As,则砷化镓晶体密度为。
9.(1)H2O、Na2O2或H2O2、MnO2
(2)检验SO2是否被酸性高锰酸钾溶液完全吸收
(3)5H2C2O4 +2+6H+=10CO2↑+2Mn2+ +8H2O
(4) NaOH溶液 坩埚
(5) Fe4S5 Fe4S5 +8O22Fe2O3+5SO2
(6)bd
【分析】装置A制备氧气,C中通入氧气,发生氧化还原反应生成二氧化硫,且固体变为红色,则生成氧化铁,生成的二氧化硫被D中高锰酸钾吸收,根据高锰酸钾的量可测定二氧化硫,E中品红可检验二氧化硫是否被完全吸收,F为尾气处理装置,避免污染环境,以此解答该题。
【详解】(1)装置A固体和液体不加热制备氧气,可以选用H2O、Na2O2或H2O2、MnO2;
(2)二氧化硫可以被高锰酸钾吸收,用装置E来检验,故装置C中品红试液的作用是检验二氧化硫是否被酸性高锰酸钾完全吸收;
(3)草酸被酸性高锰酸钾氧化为二氧化碳,同时高锰酸钾被还原为锰离子,离子方程式为:5H2C2O4 +2+6H+=10CO2↑+2Mn2+ +8H2O;
(4)二氧化硫会引起大气污染,为了避免尾气污染,装置F中应加入NaOH溶液;对固体进行灼烧应该在坩埚中进行,故骤⑤中灼烧滤渣应该在坩埚中进行;
(5)滴定时消耗草酸溶液的体积为5.0mL,根据关系式计算:6mL溶液中未反应的MnO的物质的量为: ,30mL溶液中未反应的高锰酸钾的物质的量为,装置D中反应消耗的高锰酸钾的物质的量为: ,根据关系式计算生成二氧化硫,0.32g固体是Fe2O3,n(Fe)= ,所以n(Fe):n(SO2)= :=4:5,该铁硫簇结构的化学式为Fe4S5;
(6)a.步骤⑤灼烧滤渣不够充分,则所测固体残渣质量偏大,比值x:y偏大,a错误;
b.配置草酸标准液时,定容操作俯视刻度线,则所配草酸标准溶液浓度偏大,滴定时草酸体积偏小,则所测二氧化硫物质的量偏大,比值x:y偏小,b正确;
c.滴定时,草酸溶液不小心滴到锥形瓶外一滴,所测草酸体积偏大,则所测二氧化硫物质的量偏小,比值x:y偏大,c错误;
d.放出草酸的滴定管尖嘴部分滴定前无气泡,滴定终点时有气泡,则消耗的草酸溶液体积偏小,则所测二氧化硫物质的量偏大,比值x:y偏小,d正确;
故选bd。
10.(1) 2C(s)+2NO2(g)N2(g)+2CO2(g) ΔH= - 854.0kJ·mol-1 AC
(2) A 100 95.2% 10a 增大
(3) NO分解成N2的反应是放热反应,775 K后,升高温度,该反应逆向进行 加入CO后,与NO分解生成的O2反应,使NO分解向生成N2的方向移动
【详解】(1)由盖斯定律可知,题给反应②×2+反应③-反应①可得C(s)与NO2(g)反应生成N2(g)和CO2(g)的反应,,答案为2C(s)+2NO2(g)N2(g)+2CO2(g) ΔH= - 854.0kJ·mol-1。恒温缩小容器体积,反应物浓度升高,反应速率加快;恒容降低温度,活化分子百分数降低,有效碰撞减少,反应速率降低;恒温恒容充入氮气,平衡逆向移动,反应物浓度升高,正反应速率升高;移出二氧化碳,平衡正向移动,反应物浓度降低,正反应速率降低;故选AC。
(2)①由反应速率表达式及题给图像可知,正反应速率受物质浓度变化影响更大,体现在图像中则为随浓度变化,变化越快,对应图中直线A;②,当反应达到平衡时即 k正c2 (NO2)=k逆c(N2O4),则,由图可知当时则,,则K=100。③由K=100可知,当c(NO2)为0.1 mol·L-1时,c(N2O4)=1 mol·L-1,则Δc(NO2)=2 mol·L-1,转化率为, k逆c(N2O4)=10a×1=10a。④由勒夏特列原理可知,通入二氧化氮,二氧化氮浓度升高,平衡向着二氧化氮浓度降低的方向移动,但是只能削弱二氧化氮浓度的升高但是不能抵消,因此最终二氧化氮的浓度仍旧为增大。
(3)由反应(1)可知,该反应为放热反应,升高温度平衡逆向移动,一氧化氮转化率降低;一氧化碳能与氧气反应,使平衡正向移动。
11.(1)(酚)羟基、醚键
(2) 加成(还原)反应 取代反应
(3)CH3CHO
(4)(CH3)3CCH2 CH2CHO+ 2Cu(OH)2 +NaOH(CH3)3CCH2CH2COONa+Cu2O↓+3H2O
(5)2
(6) 12 或
【分析】由J的结构得F为,E为(CH3)3CCH2 CH2CHO,D为(CH3)3CCH2 CH2CH2OH,C为(CH3)3CCH= CHCHO,A分子中含有两种不同环境的氢,且个数之比为9:1,A为(CH3)3CCHO,B为CH3CHO;G在光照条件下与氯气发生取代反应生成H,H为,在NaOH的水溶液中水解得I,I为。
【详解】(1)G中官能团的名称为(酚)羟基、醚键。故答案为:(酚)羟基、醚键;
(2)C为(CH3)3CCH= CHCHO,D为(CH3)3CCH2 CH2CH2OH,C→D为加成或还原反应、G在光照条件下与氯气发生取代反应生成H,H为,G→H的反应类型为取代反应。故答案为:加成(还原)反应;取代反应;
(3)B的结构简式为CH3CHO。故答案为:CH3CHO;
(4)E→F第1步反应新制氢氧化铜悬浊液将醛基氧化成羧酸盐,化学方程式:(CH3)3CCH2 CH2CHO+ 2Cu(OH)2 +NaOH(CH3)3CCH2CH2COONa+Cu2O↓+3H2O。故答案为:(CH3)3CCH2 CH2CHO+ 2Cu(OH)2 +NaOH(CH3)3CCH2CH2COONa+Cu2O↓+3H2O;
(5)J分子中酚羟基和酯基均能与NaOH反应,1 mol J在氢氧化钠溶液中水解最多消耗2mol NaOH。故答案为:2;
(6)I的同分异构体中①含有苯环,余下2个C和3个O原子; ②只含一种含氧官能团; ③1 mol该有机物可与3 mol NaOH反应,应有三个酚羟基,两个碳可组成乙基或2个甲基,连苯三酚苯环上连上乙基有2种,连上2个甲基有2种,均苯三酚苯环上连上乙基有1种,连上2个甲基有1种,偏苯三酚苯环上连上乙基有3种,连上2个甲基有3种,共2+2+1+1+3+3=12,符合三个条件的有12种(不考虑立体异构) ,其中核磁共振氢谱中有四组峰的有机物的结构简式为或。
故答案为:12;或。
山西省运城市2023届高三下学期第二次模拟调研测试理综化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学与生产、生活密切相关。下列说法错误的是
A.长时间高温蒸煮可杀死“甲流”病毒 B.可用氢氟酸溶蚀玻璃生产磨砂玻璃
C.5G、6G技术离不开制备光缆的晶体硅 D.石灰石是制造玻璃和水泥的主要原料之一
2.下列有关物质结构与性质的比较正确的是
A.基态原子未成对电子数:Cr> Mn> As
B.酸性:CH3COOH>CH2ClCOOH>CH2FCOOH
C.键角:SeO3< <
D.沸点:AsH3> PH3>NH3
3.有机物M(结构简式为( )是合成花椒毒素的重要中间体,下列说法错误的是
A.电负性:F>O>N>C B.第一电离能:N>O>C
C.M中碳原子的杂化方式有2种 D.M可以形成分子间氢键
4.由主族元素X、Y、Z、W组成的化合物ZX4W(YX4)3具有良好的储氢性能,其中,X、Y、Z是短周期元素, 与均为10电子数微粒,四种元素的原子序数之和为33。下列有关说法错误的是
A.X与Y、Z均可形成多种化合物 B.非金属性:Z> Y> >X
C.X、W元素可形成离子化合物 D.原子半径:W> Y> Z> >X
5.吲哚衍生物具有广泛又重要的生物活性。现有甲、乙两种吲哚衍生物,二者之间可相互转化,其结构简式如图所示:
下列关于甲,乙的说法正确的是
A.甲、乙的化学式不相同 B.甲、乙中所含有官能团种类相同
C.甲、乙在酸碱溶液均能稳定存在 D.甲、乙均能与H2发生加成反应
6.我国科研人员利用双极膜技术构造出一类具有高能量密度、优异的循环性能的新型水系电池,模拟装置如图所示。已知电极材料分别为Zn和MnO2,相应的产物为和Mn2+。下列说法错误的是
A.双极膜中的OH-通过膜a移向M极
B.电池工作一段时间后,NaOH溶液的pH不变
C.N电极的反应式为MnO2 +4H+ +2e- =Mn2+ +2H2O
D.若电路中通过2 mol e-,则稀硫酸溶液质量增加89 g
7.室温下,向10 mL0.1 mol·L-1 K2A(室温下,H2A的Ka1=1.64×10-3)溶液中滴加0.1 mol·L-1的HCl溶液,混合溶液的pH与所加HCl溶液体积的关系如图所示。下列说法正确的是
A.室温下,H2A的Ka2≈2.0 ×10-6
B.b点溶液存在关系式:c(K+)=c(Cl-)+c(HA- )+2c(A2- )
C.a、b、c点溶液中水的电离程度:a
二、工业流程题
8.工厂的含砷废水必须经过一定的处理。 某厂用某含砷废水(含HAsO2、H2SO4、及少量Fe3+、Cu2+、Bi2+ )提取三氧化二砷(俗称砒霜,分子式:As2O3)的流程如下:
已知:Ksp[Fe(OH)3]=2.8 ×10-3920 ,Ksp[Cu(OH)2]=2.2 ×10-22,Ksp [Bi(OH)3]=4.4 ×10-31。
回答下列问题:
(1)滤渣a的成分是___________(写化学式)。
(2)“沉淀”时,CuSO4溶液必须过量的原因是_________________。
(3)写出“还原”时Cu(AsO2)2与H2O、SO2发生反应的化学方程式:_____________。
(4)红色还原渣(不溶于水)“氧化”时反应的离子方程式为___________。
(5)“沉砷”后废水中残留的砷可用PFS(聚铁)进一步去除,用石灰乳调节废水的pH值,通入空气,PFS用量[以表示]、终点pH值与砷去除率的关系如图所示。PFS除砷的最佳条件是_________。
(6) 当废水中砷质量浓度为5.0g·L-1时,若实验取75 L含砷废水,制得475.2 gAs2O3,则As元的素回收率为________。
(7)砷化镓(GaAs)为第三代半导体,其立方晶胞结构如图所示。已知晶胞参数为a nm,阿伏加德罗常数值为NA,则砷化镓晶体密度为____________g· cm-3。
三、实验题
9.为探究某铁硫簇化合物(用FexSy表示)的组成,某化学兴趣小组设计了如图所示的实验装置测定样品中铁、硫的含量:
已知: i.样品的主要成分为FexSy,含少量不溶于水、盐酸,且不参与装置C中反应的杂质;
ii. Mn2+在稀溶液中近乎无色。
实验步骤:
①按图连接装置,进行气密性检查,然后装入相应的药品;
②通入氧气并加热,装置C中固体逐渐转变为红棕色;
③待固体完全转化后,取装置D中的溶液6 mL于锥形瓶中,用0.1 mol·L-1的H2C2O4(草酸)溶液滴定。滴定共进行3次,平均消耗草酸溶液5.0 mL(假设装置D中溶液体积反应前后不变);
④取装置C中的残留固体于烧杯中,加入稀盐酸,充分搅拌后过滤;
⑤向滤液中加入足量氢氧化钠溶液,出现沉淀。过滤后取滤渣灼烧,得0.32 g固体。
回答下列问题:
(1)A为O2发生装置,则试剂a、试剂b可以分别是__________。
(2)装置E中品红溶液的作用是______________。
(3)写出草酸溶液滴定酸性高锰酸钾溶液时反应的离子方程式:__________。(→ Mn2+)。
(4)为防止尾气污染,装置F中应加入的试剂是___, 步骤⑤中灼烧滤渣应在____进行(填仪器名称)。
(5)若实验完成时装置E中品红溶液无变化,根据上述实验所得数据,可确定该铁硫簇化合物的化学式为_____,写出该铁硫簇化合物与O2反应的化学方程式:_________。
(6)下列操作,可能导致x:y的值偏小的是_____________(填字母)。
a.步骤⑤灼烧滤渣不够充分
b.配制草酸标准液时,定容操作俯视刻度线
c.滴定时,草酸溶液不小心滴到锥形瓶外几滴
d.放出草酸的滴定管尖嘴部分滴定前无气泡,滴定终点时有气泡
四、原理综合题
10.加深对含氮氧化物的研究,有利于为环境污染提供有效决策。回答下列问题:
(1)已知:2NO(g) +O2(g)2NO2(g) ΔH1=-114 kJ·mol-1;
C(s)+O2(g)CO2(g) ΔH2= - 393.5 kJ·mol-1;
2NO(g)N2(g)+O2(g) ΔH3=-181 kJ·mol -1。
C(s)与NO2(g)反应生成N2(g)和CO2(g)的热化学方程式为___________;关于该可逆反应,改变下列条件,一段时间后,正反应速率增大的是_____ (填字母)。
A.恒温下,缩小反应容器体积
B.恒容下,降低反应温度
C.恒温恒容下,通入一定量的N2
D.恒温恒容下,将CO2移出容器
(2)T °C时,存在如下平衡:2NO2(g)N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为:v正= k正c2 (NO2),v逆=k逆c(N2O4) (k正、k逆为速率常数,仅与温度有关),且lg v正~lg c(NO2)与lg v逆~lg c(N2O4)的关系如图所示。
①表示v正的直线是____ (填“A”或“B")。
②T °C时,该反应的平衡常数K=____________。
③T °C时,向刚性容器中充入一定量NO2,平衡后测得c(NO2)为0.1 mol·L-1,平衡时NO2的转化率为____________(保留一位小数)。平衡后v逆=________(用含a的表达式表示)。
④上题③中的反应达到平衡后,其他条件不变,继续通定量入一的NO2,NO2的平衡浓度将________ (填“增大”“减小”或“不变”)。
(3)为减少汽车尾气中NOx的排放,某研究小组在实验室以耐高温催化剂催化NO转化为N2,测得NO转化为N2的转化率随温度变化情况如图所示。结合(1)中的反应,若不使用CO,温度超过775K,发现NO转化为N2的转化率降低,其可能的原因是_______________;用平衡移动原理解释加入CO后,NO转化为N2的转化率增大的原因:__________。
五、有机推断题
11.辣椒素酯具有抗氧化、抗炎和抗肿瘤等功效,其一种合成路线如下:
已知: I. A分子中含有两种不同环境的氢,且个数之比为9:1;
Ⅱ. ,其中R1、R2为氢或烃基。
回答下列问题:
(1)G中官能团的名称为_____________。
(2)C→D、G→H的反应类型分别为________________、__________________。
(3)B的结构简式为_______________。
(4)写出E→F第1步反应的化学方程式:______________________。
(5)1 mol J在氢氧化钠溶液中水解最多消耗__________mol NaOH。
(6)I的同分异构体中符合下列条件的有_________种(不考虑立体异构) ,其中核磁共振氢谱中有四组峰的有机物的结构简式为____________________(任写一种)。
①含有苯环; ②只含一种含氧官能团; ③1 mol该有机物可与3 mol NaOH反应。
参考答案:
1.C
【详解】A.长时间高温蒸煮可使病毒中的蛋白质变性,从而杀死病毒,故A正确;
B.氢氟酸能和二氧化硅反应,可用氢氟酸溶蚀玻璃生产磨砂玻璃,故B正确;
C.二氧化硅可以用来制备光缆,故C错误;
D.水泥制造的原理是对石灰石、粘土等原料进行破碎、混合、烧制等一系列工艺过程,石灰石是制造玻璃和水泥的主要原料之一,故D正确;
故选C。
2.A
【详解】A.Cr基态原子的价电子排布是3d54s1,未成对电子有6个;Mn基态原子的价电子排布是3d54s2,未成对电子有5个;As基态原子的价电子排布是4s24p3,未成对电子有3个;基态原子未成对电子数:Cr>Mn>As,故A正确;
B.饱和一元羧酸烃基上的氢原子被卤素取代后,因为卤素原子有吸引电子作用,降低了羧基碳原子上的电子云密度,使氢容易电离,卤代乙酸中卤素原子个数越多、卤素原子的非金属性越强, 酸性越强,则酸性:CH3COOH
D.一般情况下,对于结构相似的化合物而言,相对分子质量越大其沸点越高,但是NH3分子间存在氢键,沸点增高,出现了反常的现象,即沸点NH3>AsH3>PH3,故D错误;
故选A。
3.C
【详解】A.同周期元素(惰性气体元素除外)从左到右电负性逐渐增大,所以电负性:F>O>N>C,故A正确;
B.同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,第一电离能:N>O>C,故B正确;
C.M中存在羰基、-C≡N和-CH3,M中碳原子的杂化方式有sp、sp2、sp3共3种,故C错误;
D.M中含有亚氨基(-NH-),可以形成分子间氢键,故D正确;
故选C。
4.B
【分析】ZX4W(YX4)3为储氢材料,同时和均为10电子微粒,则X为H、Z为N、Y为B。四种元素序数之和为33,则W为Ca。
【详解】A.X与Y、Z均能形成多种化合物,A项正确;
B.从离子化合价来看,中H为正价,Z为负价,则非金属性:Z>X。中X为负价,Y为正价,则非金属性:X>Y。所以非金属性:Z>X>Y,B项错误;
C.X与W形成CaH2(含Ca2+和H-)为离子化合物,C项正确;
D.电子层越多半径越大,同电子层核电荷数越多半径越小:W>Y>Z>X,D项正确;
故选B。
5.D
【详解】A.由甲乙结构式可知,二者分子式相同都是C15H14N2O3,故A错误;
B.甲中含有羟基而乙中没有,故B错误;
C.甲和乙中都含有酯基,在碱性溶液中会发生水解反应,二者都不能在碱溶液中稳定存在,故C错误;
D.甲、乙均含有碳碳双键,能与H2发生加成反应,故D正确;
故选D。
6.B
【详解】A.由题给信息Zn生成Zn(OH),MnO2生成Mn2+可知,M极为Zn电极,N电极材料为MnO2,即M极为负极,N极为正极,OH-移向负极,A项正确;
B.负极的电极反应式为Zn+4OH--2e-=Zn(OH),每转移2 mol e-,有2 molOH-移向NaOH溶液,而消耗4molOH-,NaOH溶液的pH变小,B项错误;
C.N电极材料为MnO2,MnO2在正极得到电子生成Mn2+,电极方程式为:MnO2 +4H+ +2e- =Mn2+ +2H2O,故C正确;
D.若电路中通过2 mol e-,双极膜中有2 mol H+移向硫酸溶液,同时溶解1 mol MnO2,稀硫酸溶液质量增加2mol1g/mol+1mol87g/mol=89g,D项正确;
故选B。
7.D
【详解】A.由图可知,0.1 mol·L-1 K2A溶液的pH为10,溶液中c(OH-)= c(HA-),则H2A的Kh1=,则H2A的Ka2≈1.0 ×10-7,故A错误;
B.b点加入10mL0.1 mol·L-1的HCl溶液,溶质为KHA和KCl且物质的量浓度相等,根据HA-的水解常数和电离常数分析Kh2=,即电离程度大于水解程度,c(H+)>c(OH-),根据电荷守恒得到关系式c(H+)+c(K+)=c(Cl-)+c(HA- )+2c(A2- )+c(OH-),则c(K+)
故选D。
8.(1)Fe(OH)3、Cu(OH)2、Bi(OH)3
(2)为了使砷完全沉淀
(3)3Cu(AsO2)2+ 3SO2 +6H2O=Cu3(SO3)2 ·2H2O+ 6HAsO2 + H2SO4
(4)2Cu3(SO3)2·2H2O+4H+ + 3O2=6Cu2+ +4 +6H2O
(5)终点pH值为8,PFS用量为4或
(6)96%
(7)
【分析】含砷废水(含HAsO2、H2SO4、及少量Fe3+、Cu2+、Bi2+ )中加入NaOH溶液调节pH=6,由已知数据和后续除杂过程中不在设置步骤除去Fe3+、Cu2+、Bi2+可知,该步骤中Fe3+、Cu2+、Bi2+转化为Fe(OH)3、Cu(OH)2、Bi(OH)3沉淀,过滤后存在于滤渣a中除去,滤液中加入过量CuSO4溶液将AsO转化为Cu(AsO)2沉淀,再用SO2还原Cu(AsO)2得到HAsO2和H2SO4,经过沉砷得到As2O3,以此解答。
【详解】(1)由分析可知,滤渣a的成分是Fe(OH)3、Cu(OH)2、Bi(OH)3。
(2)“沉淀”时,为了使砷完全沉淀,CuSO4溶液必须过量。
(3)“还原”时Cu(AsO2)2与H2O、SO2反应生成Cu3(SO3)22H2O、HAsO2和H2SO4,化学方程式为3Cu(AsO2)2+ 3SO2 +6H2O=Cu3(SO3)2 ·2H2O+ 6HAsO2 + H2SO4。
(4)Cu3(SO3)22H2O (不溶于水)“氧化”时和O2、H2SO4溶液反应得到CuSO4溶液,O元素由0价下降到-2价,S元素由+4价上升到+6价,根据得失电子守恒和电荷守恒配平离子方程式为:2Cu3(SO3)2·2H2O+4H+ + 3O2=6Cu2+ +4 +6H2O。
(5)PFS除砷时,去除率最高时的条件是终点pH值为8,PFS用量为4或。
(6)当废水中砷质量浓度为5.0g·L-1时,若实验取75 L含砷废水,根据As守恒,理论上生成As2O3的质量为495g,As元素的回收率为 =96%。
(7)由晶胞结构可知,每个晶胞含有8=4个Ga和4个As,则砷化镓晶体密度为。
9.(1)H2O、Na2O2或H2O2、MnO2
(2)检验SO2是否被酸性高锰酸钾溶液完全吸收
(3)5H2C2O4 +2+6H+=10CO2↑+2Mn2+ +8H2O
(4) NaOH溶液 坩埚
(5) Fe4S5 Fe4S5 +8O22Fe2O3+5SO2
(6)bd
【分析】装置A制备氧气,C中通入氧气,发生氧化还原反应生成二氧化硫,且固体变为红色,则生成氧化铁,生成的二氧化硫被D中高锰酸钾吸收,根据高锰酸钾的量可测定二氧化硫,E中品红可检验二氧化硫是否被完全吸收,F为尾气处理装置,避免污染环境,以此解答该题。
【详解】(1)装置A固体和液体不加热制备氧气,可以选用H2O、Na2O2或H2O2、MnO2;
(2)二氧化硫可以被高锰酸钾吸收,用装置E来检验,故装置C中品红试液的作用是检验二氧化硫是否被酸性高锰酸钾完全吸收;
(3)草酸被酸性高锰酸钾氧化为二氧化碳,同时高锰酸钾被还原为锰离子,离子方程式为:5H2C2O4 +2+6H+=10CO2↑+2Mn2+ +8H2O;
(4)二氧化硫会引起大气污染,为了避免尾气污染,装置F中应加入NaOH溶液;对固体进行灼烧应该在坩埚中进行,故骤⑤中灼烧滤渣应该在坩埚中进行;
(5)滴定时消耗草酸溶液的体积为5.0mL,根据关系式计算:6mL溶液中未反应的MnO的物质的量为: ,30mL溶液中未反应的高锰酸钾的物质的量为,装置D中反应消耗的高锰酸钾的物质的量为: ,根据关系式计算生成二氧化硫,0.32g固体是Fe2O3,n(Fe)= ,所以n(Fe):n(SO2)= :=4:5,该铁硫簇结构的化学式为Fe4S5;
(6)a.步骤⑤灼烧滤渣不够充分,则所测固体残渣质量偏大,比值x:y偏大,a错误;
b.配置草酸标准液时,定容操作俯视刻度线,则所配草酸标准溶液浓度偏大,滴定时草酸体积偏小,则所测二氧化硫物质的量偏大,比值x:y偏小,b正确;
c.滴定时,草酸溶液不小心滴到锥形瓶外一滴,所测草酸体积偏大,则所测二氧化硫物质的量偏小,比值x:y偏大,c错误;
d.放出草酸的滴定管尖嘴部分滴定前无气泡,滴定终点时有气泡,则消耗的草酸溶液体积偏小,则所测二氧化硫物质的量偏大,比值x:y偏小,d正确;
故选bd。
10.(1) 2C(s)+2NO2(g)N2(g)+2CO2(g) ΔH= - 854.0kJ·mol-1 AC
(2) A 100 95.2% 10a 增大
(3) NO分解成N2的反应是放热反应,775 K后,升高温度,该反应逆向进行 加入CO后,与NO分解生成的O2反应,使NO分解向生成N2的方向移动
【详解】(1)由盖斯定律可知,题给反应②×2+反应③-反应①可得C(s)与NO2(g)反应生成N2(g)和CO2(g)的反应,,答案为2C(s)+2NO2(g)N2(g)+2CO2(g) ΔH= - 854.0kJ·mol-1。恒温缩小容器体积,反应物浓度升高,反应速率加快;恒容降低温度,活化分子百分数降低,有效碰撞减少,反应速率降低;恒温恒容充入氮气,平衡逆向移动,反应物浓度升高,正反应速率升高;移出二氧化碳,平衡正向移动,反应物浓度降低,正反应速率降低;故选AC。
(2)①由反应速率表达式及题给图像可知,正反应速率受物质浓度变化影响更大,体现在图像中则为随浓度变化,变化越快,对应图中直线A;②,当反应达到平衡时即 k正c2 (NO2)=k逆c(N2O4),则,由图可知当时则,,则K=100。③由K=100可知,当c(NO2)为0.1 mol·L-1时,c(N2O4)=1 mol·L-1,则Δc(NO2)=2 mol·L-1,转化率为, k逆c(N2O4)=10a×1=10a。④由勒夏特列原理可知,通入二氧化氮,二氧化氮浓度升高,平衡向着二氧化氮浓度降低的方向移动,但是只能削弱二氧化氮浓度的升高但是不能抵消,因此最终二氧化氮的浓度仍旧为增大。
(3)由反应(1)可知,该反应为放热反应,升高温度平衡逆向移动,一氧化氮转化率降低;一氧化碳能与氧气反应,使平衡正向移动。
11.(1)(酚)羟基、醚键
(2) 加成(还原)反应 取代反应
(3)CH3CHO
(4)(CH3)3CCH2 CH2CHO+ 2Cu(OH)2 +NaOH(CH3)3CCH2CH2COONa+Cu2O↓+3H2O
(5)2
(6) 12 或
【分析】由J的结构得F为,E为(CH3)3CCH2 CH2CHO,D为(CH3)3CCH2 CH2CH2OH,C为(CH3)3CCH= CHCHO,A分子中含有两种不同环境的氢,且个数之比为9:1,A为(CH3)3CCHO,B为CH3CHO;G在光照条件下与氯气发生取代反应生成H,H为,在NaOH的水溶液中水解得I,I为。
【详解】(1)G中官能团的名称为(酚)羟基、醚键。故答案为:(酚)羟基、醚键;
(2)C为(CH3)3CCH= CHCHO,D为(CH3)3CCH2 CH2CH2OH,C→D为加成或还原反应、G在光照条件下与氯气发生取代反应生成H,H为,G→H的反应类型为取代反应。故答案为:加成(还原)反应;取代反应;
(3)B的结构简式为CH3CHO。故答案为:CH3CHO;
(4)E→F第1步反应新制氢氧化铜悬浊液将醛基氧化成羧酸盐,化学方程式:(CH3)3CCH2 CH2CHO+ 2Cu(OH)2 +NaOH(CH3)3CCH2CH2COONa+Cu2O↓+3H2O。故答案为:(CH3)3CCH2 CH2CHO+ 2Cu(OH)2 +NaOH(CH3)3CCH2CH2COONa+Cu2O↓+3H2O;
(5)J分子中酚羟基和酯基均能与NaOH反应,1 mol J在氢氧化钠溶液中水解最多消耗2mol NaOH。故答案为:2;
(6)I的同分异构体中①含有苯环,余下2个C和3个O原子; ②只含一种含氧官能团; ③1 mol该有机物可与3 mol NaOH反应,应有三个酚羟基,两个碳可组成乙基或2个甲基,连苯三酚苯环上连上乙基有2种,连上2个甲基有2种,均苯三酚苯环上连上乙基有1种,连上2个甲基有1种,偏苯三酚苯环上连上乙基有3种,连上2个甲基有3种,共2+2+1+1+3+3=12,符合三个条件的有12种(不考虑立体异构) ,其中核磁共振氢谱中有四组峰的有机物的结构简式为或。
故答案为:12;或。












