

北京市丰台区2022~2023学年度第二学期第高三化学第二次模拟
展开北京市丰台区2022~2023学年度第二学期综合练习(二)
高 三 化 学 2023.04
本试卷共10页,100分。考试时长90分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16 F 19 Na 23 P 31 Cl 35.5 Mn 55 Fe 56
第一部分(选择题 共42分)
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.研究CO2的利用对促进低碳社会的构建具有重要意义。下列有关CO2的应用中,涉及氧
化还原反应的是
A.用CO2制纯碱 B.用CO2制甲醇
C.用干冰制造“云雾” D.用CO2制碳酸饮料
2.下列化学用语或图示表达不正确的是
A.SO3的VSEPR模型: B.羟基的电子式:
8
C.S2-的结构示意图: D.原子核内有8个中子的碳原子:C
3.下列离子方程式书写正确的是
A.Cl2通入水中制氯水:Cl2 + H2O ===== 2H++ Cl-+ ClO-
B.可用Na2SO3溶液吸收少量Cl2:3SO2﹣ 3+ Cl2 + H2O ===== 2HSO﹣ 3+2Cl-+ SO2﹣ 4
C.过量铁粉与稀硝酸反应:Fe +NO-3+ 4H+ ===== Fe3+ + NO↑+2H2O
D.NaHCO3溶液与少量Ba(OH)2溶液混合:HCO﹣ 3+Ba2++ OH-===== BaCO3↓ + H2O
4.下列关于Na、Mg、Cl、Br元素及其化合物的说法不正确的是
A.酸性:HClO4>HBrO4
B.熔点:NaCl>NaBr
C.电负性:Cl > Br >Na> Mg
D.离子半径:r (Br-)>r (Cl-)>r(Na+)>r (Mg2+)
点燃
5.已知:2Na+O2==== Na2O2 。下列说法不正确的是
A.钠在空气中燃烧,产生黄色火焰,生成淡黄色固体
B.Na2O2中含有离子键、非极性共价键
C.Na2O2中阴阳离子个数比为1∶1
D.Na2O2可作供氧剂,与CO2反应过程中每生成1mol O2转移2 mol e-
6.电化学的应用领域非常广泛。下列说法不正确的是
A.电解CuCl2溶液时,与直流电源负极相连的石墨棒上逐渐覆盖红色的铜
B.铜板上铁铆钉在中性水膜中被腐蚀时,正极发生的电极反应为:
O2+2H2O+4e-===== 4OH-
C.电解饱和食盐水的过程中,阴极区碱性不断增强
D.铅蓄电池放电时,电子由PbO2通过导线流向Pb
7. 邻二氮菲(phen)与Fe2+生成稳定的橙红色邻二氮菲亚铁离子[Fe(phen)3]2+,可用于Fe2+的测定,邻二氮菲的结构简式如图所示。下列说法不正确的是
A.邻二氮菲的一氯代物有4种
B.邻二氮菲的熔点主要取决于所含化学键的键能
C.邻二氮菲分子中的碳原子和氮原子杂化方式相同
D.用邻二氮菲测定Fe2+浓度时,溶液酸性或碱性太强会影响测定结果
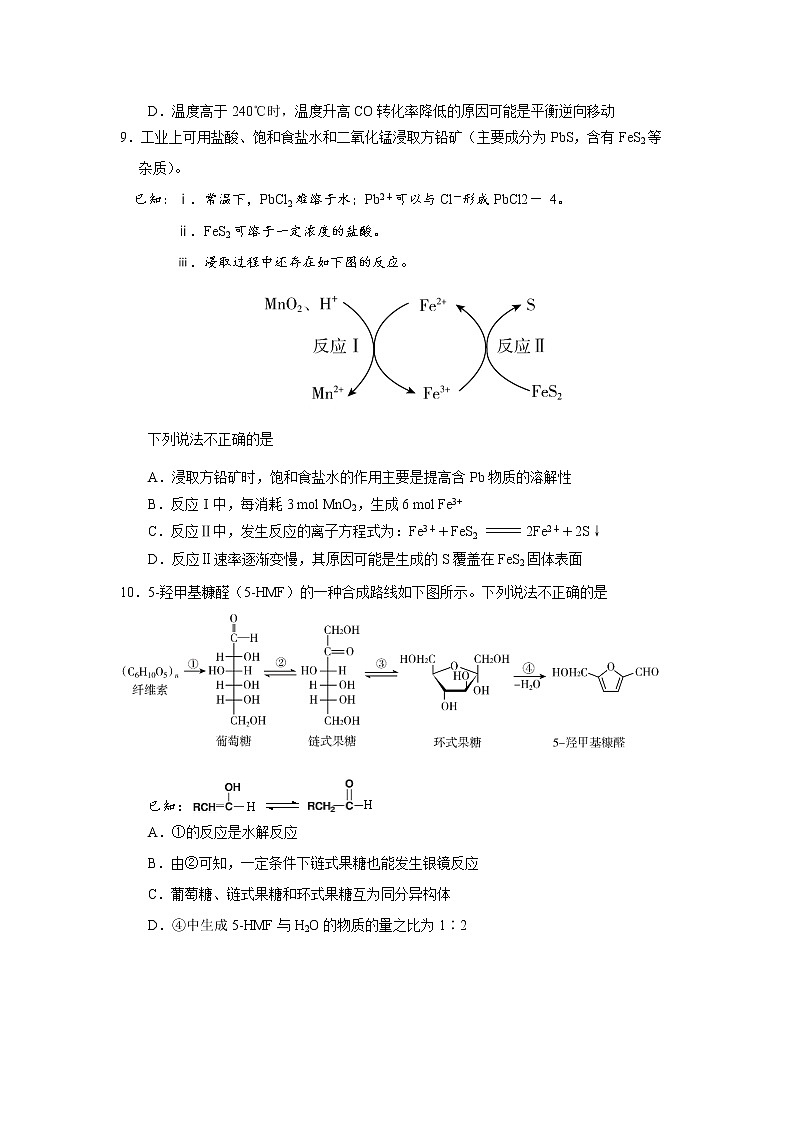
8.工业上可以利用水煤气(H2、CO)合成二甲醚(CH3OCH3),同时生成CO2。合成过程中,主要发生三个反应,T℃时,有关反应及相关数据如下。
2 H2(g) + CO(g) CH3OH(g) ΔH =- 91.8 kJ·mol-1
2CH3OH(g) CH3OCH3 (g) + H2O(g) ΔH =-23.5 kJ·mol-1
CO(g) + H2O(g) CO2(g) + H2(g) ΔH =-41.3 kJ·mol-1
保持原料气组成、压强、反应时间等因素不变,进行实验,测得CO转化率随温度变化曲线如下图。
下列说法不正确的是
A.T℃时,水煤气合成二甲醚的热化学方程式:
3H2(g)+ 3CO(g) CH3OCH3 (g) + CO2(g) ΔH =-248.4 kJ·mol-1
B.T℃时,增大压强、加入催化剂均可提高CO的平衡转化率
C.220℃~ 240℃时,温度升高反应速率加快,CO转化率升高
D.温度高于240℃时,温度升高CO转化率降低的原因可能是平衡逆向移动
9.工业上可用盐酸、饱和食盐水和二氧化锰浸取方铅矿(主要成分为PbS,含有FeS2等杂质)。
已知:ⅰ.常温下,PbCl2难溶于水;Pb2+可以与Cl-形成PbCl2- 4。
ⅱ.FeS2可溶于一定浓度的盐酸。
ⅲ.浸取过程中还存在如下图的反应。
下列说法不正确的是
A.浸取方铅矿时,饱和食盐水的作用主要是提高含Pb物质的溶解性
B.反应Ⅰ中,每消耗3 mol MnO2,生成6 mol Fe3+
C.反应Ⅱ中,发生反应的离子方程式为:Fe3++FeS2 ===== 2Fe2++2S↓
D.反应Ⅱ速率逐渐变慢,其原因可能是生成的S覆盖在FeS2固体表面
10.5-羟甲基糠醛(5-HMF)的一种合成路线如下图所示。下列说法不正确的是
H
H
已知:
A.①的反应是水解反应
B.由②可知,一定条件下链式果糖也能发生银镜反应
C.葡萄糖、链式果糖和环式果糖互为同分异构体
D.④中生成5-HMF与H2O的物质的量之比为1∶2
11.由实验操作和现象,可得出相应正确结论的是
实验操作和现象
结论
A
向NaBr溶液中滴加过量氯水,溶液变为橙色,再加入淀粉KI溶液,溶液变为蓝色
氧化性:Cl2>Br2>I2
B
将补铁剂溶于盐酸,过滤,将滤液加入KMnO4溶液中,溶液紫色褪去
补铁剂中含有二价铁
C
在5 mL FeCl3溶液中滴加2滴Na2SO3溶液,溶液变为红褐色,再滴加K3[Fe(CN)6]溶液,产生蓝色沉淀
发生了水解反应和氧化还原反应
D
将充满NO2的试管倒扣在盛有足量水的水槽中,试管中液面上升,试管顶部仍有少量气体
收集的NO2中含有不溶于水的杂质气体
12.聚氨酯水凝胶M是一种良好的药物载体,由三种原料在70℃及催化剂条件下合成,其结构片段如下图(图中表示链延长)。下列说法不正确的是
70℃
催化剂
O=C=N-R1 + R2-O-H
R2-O-C-NH-R1
已知:
A.Z对应的原料单体是乙二醇
B.合成聚氨酯水凝胶M的原料之一为:
C.1个X对应的原料分子中至少含有4个羟基
D.聚氨酯水凝胶M通过水解反应可再次得到合成时所用的三种原料
13.常温下,向10mL浓度均为0.1mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1mol·L-1盐酸,溶液pH随盐酸加入体积的变化如下图所示。下列说法不正确的是
已知:常温常压下,1体积水能溶解约1体积CO2。
A.a点的溶液中,c (OH-) >c (Cl-)
B.b点(pH=7)的溶液中,2n (CO2- 3) + n (HCO- 3) < 0.001 mol
C.c点的溶液pH<7,是因为此时HCO- 3的电离能力大于其水解能力
D.d点的溶液中,c(Na+)=c(Cl-)
14.某同学检验海带中是否含有碘元素,进行了如下实验。
步骤Ⅰ:灼烧干海带得到海带灰;
步骤Ⅱ:将海带灰加蒸馏水溶解、过滤,得到海带灰浸取液;
步骤Ⅲ:取少量浸取液于试管中,加入淀粉溶液,溶液未变蓝;再加入10% H2O2溶液(硫酸酸化),溶液变为蓝色;
步骤Ⅳ:将10% H2O2溶液(硫酸酸化)替换为氯水,重复步骤Ⅲ,溶液未变蓝;
步骤Ⅴ:向步骤Ⅳ所得溶液中通入SO2,溶液迅速变为蓝色。
下列说法不正确的是
A.步骤Ⅰ中,灼烧干海带的目的是除去有机化合物,获得可溶性碘化物
B. 步骤Ⅲ中,反应的离子方程式:H2O2 + 2I-+ 2H+===== I2 + 2H2O
C.若将步骤Ⅴ中的SO2替换为KI溶液,也可能观察到溶液变为蓝色
D.对比步骤Ⅲ、Ⅳ和Ⅴ中实验现象,说明该条件下H2O2氧化性比氯水强
第二部分(非选择题 共58分)
本部分共5题,共58分。
15.(9分)随着科学的发展,氟及其化合物的用途日益广泛。
Ⅰ.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。
1-乙基-3-甲基咪唑四氟硼酸盐 ([Emim]BF4)
(1)写出基态铜原子的价电子排布式 。
(2)NaBF4是制备此离子液体的原料。
①微粒中F—B—F键角:BF3 BF-4(填“>”、“<”或“=”)。
②BF3可以与NaF反应生成NaBF4的原因是 。
(3)以Cu(BF4)2和[Emim]BF4的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为 ,电解质溶液中Cu2+向 (填“阴”或“阳”)极移动。
Ⅱ.NaF等氟化物可以做光导纤维材料,一定条件下,某NaF的晶体结构如下图。
F-
Na+
(4)与F-距离最近且相等的Na+有________个。
(5)NA表示阿伏伽德罗常数的值。NaF晶胞为正方体,边长为a nm,则晶体的摩尔体积Vm = m3· mol-1 。(nm=10-9m)
16.(10分)化学平衡常数在定性分析与定量分析中应用广泛。
(1)一定温度下,在密闭容器中反应:I2(g) + H2(g) 2HI(g),测得如下数据。
t0
t1
t2
t3
c(I2) /mol·L-1
0.50
0.22
0.11
0.11
c(H2) /mol·L-1
0.50
0.22
0.11
0.11
c(HI) / mol·L-1
0.00
0.56
0.78
0.78
① 该温度下,I2的平衡转化率为 。
② 该温度下,当初始投为入浓度为c(I2)=0.44 mol·L-1,c(H2)=0.44 mol·L-1,
c(HI)=4.00 mol·L﹣1时,进行实验,反应进行的方向为 (填“正反应方向”或“逆反应方向”)。
(2)已知:25℃时,H2SO3 、H2CO3、HClO、CH3COOH的电离平衡常数。
物质
H2SO3
H2CO3
HClO
CH3COOH
电离平衡常数
Ka1=1.4´10﹣2
Ka2=6.0´10﹣8
Ka1=4.5´10﹣7
Ka2=4.7´10﹣11
Ka=4.0´10﹣8
Ka=1.8´10﹣5
① 25℃时,相同物质的量浓度的H2SO3、H2CO3、HClO、CH3COOH溶液,c(H+)由
大到小的顺序为 。
② 25℃时,向20.00 mL CH3COOH溶液中加入NaOH溶液达到滴定终点,再向溶液中加入CH3COOH溶液,使溶液中n(CH3COO-)=n(CH3COOH),溶液中c(H+)=
mol·L-1。
③ 结合电离平衡常数分析CO2与NaClO 溶液反应的产物 。
④ 将足量SO2通入AgNO3溶液中,迅速反应得到无色溶液和白色沉淀(Ag2SO3)。
放置一段时间,有Ag和SO2-4生成。先产生白色沉淀,后生成Ag和SO2-4的可能原因是 。
17.(13分)左氧氟沙星是一种具有广谱抗菌作用的药物,其前体K的合成路线如下:
LiAlH4
DHP
ⅰ.R一OH
ROH(其中DHP、PPTS是有机试剂缩写)
R一OPHT
PPTS
已知:
LiAlH4
ⅱ.R1一COOR2
R1一CH2OH+ R2OH
ⅲ.
(1)A中含—CH3,A→B的化学方程式是________。
(2)D的结构简式是________。
(3)已知试剂a的结构简式为 。D→E的反应类型为________。
(4)G分子中官能团名称为氟原子、醚键、__________、__________。
(5)已知试剂b为 。H的结构简式是__________。
(6)I中含有两个酯基,I的结构简式是__________。
-HF
N
M
CH2Cl2
ⅰ.KOH
ⅱ. H+
K
P
(7)K的另一种制备途径如下:
写出M、N、P的结构简式______、______、______。
18.(12分)钨精矿分解渣可回收制备氧化铁和碳酸锰。在70~80℃时,钨精矿分解渣用盐酸浸取,浸出液中主要金属离子为Fe3+、Mn2+和Ca2+,还含有少量Al3+、Cu2+等。浸出液进一步制备氧化铁和碳酸锰的部分工艺流程如下。
已知:ⅰ.金属离子的起始浓度为0.1mol·L-1时,生成氢氧化物沉淀的pH。
氢氧化物
Fe(OH)3
Al(OH)3
Cu(OH)2
Mn(OH)2
开始沉淀时
1.5
3.3
4.4
7.8
完全沉淀时
2.8
4.6
6.4
8.8
ⅱ.
物质
CaSO4
CaCO3
MnCO3
CuS
MnS
Ksp
7.1´10-5
2.8´10-9
2.3´10-13
1.3´10-36
2.5´10-13
(1)浸出液加入硫酸铵后,采取的分离操作是________。
(2)沉淀1的主要成分是________。
(3)已知,煅烧后的Fe2O3不溶于水和稀硝酸。粗氧化铁中除Fe2O3外,还含有
的物质是________。
(4)结合化学用语解释(NH4)2S溶液呈碱性的原因________。
(5)滤液3中含有Mn2+和Ca2+,加入Na2CO3主要沉淀出MnCO3的原因可能是
________。
(6)碳酸锰含量测定。
步骤1:准确称取0.1000 g碳酸锰样品于锥形瓶中,加入适量高磷混酸(主要含HClO4和H3PO4)加热至220~240℃,无小气泡冒出后,冷却至室温。
步骤2:用0.04 mol·L-1硫酸亚铁铵[ (NH4)2Fe(SO4)2]标准溶液滴定,消耗硫酸亚铁铵标准溶液体积为a mL。
已知:ⅰ.PO3- 4能与Mn3+络合形成稳定的[Mn(PO4)2]3-。
ⅱ.HClO4的沸点为203℃。
① 写出HClO4将Mn2+氧化为[Mn(PO4)2]3-,同时生成Cl2的离子方程式_______。
② 碳酸锰样品中锰的质量分数为________。
19.(14分)某小组同学探究不同条件下H2O2与三价铬(Cr)化合物的反应。
资料:ⅰ.Cr3+(墨绿色)、CrO-2(墨绿色)、Cr(OH)3(蓝色)、CrO2- 4(黄色)、
Cr2O2-7(橙色)、[Cr(O2)4]3-(砖红色)
ⅱ.Cr2O2-7+ H2O 2 CrO2- 4+ 2H+
ⅲ.H2O2 H+ + HO- 2;HO- 2H+ + O2- 2
室温下,向0.1 mol•L-1 Cr2(SO4)3溶液中滴加H2SO4溶液或NaOH溶液分别配制不同pH的Cr(III)溶液;取配制后的溶液各5 mL,分别加入足量30% H2O2溶液。
实验
①
②
③
④
加H2O2前
pH
4.10
6.75
8.43
13.37
现象
墨绿色溶液
蓝色浊液
蓝色浊液
墨绿色溶液
加H2O2后
现象
墨绿色溶液
黄绿色溶液
黄色溶液
砖红色溶液
(1)结合加H2O2前的实验现象,可推测Cr(OH)3具有________(填“碱性”、“酸性”或“两性”)。
(2)实验①中,加H2O2后无明显现象的原因可能是________。
(3)实验②中,蓝色浊液变为黄绿色溶液的原因可能是________。
(4)取实验③中黄色溶液,加入一定量稀硫酸,可观察到,溶液迅速变为橙色,最终变为绿色,观察到有无色气体产生。结合化学用语解释上述实验现象________。
(5)已知[Cr(O2)4]3-中Cr为+5价。实验④中,加入H2O2后发生反应的离子方程式为
________。
(6)取少量实验④的砖红色溶液,加热,随着温度的升高,溶液最终变为黄色。针对溶液的颜色变化,该小组同学提出如下猜想。
猜想1:加热条件下,[Cr(O2)4]3-发生自身氧化还原反应,生成CrO2- 4;
猜想2: 。
针对上述猜想,该小组同学另取少量实验④的砖红色溶液, ,溶液由砖红色变为黄色,由此得出猜想1成立。
(7)综合以上实验,影响H2O2与三价铬化合物反应的因素除了pH,还有_______。
辽宁省协作校2022-2023学年度高三第二次模拟考试化学试卷: 这是一份辽宁省协作校2022-2023学年度高三第二次模拟考试化学试卷,文件包含辽宁省协作校2022-2023学年度高三第二次模拟考试暨朝阳一高中第三次模拟考试化学试卷docx、二模答案定稿pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
2022-2023学年北京市海淀区高三第二次模拟考试化学试卷(含解析): 这是一份2022-2023学年北京市海淀区高三第二次模拟考试化学试卷(含解析),共30页。试卷主要包含了单选题,实验题,简答题,推断题等内容,欢迎下载使用。
北京市东城区2022-2023学年度高三化学模拟试题及答案: 这是一份北京市东城区2022-2023学年度高三化学模拟试题及答案,共9页。












