

江西省鹰潭市2021届-2023届高考化学三年模拟(一模)按题型分类汇编-02非选择题
展开这是一份江西省鹰潭市2021届-2023届高考化学三年模拟(一模)按题型分类汇编-02非选择题,共40页。试卷主要包含了工业流程题,实验题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。
江西省鹰潭市2021届-2023届高考化学三年模拟(一模)按题型分类汇编-02非选择题
一、工业流程题
1.(2021·江西鹰潭·统考一模)硼、镁及其化合物在工农业生产中应用广泛。已知硼镁矿的主要成分为,硼砂的化学式为。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图1所示。
(1)硼砂中B的化合价为_______。
(2)在实验室可以用与水反应得到,且反应前后B的化合价不变,该反应的化学方程式为_______。X为氧化物,是晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_______。
(3)短周期元素M与B同一主族,其单质在时可与反应制备MN,在这种单质中添加少量固体并充分混合,有利于的制备,其主要原因是_______。
(4)制得的粗硼在一定条件下反应生成,在一定条件下受热分解可以得到纯净的单质硼。0.2000g粗硼制成的完全分解,将生成的I2配制成碘水,量取碘水于锥形瓶中,向其中滴加几滴淀粉溶液,用溶液滴定至终点,消耗溶液。(提示:)滴定终点的现象为_______,该粗硼样品的纯度为_______%。
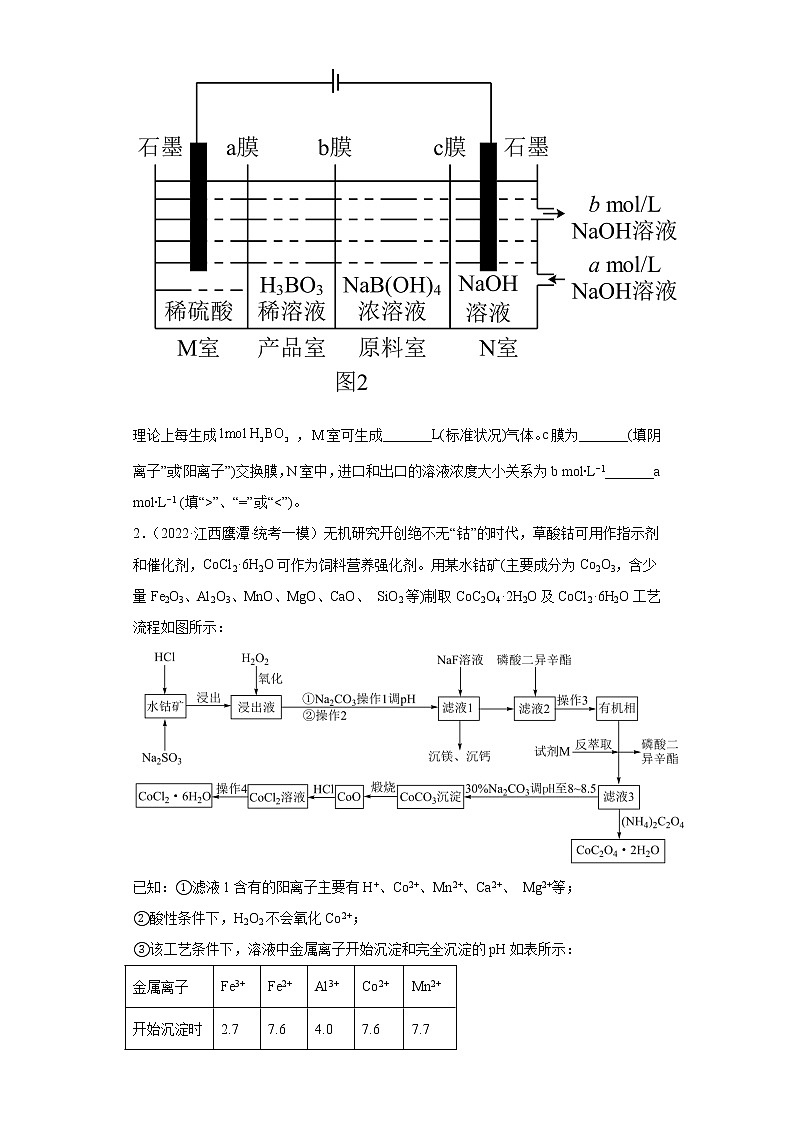
(5)[也可写成]可以通过电解溶液的方法制备。工作原理如图2所示。
理论上每生成,室可生成_______L(标准状况)气体。c膜为_______(填“阴离子”或“阳离子”)交换膜,N室中,进口和出口的溶液浓度大小关系为b mol∙L−1_______a mol∙L−1 (填“>”、“=”或“<”)。
2.(2022·江西鹰潭·统考一模)无机研究开创绝不无“钴”的时代,草酸钴可用作指示剂和催化剂,CoCl2·6H2O可作为饲料营养强化剂。用某水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、 SiO2等)制取CoC2O4·2H2O及CoCl2·6H2O工艺流程如图所示:
已知:①滤液1含有的阳离子主要有H+、Co2+、Mn2+、Ca2+、 Mg2+等;
②酸性条件下,H2O2不会氧化Co2+;
③该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子
Fe3+
Fe2+
Al3+
Co2+
Mn2+
开始沉淀时
2.7
7.6
4.0
7.6
7.7
完全沉淀时
3.7
9.6
5.2
9.2
9.8
回答下列问题:
(1)“浸出”过程中,Co2O3参与反应的离子方程式为_______。
(2)“氧化”过程中涉及的反应离子方程式_______。
(3)“操作1”调pH的范围为_______。
(4)在实验室完成“操作3”需用到的玻璃仪器有_______。
(5)“操作4”洗涤过程中可以用工业酒精代替水,其优点是_______。
(6)由已知③可知,当Al3+完全沉淀(Al3+浓度为1.0 ×10-5mol·L-1 )时Fe3+的浓度为_______。
(7)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是_______(填选项,忽略亚钴离子的颜色干扰)。已知几种物质在20°C时的颜色及Ksp值如表:
化学式
AgCl
AgSCN
Ag2S
Ag2CrO4
颜色
白色
浅黄色
黑色
红色
Ksp
2.0×10-10
1.0×10-12
2.0×10-48
2.0×10-12
A.KCl B.K2CrO4 C.KSCN D.K2S
3.(2023·江西鹰潭·统考一模)随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂(LEP)是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如下:
已知: i.废旧磷酸铁锂正极片中的化学物质均不溶于水也不与水反应。
ii.Li2CO3在水中的溶解度随温度升高而降低,但煮沸时与水发生反应。
回答下列问题:
(1)LiFePO4中用途最广用量最大的金属元素在周期表中的位置是___________。
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如下表,实际生产中氧化剂选用H2O2,不选用NaClO3的原因是___________。在“氧化浸出”时,适当的升温可加快反应速率,但般不采取高温法, 其原因是___________。“氧化浸出”时生成了难溶的FePO4,该反应的离子方程式为。___________。
序号
锂含量/%
氧化剂
pH
浸出液Li浓度/(g·L-1)
浸出渣中Li含量/%
1
3.7
H2O2
3.5
9.02
0.10
2
3.7
NaClO3
3.5
9.05
0.08
3
3.7
O2
3.5
7.05
0.93
4
3.7
NaClO
3.5
8.24
0.43
(3)“浸出液”循环两次的目的是___________。
(4)“滤渣II”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得LiFePO4,实现再生利用,其化学方程式为___________。
(5)“一系列操作”具体包括___________、洗涤、干燥。
二、实验题
4.(2021·江西鹰潭·统考一模)亚硝酸钠(NaNO2)易溶于水,微溶于乙醇,可作为肉类食品的护色剂,并可以防止肉毒杆菌在肉类食品中生长,保持肉制品的结构和营养价值;但是过量摄入会导致中毒。某化学兴趣小组对亚硝酸钠进行多角度探究:
I.亚硝酸钠的制备
(1)实验中用恒压滴液漏斗,相比普通分液漏斗,其显著优点是________。
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为_______。
II.探究亚硝酸钠与硫酸反应生成的气体产物
已知:①NO+NO2+2OH-=2NO+H2O ②气体液化的温度:NO2:21℃,NO:-152℃
(3)反应前应打开弹簧夹,先通入一段时间氮气,其目的是______。
(4)为了检验装置A中生成的气体产物,装置的连接顺序(从左→右连接):A、C、______、_______、______。
(5)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是_______。
②装置E的作用是________。
③通过上述实验探究过程,可得出装置A中反应的化学方程式为_______。
III.设计实验证明酸性条件下NaNO2具有氧化性
(6)供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液。根据提供的试剂,设计酸性条件下NaNO2具有氧化性的实验方案:_____。
5.(2022·江西鹰潭·统考一模)2021 年10月16日神舟十三号载人飞船发射成功,肼是一种良好的火箭燃料,分子式N2H4,为无色油状液体,与水按任意比例互溶形成稳定的水合肼N2H4·H2O,沸点118°C,有强还原性。实验室先制备次氯酸钠,再与尿素[CO(NH2)2]反应制备水合肼,进一步脱水制得肼,实验装置如图所示(部分装置省略)。已知:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
(1)装置C中制备NaClO的离子方程式为_______。反应过程中温度升高易产生副产物NaClO3,可采取的措施是_______。装置B中装有饱和食盐水,反应完后关闭K1,装置B的作用是_______。
(2)将装置C中制备的溶液转移到装置D的_______中,并缓缓滴入,原因是_______。
(3)装置D蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3 ·10H2O,获得NaCl粗品的操作是_______(NaCl和Na2CO3的溶解度曲线如图)。
(4)称取5.0g水合肼样品,加水配成500mL溶液,从中取出10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.20mol/L的I2溶液进行滴定,滴定终点的现象是_______,测得消耗I2溶液的体积为17.50mL,则样品中水合肼N2H4·H2O)的质量百分数为_______(用百分数表示并保留3位有效数字)。(已知:N2H4·H2O +2I2=N2↑+4HI+H2O)
(5)脱水制得的液态肼,在加热条件下可与新制的Cu(OH)2制备纳米级Cu2O,并产生无污染气体,写出该反应的化学方程式:_______。
6.(2023·江西鹰潭·统考一模)连二亚硫酸钠(Na2S2O4)是重要的化工产品,可用SO2与Zn、NaOH溶液反应制取。实验室模拟制备的工艺流程及制取装置如图。
已知:①连二亚硫酸钠易溶于水、难溶于乙醇、在碱性介质中较稳定、在空气中易被氧化。
②二价锌在水溶液中的存在形式与pH的关系如图。
请回答下列问题:
(1)通入一段时间SO2的作用除了充当反应物以外还有_______。需调节溶液为弱碱性的原因:_______。
(2)写出制取连二亚硫酸钠的总反应方程式对应的离子方程式:___________。
(3)下列说法正确的是_________。
A.将锌粉投入水中形成悬浮液主要是为了加快反应速率
B.单向阀的主要作用是防止氧气倒吸进入装置中
C.洗涤Na2S2O4·2H2O时用水洗涤效果比酒精好
D.向Na2S2O4溶液中加NaCl的稀溶液或固体对Na2S2O4的产率无明显影响
(4)请选择最佳操作并排序完成制备Na2S2O4·2H2O晶体。安装好整套装置,并检查装置的气密性→___________→过滤取滤液并加入 NaCl固体,冷却至窒温、过滤,洗涤,干燥得晶体。
a.将一定量的Zn粉与蒸馏水混合搅拌成悬浊液
b.向溶液中滴加NaOH至pH在8.2 ~ 10.5之间
c.28 ~ 35℃加热条件下,向悬浊液中通入SO2至澄清
(5)称取上述制得的连二亚硫酸钠样品0.0800g加入另一三颈烧瓶, 通过自动电位滴定仪控制滴定管向三颈烧瓶中快速滴加K3[Fe(CN)6]溶液将连二亚硫酸钠氧化为硫酸钠,记录终点读数,共消耗10.00mL0.2000mol·L-1的K3[Fe(CN)6]溶液,则样品中连二亚硫酸钠的纯度为_______。样品中可能存在的杂质有________。
三、原理综合题
7.(2021·江西鹰潭·统考一模)碘及碘的化合物在人类活动中占有重要的地位。已知反应H2(g)+I2(g)2HI(g)ΔH=-14.9kJ·mol-1。
(1)根据下图判断1molH2(g)分子中化学键断裂时需要吸收的能量为___________kJ。
(2)氢气和碘蒸气能直接反应生成碘化氢,T℃时,向1L的恒容密闭容器中充入0.2mol H2(g)和0.2mol I2(g),5min时反应达到平衡,H2(g)、I2(g)和HI(g)的物质的量浓度(c)随时间(t)变化的曲线如图所示:
0~5min内,用H2(g)表示的该反应速率v(H2)=__________。6min时,改变的外界条件为__________。
(3)反应H2(g)+I2(g)2HI(g)的反应机理如下:
第一步:I22I(快速平衡);
第二步:I+H2H2I(快速平衡);
第三步:H2I+I→2HI(慢反应)。
则该反应的反应速率由__________步决定。
(4)将等物质的量的I2和H2置于预先抽真空的特制1L恒容密闭容器中,加热到1500K,起始总压强为416kPa;体系达到平衡时,总压强为456kPa。若体系中只考虑如下反应关系:
①I2(g) 2I(g)Kpl=200ΔH1
②I2(g)+H2(g)2HI(g)Kp2ΔH2
KP为以分压表示的平衡常数。1500K时,平衡体系中I(g)的分压为__________kPa,Kp2=__________(写表达式)。
(5)某实验兴趣小组将氧化还原反应2Cu2++5I-2CuI↓++设计成如图所示的原电池装置:
带孔的封蜡鸡蛋壳为半透膜,鸡蛋壳内的电极为__________(填“正极”或“负极”);该电极反应式为__________。
8.(2022·江西鹰潭·统考一模)2020年9月在75届联合国大会上,中国庄严承诺:2030年前实现碳达峰,2060年前实现碳中和。实现CO2大规模减排,需要多措并举,其中碳资源的综合利用成为重中之重。
I.甲醇的制备和利用
(1)甲醇不仅是重要的化工原料,还是性能优良的车用燃料。CO2和H2在Cu/ZnO催化作用下可以合成甲醇:CO2+3H2=CH3OH+H2O,此反应分两步进行:
反应I:_______∆H>0
反应II:Cw/Zn+2H2+CO2=Cu/ZnO+CH3OH∆H<0
①反应I的化学反应方程式为_______。
②反应II几乎不影响总反应达到平衡所用的时间,如图能正确表示Cu/ZnO催化CO2和H2合成甲醇反应过程的是_______(填标号)
A.B.
C.D.
(2)科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳中和的目标。原理如图所示:
P极电极反应式为_______。
II.二甲醚的制备
(3)二甲醚(CH3OCH3)是未来制取低碳烯烃的主要原料之一,也是一种优良的洁净燃料。
利用CO2催化加氢制备二甲醚过程中发生的化学反应为:
反应I:CO2(g)+H2(gCO(g)+H2O(g)∆H1>0
反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g)∆H2<0
反应III:2CH3OH(g)CH3OCH3(g)+H2O(g)∆H3<0
①一定条件下,在恒容密闭容器中按=3投料进行上述反应,CO2的平衡转化率及CO、CH3OCH3、CH3OH的平衡体积分数随温度变化如图所示。
曲线X表示_______的平衡体积分数随温度变化,温度从453K上升至573K,CO2的平衡转化率变化的原因是_______。
②一定温度下,向体积为1L的恒容密闭容器中通入1molCO2和3molH2进行上述反应,反应经10min达到平衡,此时CO2的平衡转化率为30%,容器中CO(g)为0.05mol,CH3OH(g)为0.05mol。0~10min,用CH3OCH3(g)的物质的量浓度变化表示的平均反应速率v(CH3OCH3)=_______,反应III的化学平衡常数K=_______。
9.(2023·江西鹰潭·统考一模)当今,世界多国相继规划了碳达峰、碳中和的时间点。因此研发CO2的回收和综合利用成为研究热点。
I.一种脱除和利用水煤气中CO2的方法为,在吸收塔中用K2CO3溶液吸收CO2;吸收液再生可得较纯净的CO2用于合成其他物质。
(1)若K2CO3溶液吸收一定量的CO2后,c()= 5c(),则该溶液的pH=___________(该温度下H2CO3的Ka1=4.6×10-7,Ka2=5.0×10-11)。
II.CO2可用于合成低碳烯烃:2CO2(g)+6H2(g) = CH2=CH2(g)+4H2O(g) ΔH =a kJ/mol
(2)已知: H2和CH2 = CH2的标准燃烧热分别是285.8 kJ/mol和1410.0 kJ/mol。H2O(g) = H2O(l) ΔH =- 44 kJ/mol 则a=___________kJ/mol。
(3)上述由CO2合成CH2= CH2的反应在下___________。自发(填“高温”或“低温”)。
(4)如图所示为在体积为1 L的恒容容器中,投料为3mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响。
①下列说法正确的是___________。
a.其他条件不变,若不使用催化剂,则250°C时CO2的平衡转化率可能位于点M1
b.平衡常数大小: M>N
c.其他条件不变,若投料改为4mol H2和1 mol CO2时,则250℃时CO2的平衡转化率可能位于点M2
d.当压强、混合气体的密度或n(H2)/n(CO2)不变时均可视为化学反应已达到平衡状态
②计算250℃时该反应平衡常数的数值K=___________。
③若达到平衡后再向体系内通入1.5 mol CO2和1 mol H2O, 则平衡___________ (填向左移动、向右移动或不移动)。
III.利用“Na -CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na -CO2 ”电池,以等质量的钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO22Na2CO3 +C。放电时该电池“吸入”CO2,其工作原理如图所示:
(5)若生成的Na2CO3和C全部沉积在电极表面,放电时,正极的电极反应式为___________,当转移0.4mol e- 时,两电极的质量差为___________ g。
四、结构与性质
10.(2021·江西鹰潭·统考一模)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)的价电子排布图为:__;基态磷原子有___种空间运动状态不同的电子。
(2)Li、O、P三种元素的电负性由大到小的顺序是:__。
(3)写出一种与互为等电子体的分子的化学式:__,该分子的中心原子的价层电子对数等于__。
(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:__。
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是分子中的键角大于分子中的键角,原因是:___。
(6)为离子晶体,具有反萤石结构,晶胞如下图所示。则配位数为:__,若晶胞参数为bnm,阿伏加德罗常数的值为,则的密度为__(列出计算式即可)。
11.(2022·江西鹰潭·统考一模)太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜钢镓硒(中掺入)等化合物薄膜太阳能电池以及薄膜系太阳能电池。
(1)亚铜离子基态时的价电子排布式表示为___________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为___________(用元素符号表示)。
(3)晶体的堆积方式是___________(填堆积名称),其配位数为___________;往的硫酸盐溶液中加入过量氨水,可生成,下列说法正确的是___________。
A.中所含的化学键有离子键、极性键和配位键
B.在中给出孤电子对,提供空轨道
C.组成元素中第一电离能最大的是氧元素
D.与互为等电子体,空间构型均为正四面体形
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸()溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
①中B的原子杂化类型为___________杂化;
②写出硼酸在水溶液中的电离方程式___________。
(5)硅与碳是同一主族元素,其中石墨为混合型晶体,已知石墨的层间距为,键长为,计算石墨晶体密度=___________(结果保留两位有效数字,为)。
12.(2023·江西鹰潭·统考一模)Co、Al、 Si形成的合金是一种高性能的热电材料,备受研究人员关注。回答下列问题:
(1)基态Co原子的核外电子排布式为___________,它处于元素周期表的___________区。
(2)下列各状态的铝中,再电离出一个电子所需能量最小的是___________ (填序号)。
A. B.
C. D.
(3)AlCl3是某些有机反应的催化剂,如苯酚()与乙酰氯()反应的部分历程为。
①乙酰氯分子中碳原子的杂化类型为___________。
②乙酰氯分子中C-C键与C-Cl键的夹角___________ 120°(填“大于“等于”或“小于”), 判断理由是___________。
③的空间构型为___________。
(4)金刚石、金刚砂(SiC)、单晶硅的熔点由低到高的顺序为___________。
(5)Co、Al、Si形成的一种合金的晶胞结构如图所示(若不看, 该晶胞具有萤石结构),1号原子、2号原、Al原子的分数坐标分别为(0, 1, 0)、(,,)、(,,),则3号原子的分数坐标为___________ ; 若晶胞参数为anm,,则该合金的密度为___________g·cm-3(NA表示阿伏加德罗常数的值,只需列出式子)。
五、有机推断题
13.(2021·江西鹰潭·统考一模)化合物M是一种医用高分子材料,可用于制造隐形眼镜;以下是M、有机玻璃的原料H及合成橡胶(N)的合成路线。
(1)A的结构简式是____。
(2)写出反应类型:G→H___;写出反应条件:D→E___。
(3)写出B→C化学反应方程式:___;
(4)写出E+F→N化学反应方程式:___。
(5)H在一定条件下能被氧化为不饱和酸 ,该不饱和酸有多种同分异构体,属于酸类且含有碳碳双键的同分异构体共有__种。
(6)已知:①RCHO
②
③+SOCl2→+SO2+HCl;R-OH+SOCl2→R-Cl+SO2+HCl
根据已有知识并结合相关信息,写出以为原料制备的合成路线流程图(无机试剂任用)______。合成路线流程图示例如下:。
14.(2022·江西鹰潭·统考一模)合成药物盐酸普罗帕酮的中间体E和双酚A型聚碳酸酯的路线:
已知: i.RCOOR'+ R"OH RCOOR"+ R'OH(R、 R'、 R"代表烃基)
ii.
(1)A的结构简式是_______,试剂a是_______。
(2)C只含有一种官能团,反应②的化学方程式是_______。
(3)反应⑤的反应类型是_______,E中官能团名称是_______。
(4)M的相对分子质量比J大14, 满足下列条件M的同分异构体共有_______种。
①苯环之外无其它环状结构,苯环上三个取代基
②苯环上有两种氢
③与FeCl3(aq)显色,且1molM最多能和2molNaOH反应。
写出其中任意一种核磁共振氢谱峰面积比为 1: 2: 2: 2: 3同分异构体的结构简式_______。
(5)下列说法正确的是: _______ (填字母序号)。
a.反应③中C发生氧化反应
b.可用FeCl3溶液检验反应⑤中A是否反应完全
c.反应⑥的反应物与生成物互为同分异构体
d.反应物⑩中试剂b的结构简式是
e.反应④是缩合聚合反应,生成了聚酯
(6)参照上述合成路线和信息,写出以乙醇为原料合成2-丁烯酸(CH3CH=CHCOOH)的合成路线(无机试剂任选)_______。
15.(2023·江西鹰潭·统考一模)化合物W是合成风湿性关节炎药物罗美昔布的一种中间体,其合成路线如下:
已知: (i)
(ii)
回答下列问题:
(1)A的化学名称是___________, B中含氧官能团的名称是 ___________。
(2)由B生成C的反应类型是___________。
(3)写出由G生成H的化学方程式: ___________。
(4)写出I的结构简式: ___________。
(5)Y为X的同系物,分子式为C8H9Br,Y的可能结构有___________种。
(6)设计由甲苯和 制备 的合成路线___________。(无机试剂任选)
参考答案:
1. +3 氯化铵分解产生的氯化氢能够破坏铝表面的氧化铝薄膜 滴加最后一滴溶液,锥形瓶中溶液蓝色恰好褪去,且半分钟内不恢复原色 93.5 5.6 阳离子 >
【分析】硼镁矿的主要成分为,硼镁矿加入浓NaOH溶液,过滤得到氢氧化镁沉淀,氢氧化镁加入浓盐酸,蒸发结晶得到MgCl2∙6H2O,一定条件下得到MgCl2,再电解熔融MgCl2得到镁单质;滤液浓缩得到,通入适量二氧化碳得到硼砂,硼砂中加水、调节pH后冷却结晶得到硼酸,硼酸加热得到三氧化二硼,三氧化二硼和镁单质高温反应生成硼和氧化镁。
【详解】(1)硼砂()中Na、H、O的化合价依次为+1、+1、-2,根据化合物中元素的正负化合价代数和为0,B的化合价为+3;故答案为:+3。
(2)在实验室可以用与水反应得到,且反应前后B的化合价不变,则中氢元素化合价升高,水中氢元素化合价降低得到氢气,该反应的化学方程式为。X为氧化物,是晶体加热脱水的产物,其化学式为,其与Mg制取粗硼的化学方程式为;故答案为:;。
(3)根据题意得到M为Al,Al在时可与反应制备MN,在这种单质中添加少量固体并充分混合,有利于的制备,其主要原因是氯化铵分解产生的氯化氢,氯化氢能够与铝表面的氧化铝薄膜反应,破坏铝表面的氧化铝薄膜;故答案为:氯化铵分解产生的氯化氢能够破坏铝表面的氧化铝薄膜。
(4)根据题意得到滴定终点的现象为滴加最后一滴溶液,锥形瓶中溶液蓝色恰好褪去,且半分钟内不恢复原色,根据2B~2~3I2~6,得到n(B)=,该粗硼样品的纯度为;故答案为:滴加最后一滴溶液,锥形瓶中溶液蓝色恰好褪去,且半分钟内不恢复原色;93.5。
(5)理论上每生成,即由1mol H+和1mol反应生成,说明有1mol H+穿过a膜进入到产品室,即有1mol电子发生转移,根据4mol e-~O2,则室可生成0.25mol氧气,在标准状况下的体积为5.6L。阴极水中氢离子放电,剩余氢氧根,要使得电荷守恒,因此原料室的钠离子穿过c膜进入到N室即c膜为阳离子交换膜,在N室中生成NaOH,因此进口和出口的溶液浓度大小关系为b mol∙L−1>a mol∙L−1;故答案为:5.6;阳离子;>。
2.(1)
(2)2Fe2++H2O2+2H+=2H2O+2Fe3+
(3)
(4)烧杯、玻璃棒、漏斗
(5)能够减少晶体的溶解损失,且酒精易挥发,便于晶体干燥
(6)
(7)B
【分析】由流程图可知,“浸出”过程中,亚硫酸钠与Co2O3发生了氧化还原反应,依据得失电子守恒、电荷守恒和原子守恒,可以写出离子方程式,由已知条件:滤液1含有的阳离子主要有H+、Co2+、Mn2+、Ca2+、Mg2+、Al3+等,“操作1”调pH的目的是除去溶液中的铁离子和铝离子,但Co2+、Mn2+并未沉淀,依据金属离子开始沉淀和完全沉淀的pH范围可知,“操作1”调节pH的范围,以此解题。
【详解】(1)由流程图可知,“浸出”过程中,亚硫酸钠与Co2O3发生了氧化还原反应,依据得失电子守恒、电荷守恒和原子守恒,反应的离子方程式为:;
(2)氧化过程中在酸性条件下过氧化氢将二价铁氧化为三价铁,方程式为:2Fe2++H2O2+2H+=2H2O+2Fe3+;
(3)“操作1”调节pH的目的是除去溶液中的铁离子和铝离子,范围为:;
(4)经分析可知,“操作2”为过滤,过滤所需玻璃仪器有:烧杯、玻璃棒、漏斗;
(5)“操作4”为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,洗涤过程中用工业酒精代替水,能够减少晶体的溶解损失,且酒精易挥发,便于晶体干燥;
(6)由表格可求,氢氧化铁的溶度积,当铝离子恰好完全沉淀时,氢氧根离子浓度为,此时铁离子的浓度为:;
(7)滴定原理为通过硝酸银先沉淀氯离子,氯离子反应完后硝酸银与指示剂结合产生现象,所以指示剂与硝酸银生成的沉淀的溶解度应大于氯化银,,。
A.通过标准硝酸银溶液滴定未知浓度的CoCl2溶液,不能加入含氯离子的物质,A错误;
B.,,所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度比氯化银大,B正确;
C. AgSCN组成与AgCl相同,而Ksp(AgSCN)
答案选B。
3.(1)第四周期VIII族
(2) 与盐酸反应产生,污染生产环境 防止H2O2分解和盐酸挥发
(3)可提高盐酸与H2O2的利用率
(4)2FePO4+ Li2CO3+ H2C2O42LiFePO4+H2O↑+3CO2↑
(5)水浴加热、趁热过滤
【分析】废旧磷酸铁锂正极片(LiFePO4、导电石墨、铝箔)首先用NaOH溶液浸取,Al溶解得到偏铝酸盐,过滤分离出含偏铝酸钠的溶液,滤渣I为LiFePO4及石墨,加盐酸与氧化剂,将LiFePO4氧化得含有Li+的溶液和FePO4沉淀,过滤分离出滤渣Ⅱ含炭黑、FePO4,滤液含LiCl,浸出液循环两次提高盐酸与氧化剂的利用率,之后再加NaOH调节pH,除去少量铁离子,然后滤液加碳酸钠发生复分解反应生成Li2CO3,经一系列操作得Li2CO3,以此来解答。
【详解】(1)LiFePO4中用途最广用量最大的金属元素是Fe,其在周期表中的位置是:第四周期VIII族;
(2)氧化浸出时,实际生产中氧化剂选用H2O2,因为NaClO3与盐酸反应产生Cl2,污染生产环境;为防止H2O2分解和盐酸挥发,故在氧化浸出时,一般不采取高温法;“氧化浸出”时,LiFePO4被H2O2 在酸性环境中氧化得到Li+和FePO4沉淀,根据电子守恒、元素守恒可得该反应的离子方程式为;
(3)“浸出液”循环两次的目的是提高盐酸与H2O2的利用率;
(4)“滤渣II”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得LiFePO4,实现再生利用,其化学方程式为2FePO4+ Li2CO3+ H2C2O42LiFePO4+H2O↑+3CO2↑;
(5)已知碳酸锂在水中的溶解度随温度升高而降低,但煮沸时与水发生反应,故沉锂时应水浴加热,温度保持在95℃;沉锂后要得碳酸锂产品,需进行趁热过滤、洗涤、干燥;故答案为:水浴加热;趁热过滤。
4. 平衡滴液漏斗与烧瓶内压强,便于稀硝酸溶液流下 4NO+O2+=+2CO2 排尽整个装置中的空气,防止产生的NO被氧化生成NO2 E D B D中通入氧气后,气体由无色变为红棕色 冷却二氧化氮,用来检验NO 取碘化钾溶液并滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许NaNO2溶液,溶液变蓝,证明NaNO2具有氧化性;或者取硫酸亚铁溶液并滴加稀硫酸酸化,滴加几滴KSCN溶液,溶液仍为浅绿色,滴加少许NaNO2溶液,此时溶液由浅绿色变为血红色,证明NaNO2具有氧化性
【分析】I.亚硝酸钠的制备:根据实验装置图可知,实验中用铜与稀硝酸反应生成NO,用水除去了挥发出来的硝酸,在碳酸钠溶液中与氧气反应生成亚硝酸钠,实验中的尾气用D装置吸收;
II.探究亚硝酸钠与硫酸反应气体产物成分:反应前应打开弹簧夹,先通入一段时间氮气,可排除装置内的空气,A中反应生成NO,然后用C干燥,E冷却二氧化氮,D检验NO,最后连接B,防止污染空气;
III.设计实验证明酸性条件下NaNO2具有氧化性,用淀粉、KI溶液检验,或可在酸性条件下氧化亚铁离子,用KSCN溶液检验。
【详解】I.(1)恒压滴液漏斗可以平衡内外压强相等,因此相比普通分液漏斗,显著的优点是平衡滴液漏斗与烧瓶内压强,便于稀硝酸溶液流下,故答案为:平衡滴液漏斗与烧瓶内压强,便于稀硝酸溶液流下;
(2)D中澄清石灰水变浑浊,说明有二氧化碳生成,反应物是NO、氧气和碳酸钠,则C中制备NaNO2的离子方程式为4NO+O2+=+2CO2,故答案为:4NO+O2+=+2CO2;
II.(3)NO很容易被氧气氧化,装置中有空气,无法检验有NO生成,所以通氮气的目的是排尽整个装置中的空气,防止产生的NO被氧化生成NO2,故答案为:排尽整个装置中的空气,防止产生的NO被氧化生成NO2;
(4)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,用来检验NO,所以装置的连接为A→C→E→D→B,故答案为:E;D;B;
(5)①D中无色气体变成红色,说明含有NO气体,因此确认A中产生的气体含有NO所依据的现象是D中通入氧气后,气体由无色变为红棕色,故答案为:D中通入氧气后,气体由无色变为红棕色;
②根据以上分析可知装置E的作用是冷却二氧化氮,用来检验NO,故答案为:冷却二氧化氮,用来检验NO;
③通过上述实验探究过程,可得出装置A中反应是亚硝酸钠与硫酸生成一氧化氮气体和二氧化氮气体,化学方程式为:,故答案为:;
III.(6)利用亚硝酸钠氧化碘化钾生成单质碘,碘遇淀粉显蓝色,则实验方案是:取碘化钾溶液并滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许NaNO2溶液,溶液变蓝,证明NaNO2具有氧化性;或者取硫酸亚铁溶液并滴加稀硫酸酸化,滴加几滴KSCN溶液,溶液仍为浅绿色,滴加少许NaNO2溶液,此时溶液由浅绿色变为血红色,证明NaNO2具有氧化性;故答案为:取碘化钾溶液并滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许NaNO2溶液,溶液变蓝,证明NaNO2具有氧化性;或者取硫酸亚铁溶液并滴加稀硫酸酸化,滴加几滴KSCN溶液,溶液仍为浅绿色,滴加少许NaNO2溶液,此时溶液由浅绿色变为血红色,证明NaNO2具有氧化性。
5.(1) 将氢氧化钠溶液采用冰水浴的方式降温 储存多余的Cl2
(2) 分液漏斗 若滴加次氯酸钠较快,反应生成的水合肼会被次氯酸钠氧化,导致产率降低
(3)加热至有大量固体析出,趁热过滤
(4) 最后一滴碘溶液加入,溶液变成蓝色,且半分钟不褪色 87.5%
(5)
【分析】用浓盐酸和二氧化锰加热制取氯气,并用冷却的氢氧化钠溶液吸收得到次氯酸钠,再用次氯酸钠和尿素反应生成水合肼,注意控制次氯酸钠的加入速率,防止水合肼被氧化。根据方程式计算水合肼的质量及质量分数,利用氧化还原反应的电子守恒配平方程式。据此解答。
(1)
氯气和氢氧化钠反应生成氯化钠和次氯酸钠和水,离子方程式为:,因为温度高了会产生氯酸钠,所以可以将氢氧化钠溶液采用冰水浴的方式降温;反应完后关闭K1,氯气会进入装置B中,故装置B的作用是:储存多余的Cl2;
(2)
次氯酸钠具有强氧化性,水合肼有强还原性,所以将次氯酸钠放入分液漏斗中,缓慢加入,不能太快,若加入较快,反应生成的水合肼会被次氯酸钠氧化,导致产率降低;
(3)
由溶解度曲线可知,碳酸钠的溶解度随着温度变化较大,氯化钠溶解度岁温度变化小,则获得氯化钠粗品的操作是加热至有大量固体析出,趁热过滤,防止降温时碳酸钠析出;
(4)
根据淀粉遇碘变蓝的性质分析,滴定终点的现象为:最后一滴碘溶液加入,溶液变成蓝色,且半分钟不褪色;根据方程式N2H4·H2O+2I2=N2↑+4HI+H2O分析,水合肼的质量分数为:;
(5)
根据题意,肼和氢氧化铜在加热的条件下反应生成氧化亚铜和无污染的气体,该气体应为氮气根据氧化还原反应配平方程式为:。
6.(1) 排除装置内的空气,防止连二亚硫酸钠被氧化 碱性条件下,能稳定存在
(2)Zn+2SO2+2OH-=+Zn(OH)2
(3)AB
(4)a c b
(5) 72.5% 、
【分析】Zn和SO2反应生成ZnS2O4,控制温度在35℃,使ZnS2O4和NaOH反应生成Na2S2O4和Zn(OH)2沉淀,通过过滤除去Zn(OH)2,得到Na2S2O4溶液,再向溶液中加入NaCl增大钠离子的浓度,同时进行降温,使Na2S2O4晶体析出。
【详解】(1)连二亚硫酸钠在空气中易被氧化,在碱性介质中较稳定,故通入SO2可以排除装置内的空气,防止连二业硫酸钠被氧化;溶液显碱性使Na2S2O4能稳定存在;
(2)Zn的水溶液中通入SO2发生反应:和,制取连二亚硫酸钠的总化学方程式对应的离子方程式为:;
(3)A.将锌粉投入水中形成悬浮液主要是为了增大接触面,加快反应速率,故A正确;
B.单向阀的主要作用是防止氧气倒吸进入装置中,将连二亚硫酸钠氧化,故B正确;
C.连二亚硫酸钠易溶于水、难溶于乙醇,洗涤Na2S2O4•2H2O时用酒精洗涤效果比冰水好,故C错误;
D.向Na2S2O4溶液中加NaC1固体,使c(Na+)增大,减小Na2S2O4的溶解量,促进Na2S2O4•2H2O晶体析出,产率增大,加入NaC1溶液,c(Na+)减小,减少Na2S2O4•2H2O晶体析出,产率降低,故D错误;
故答案选AB;
(4)制备Na2S2O4•2H2O晶体,先安装好整套装置,并检查装置的气密性,将一定量的Zn粉与蒸馏水混合搅拌成悬浊液,28~ 35℃加热条件下,向悬浊液中通入SO2至澄清,再向溶液中滴加NaOH至pH在8.2~ 10.5之间,过滤取滤液并加入NaCl固体,冷却至室温,过滤,洗涤,干燥得到晶体;
(5)Na2S2O4与K3[Fe(CN)6]发生反应,Na2S2O4转化为Na2SO4,S元素化合价由+3价升高到+6价,共升高6价,K3[Fe(CN)6]中Fe元素由+3价降低到+2价,降1价,根据得失电子守恒,得Na2S2O4~6K3[Fe(CN)6],n(Na2S2O4)=n(K3[Fe(CN)6])=×0.01L×0.2mol/L,m(Na2S2O4•2H2O)=n×M=×0.01L×0.2mol/L×174=0.058g,Na2S2O4•2H2O晶体的纯度为:=72.5%;Na2S2O4可能被氧化成Na2SO4,结晶过程中可能含有NaCl等杂质。
7. 439.9 0.032mol·L-1·min-1 降低温度 第三 80 负极 3I--2e-=
【详解】(1)由盖斯定律可知,断裂1molH-H键的焓变=ΔH3-ΔH1=+439.9kJ·mol-1,所以断裂1molH-H键需要吸收的能量为439.9kJ;
(2)0~5min内,v(H2)==0.032 mol·L-1·min-1;6min时改变外界条件,平衡向正反应方向移动,根据图像曲线斜率可知,化学反应速率降低,且Δc(HI)=2Δc(H2),该反应正向为放热反应,因此改变的条件为降低温度;
(3)多步反应的反应速率由慢反应决定,故该反应的反应速率由第三步决定;
(4)恒温恒容条件下,气体的物质的量之比等于压强之比,可设起始时n(I2)=n(H2)=208mol,则平衡时混合气体总物质的量为456mol,1mol气体的分压为1kPa,由于反应②是等体积变化的反应,反应①正向是气体体积增大的反应,由反应的差量I2(g)2I(g)Δn=2−1=1可知,生成I(g)的物质的量为气体物质的量变化量的2倍,所以I(g)的物质的量为:(456−416)mol×2=80mol,即平衡时I(g)的物质的量为80mol,分压分压为80kpa,即p(I)=80kPa;KP是指可逆化学反应达到平衡状态时生成物与反应物的分压(方程式系数幂次方)乘积比或反应产物与反应底物的分压(方程式系数幂次方)乘积比,因此Kp2=;
(5)鸡蛋壳内为碘化钾溶液,烧杯中盛装硫酸铜溶液,根据总反应可知,鸡蛋壳内的是I-发生氧化反应生成,电极为负极,其电极反应式为3I--2e-=。
8.(1) Cu/ZnO+H2=Cu/Zn+H2O C
(2)CO2+2e-+2H+=HCOOH
(3) CH3OCH3(或二甲醚) 到,主要发生反应Ⅱ,反应Ⅱ正反应放热,温度升高,的平衡转化率下降;到,主要发生反应Ⅰ,反应Ⅰ正反应吸热,温度升高,的平衡转化率升高 16
【详解】(1)由总反应减去第二步反应即反应I得:Cu/ZnO+H2=Cu/Zn+H2O;反应I为吸热反应,则符合条件的图象为A、C,反应I几乎不影响总反应达到平衡所用的时间,则反应的反应速率快,活化能低,符合条件的为图象C。
(2)P极上二氧化碳得电子生成甲酸,电极反应为:CO2+2e-+2H+=HCOOH。
(3)①随着温度的升高,反应Ⅲ平衡逆向移动,故CH3OCH3(或二甲醚)平衡体积分数减小,对应曲线X;CO2的平衡转化率与反应Ⅰ、Ⅱ有关,且温度升高,两个反应平衡移动方向不一致,在不同温度范围内,两个反应程度不同,故CO2的平衡转化率表现不一致,453K到553K,主要发生反应Ⅱ,反应Ⅱ正反应放热,温度升高CO2的平衡转化率下降,553K到573K,主要发生反应Ⅰ,反应Ⅰ正反应吸热,温度升高CO2的平衡转化率升高;故答案为:CH3OCH3(或二甲醚);到,主要发生反应Ⅱ,反应Ⅱ正反应放热,温度升高,的平衡转化率下降;到,主要发生反应Ⅰ,反应Ⅰ正反应吸热,温度升高,的平衡转化率升高;
②由题意知,转化的CO2物质的量n(CO2)=1mol×30%=0.3mol,平衡时CO物质的量为0.05mol,说明通过反应Ⅰ转化的CO2为0.05mol,则通过反应Ⅱ转化的CO2为0.25mol,故反应Ⅱ生成CH3OH为0.25mol,又平衡时CH3OH为0.05mol,说明有0.2molCH3OH通过反应Ⅲ转化为CH3OCH3,列式如下:
,综上所述,平衡时n(CH3OH)=0.05mol,n(CH3OCH3)=0.1mol,n(H2O)=(0.05+0.25+0.1)mol=0.4mol,前10minCH3OCH3的反应速率=;反应ⅢKc==16;故答案为:;16。
9.(1)11
(2)-128.8
(3)低温
(4) bc 64/729或0.088 不移动
(5) 31.6g
【详解】(1)H2CO3的Ka2= =5.0×10-11,c()= 5c(),则c(H+)=1×10-11mol/L,则该溶液的pH=-lg c(H+)=11。
(2)已知H2(g)、C2H4(g)的燃烧热分别是-285.8 kJ/mol和-1410.0 kJ/mol,则有:①H2(g)+O2(g)=H2O(l) △H=-285.8 kJ/mol;②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g) △H =-1410.0 kJ/mol;③H2O(g)= H2O(l) △H=-44.0 kJ/mol, 根据盖斯定律①×6-②-③×4可得:2CO2(g)+6H2(g)=CH2=CH2(g)+4H2O(g) △H=(-285.8 kJ/mol)×6-(-1410.0 kJ/mol)-(-44.0kJ/mol)×4=- 128.8 kJ/mol。
(3)2CO2(g)+6H2(g)=CH2=CH2(g)+4H2O(g) △H=-128.8 kJ/mol,反应的△H<0,△S<0,根据△G=△H-T△S,需要△G<0,即低温下反应才能自发进行。
(4)①a.使用催化剂,平衡不移动,温度不变,平衡时CO2的平衡转化率不变,故a错误;
b.升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故b正确;
c.其他条件不变,若投料改为4mol H2和1 mol CO2时,相当于增大H2的体积分数,平衡正向移动,CO2的平衡转化率增大,可能位于点M2,故c正确;
d.该反应属于气体的物质的量发生变化的反应,当压强不变时表示已经达到平衡状态,反应中始终不变,不能证明化学反应已达到平衡状态,故d错误;
故选bc;
②在体积为1 L的恒容容器中,投料为3mol H2和1 mol CO2时,在M点平衡时二氧化碳的转化率为50%,列出“三段式”
该反应平衡常数的数值K=或0.088;
③若达到平衡后再向体系内通入1.5 mol CO2和1 mol H2O,Qc==K,则平衡不移动。
(5)正极CO2得电子发生还原反应,故电极方程式为3CO2+4Na++4e-=2Na2CO3+C,负极Na失去电子生成Na+,电极方程式为Na-e-=Na+,当转移0.4mol e- 时,正极生成0.2mol Na2CO3和0.1molC,负极消耗0.4molNa,则两电极的质量差为0.2mol×106g/mol+0.1mol×12g/mol+0.4mol×23g/mol=31.6g。
10. 9 O>P>Li POCl3或CCl4或SiF4 4 B、C 电负性N>P,成键电子对离中心原子越近,成键电子对间的排斥力越大,键角越大 8
【详解】(1)Co是27号元素,价电子为3d74s2,的价电子为3d6,的价电子排布图为:;一个轨道就是一种空间运动状态不同的电子,P是15号元素,因此基态磷原子有9种空间运动状态不同的电子;故答案为:;9。
(2)同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,因此Li、O、P三种元素的电负性由大到小的顺序是:O>P>Li;故答案为:O>P>Li。
(3)根据Cl=O-,与互为等电子体的分子的化学式为POCl3或CCl4或SiF4等,该分子的中心原子的价层电子对数等于;故答案为:POCl3或CCl4或SiF4;4。
(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中硫酸铜电离出铜离子和硫酸根离子,铜离子和水形成水合铜离子,因此水和水之间存在氢键和范德华力,水中、硫酸根中存在共价键,水合铜离子存在配位键,因此不存在的微粒间作用力有金属键和离子键;综上所述,答案为B、C。
(5)N和P是同主族元素,但是分子中的键角大于分子中的键角,原因是:电负性N>P,成键电子对离中心原子越近,成键电子对间的排斥力越大,键角越大;故答案为:电负性N>P,成键电子对离中心原子越近,成键电子对间的排斥力越大,键角越大。
(6)根据图中信息,以右侧面面心的分析,得到配位数为8,晶胞中有,Li+有8个,即有4个,若晶胞参数为bnm,则的密度为;故答案为:。
11.(1)
(2)
(3) 面心立方最密堆积 12 AD
(4)
(5)2.3
【详解】(1)亚铜离子是由铜原子失去了一个电子得到的,所以有28个电子,所以为3d10;
(2)同一个周期从左往右第一电离能呈增大趋势,故硒、砷和溴元素的第一电离能从大到小顺序为Br>As>Se;
(3)晶体的堆积方式是面心立方最密堆积;其配位数为12;往的硫酸盐溶液中加入过量氨水,可生成,A.该化合物是离子化合物,在中所含的化学键有离子键、极性键和配位键,选项A正确;
B.在中给出孤电子对,提供空轨道,选项B错误;
C.组成元素中第一电离能最大的是氮元素,选项C错误;
D.与互为等电子体,空间构型均为正四面体形,选项D正确;
答案选AD;
(4)①在硼酸[]分子中,B原子与3个羟基相连,则分子中B原子杂化轨道数目为3,分子中B原子杂化轨道的类型是,其晶体具有与石墨相似的层状结构,其同层分子间的主要作用力是氢键,故答案为:sp2;
②硼酸()能电离,它在水中能结合水电离出的OH-,形成离子,则硼酸还电离出氢离子,则其电离方程式为:;
(5)石墨的层间距为,可以认为一层石墨的厚度是,对某一层石墨中的一个六元环,正六边形环的边长是,面积S=6+142142sin=52387.6pm2,环的厚度h=,那么一个环占有的体积V=Sh=52387.6335=1.75410-7pm3=1.75410-23cm3,六元环中每个C原子都被3个环共用,一个环实际有2个C原子,一个环的质量m==2=3.99g。所以,石墨的密度===2.3。
12.(1) [Ar]3d74s2 d
(2)B
(3) sp2、sp3 小于 氧原子上有2个孤电子对,且与C原子形成C-O键,对C-C键和C-Cl键有较大的排斥力 正四面体形
(4)单晶硅<金刚砂(SiC)<金刚石
(5) (,,)
【详解】(1)钴的原子序数是27,基态Co原子的电子排布式为[Ar]3d74s2,Co元素位于第Ⅷ族,原子核外最后填充的是d电子,故Co为d区元素。故答案为:[Ar]3d74s2;d;
(2)A、C、D分别电离出—个电子所需的能量为基态Al原子的第—、三、二电离能,基态铝原子的第三电离能>第二电离能>第—电离能;原子处于激发态时能量比基态时高,易失去电子,B处于激发态,电离出—个电子需要的能量最低,综合分析需要能量最小的为B。故答案为:B;
(3)①乙酰氯分子甲基中的碳原子采用杂化、羰基中的碳原子采用杂化。②由于乙酰氯分子中含有碳氧双键,C—O键上的氧原子有2个孤电子对,对C—C键和C—Cl键有较大的排斥力,因此该夹角小于120°。③微粒中Al原子形成4个键,且不含孤电子对,故空间构型为正四面体形。故答案为:sp2、sp3;小于;氧原子上有2个孤电子对,且与C原子形成C-O键,对C-C键和C-Cl键有较大的排斥力;正四面体形;
(4)金刚石、金刚砂(SiC)、单晶硅均为原子晶体,结构相似,共价键键长越短,键能越大,原子晶体的熔点越高,原子半径:C
13. 取代(水解)反应 浓硫酸,加热 +HOCH2CH2OH+H2O 2
【分析】采用逆向合成法,根据M的结构简式可知C为:,B与乙二醇反应生成C,则B的结构简式为:,A通过①银镜反应、②与H+反应生成B,则A的结构简式为:;A与氢气发生加成反应生成D,A中碳碳双键、碳氧双键都能够与氢气发生加成反应,根据D一定条件下能够生成E可知,D为;又F能够生成天然橡胶,则F的结构简式为:,根据加聚反应原理可以写出E与F反应合成N为:。
【详解】(1)根据前面分析和综合M及E的结构简式得到A的结构简式是;故答案为:。
(2)根据G→H的结构简式得到G→H反应类型为取代(水解)反应,D为CH2=C(CH3)CH2OH,因此D→E是发生消去反应,因此该反应的条件为浓硫酸加热;故答案为:取代(水解)反应;浓硫酸加热。
(3)根据前面分析得到B→C化学反应方程式:+HOCH2CH2OH+H2O;故答案为:+HOCH2CH2OH+H2O。
(4)E的结构简式为CH2=C(CH3)2,F的结构简式为,因此E+F→N化学反应方程式:;故答案为:。
(5)H在一定条件下能被氧化为不饱和酸 ,该不饱和酸有多种同分异构体,属于酸类且含有碳碳双键的同分异构体碳架结构为CH2=CHCH2COOH、CH3CH=CHCOOH,共有2种;故答案为:2。
(6)根据信息①,在浓硫酸加热作用下发生消去反应生成,根据信息③和SOCl2反应生成,根据信息②在AlCl3作用下反应生成,在Ni催化剂作用下反应生成,因此合成路线为 ;故答案为:。
14.(1) H2
(2)
(3) 取代反应 羟基和羰基
(4) 6 或
(5)abcd
(6)
【分析】A的分子式为C6H6O,则A的结构简式为;反应①中,A和试剂a反应生成B(C6H12O),则B为,试剂a为H2;反应②中,B转化为C(C6H10O),则C为;反应③中,C和CH3CO3H反应生成D(C6H10O2,七元环脂),D经过反应④可到,结合“已知i”可得D为;反应⑤中,A和(CH3CO)2O反应生成J();反应⑥中,J转化为E(C8H8O2,J的同分异构体),E再和反应生成I(),结合“已知ii”可得知E为;反应⑨中,J和G(C3H6O3)反应生成F();反应⑩中,F和试剂b反应得到,结合“已知i”可得试剂b为。
(1)A的分子式为C6H6O,则A的结构简式为;反应①中,A和试剂a反应生成B(C6H12O),则B为,试剂a为H2。
(2)由分析可知,C为,则反应②的化学方程式为。
(3)反应⑤中,A()和(CH3CO)2O反应生成J(),该反应类型为取代反应;由分析可知,E为,其官能团为羟基和羰基。
(4)M的相对分子质量比J大14,则分子式为C9H10O2;满足题干中三个条件的结构有、、、、和,共计6种,核磁共振氢谱峰面积比为 1: 2: 2: 2: 3同分异构体的结构简式为或。
(5)a.反应③中,C(C6H10O)和CH3CO3H反应生成D(C6H10O2),该反应属于氧化反应,a正确;b.A是,遇到FeCl3溶液呈紫色,J遇到FeCl3溶液不反应,故可用FeCl3溶液检验反应⑤中A是否反应完全,b正确;c.反应⑥的反应物J与生成物E的分子式都是C8H8O2,二者互为同分异构体,c正确;d.反应④中,D()转化为聚酯,结合“已知i”可知,该反应为缩合聚合反应,d正确;故选abcd。
(6)CH3CH2OH可以被氧化为CH3CHO;CH3CHO可以反应生成CH3CH=CHCHO;CH3CH=CHCHO可以被新制氢氧化铜悬浊液氧化为CH3CH=CHCOOH;综上所述,以乙醇为原料合成2-丁烯酸的合成路线为。
15.(1) 氟苯 硝基
(2)还原反应
(3) ++HBr
(4)
(5)14
(6)
【分析】根据A的分子式及D的结构简式知,A为 ,A发生取代反应生成B,B为 ,根据C的分子式知,B中硝基发生还原反应生成C中氨基,则C为 ,C发生取代反应生成D,D中氢原子被取代生成E,E中酰胺基水解生成F,F发生取代反应生成G,G为 ,G和X发生取代反应生成H,根据H的结构简式及X的分子式知,X为 ,H发生取代反应生成I,I为 ,I发生取代反应生成W;(7)由甲苯和制备, 和发生取代反应生成 , 发生取代反应生成 ,甲苯和浓硝酸发生取代反应生成 , 发生还原反应生成 。
【详解】(1)A为 ,A的化学名称是氟苯,B 为 ,B中具有的含氧官能团的名称是硝基;
故答案为:氟苯;硝基;
(2)由分析可知,由B生成C的反应类型是还原反应;
(3)G为 ,G和X发生取代反应生成H,由G生成H的化学方程式为 :+ +HBr;
(4)由分析可知,I的结构简式为 ;
(5)由分析可知,X为 ,Y为X的同系物,分子式为C8H9Br,则Y中苯环的支链可以是1个—Br、2个—CH3,这样的结构有6种,也可能是1个—Br、1个—CH2CH3,这样的结构有3种,也可能是1个—CH3、1个—CH2Br,这样的结构有3种,也可能是只有1个—CH2CH2Br,也可能是1个—CH Br CH3,一共14种;
(6)由甲苯和制备 , 和 发生取代反应生成 , 发生取代反应生成 ,甲苯和浓硝酸发生取代反应生成 , 发生还原反应生成 ,合成路线为。
相关试卷
这是一份上海崇明区2021届-2023届高考化学三年模拟(二模)按题型分类汇编-02非选择题,共33页。试卷主要包含了实验题,原理综合题,元素或物质推断题,有机推断题,填空题,工业流程题,结构与性质等内容,欢迎下载使用。
这是一份安徽黄山2021届-2023届高考化学三年模拟(二模)按题型分类汇编-02非选择题,共35页。试卷主要包含了工业流程题,实验题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。
这是一份内蒙古呼和浩特2021届-2023届高考化学三年模拟(一模)按题型分类汇编-02非选择题,共37页。试卷主要包含了原理综合题,填空题,实验题,工业流程题,结构与性质,有机推断题等内容,欢迎下载使用。












