


人教版 (2019)必修 第一册第一节 原子结构与元素周期表第2课时学案
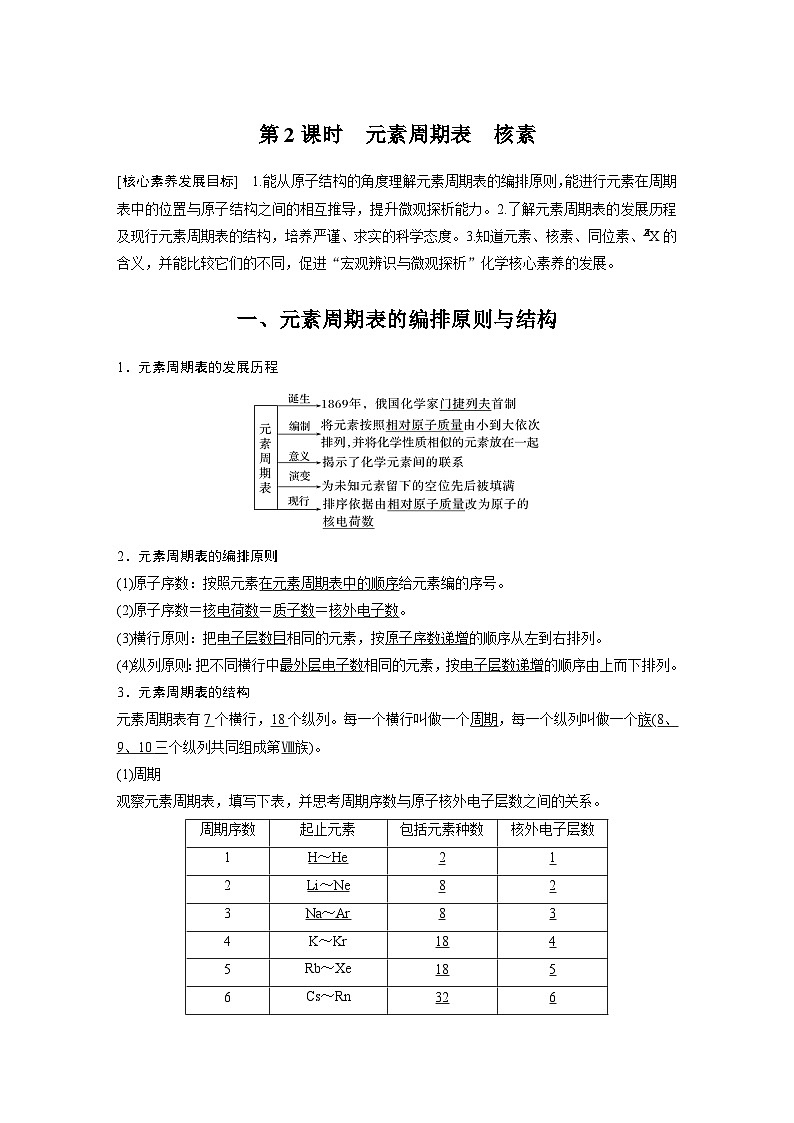
展开第2课时 元素周期表 核素
[核心素养发展目标] 1.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的相互推导,提升微观探析能力。2.了解元素周期表的发展历程及现行元素周期表的结构,培养严谨、求实的科学态度。3.知道元素、核素、同位素、X的含义,并能比较它们的不同,促进“宏观辨识与微观探析”化学核心素养的发展。
一、元素周期表的编排原则与结构
1.元素周期表的发展历程
2.元素周期表的编排原则
(1)原子序数:按照元素 给元素编的序号。
(2)原子序数= = = 。
(3)横行原则:把 相同的元素,按 的顺序从左到右排列。
(4)纵列原则:把不同横行中 相同的元素,按 的顺序由上而下排列。
3.元素周期表的结构
元素周期表有 个横行, 个纵列。每一个横行叫做一个 ,每一个纵列叫做一个 ( 三个纵列共同组成第 族)。
(1)周期
观察元素周期表,填写下表,并思考周期序数与原子核外电子层数之间的关系。
周期序数 | 起止元素 | 包括元素种数 | 核外电子层数 |
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 | K~Kr |
|
|
5 | Rb~Xe |
|
|
6 | Cs~Rn |
|
|
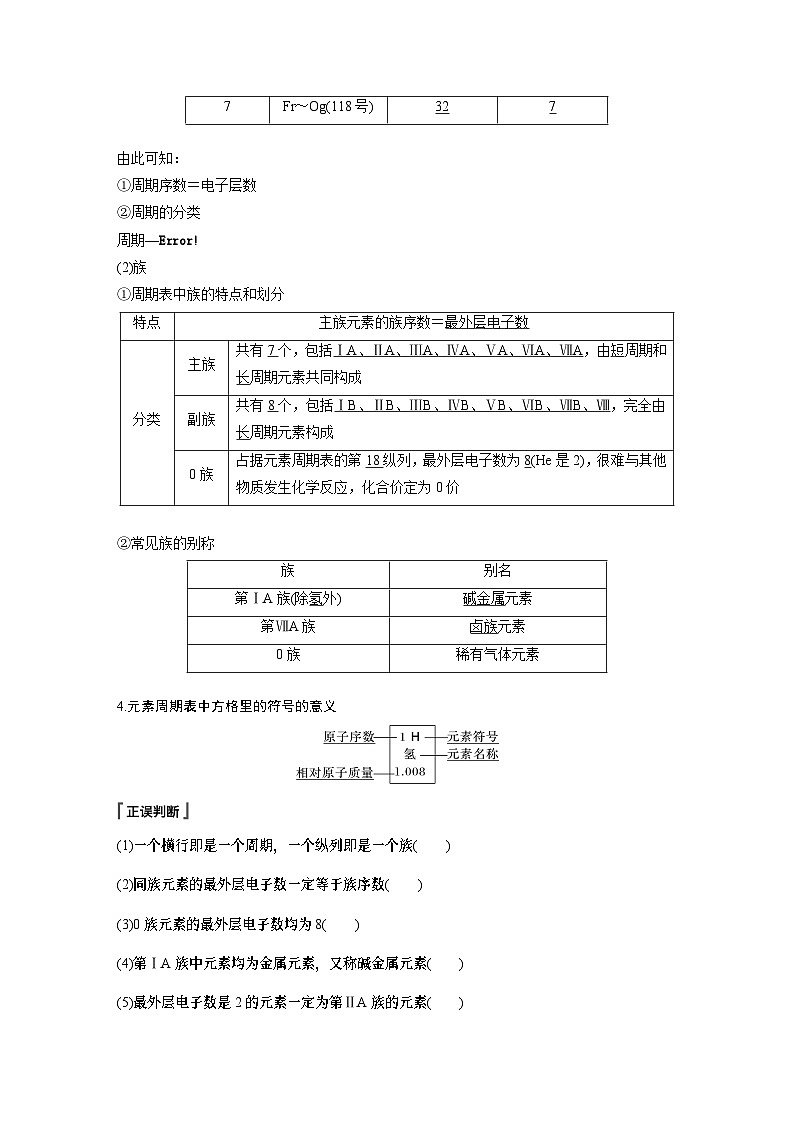
7 | Fr~Og(118号) |
|
|
由此可知:
①周期序数=电子层数
②周期的分类
周期—
(2)族
①周期表中族的特点和划分
特点 | 主族元素的族序数= | |
分类 | 主族 | 共有 个,包括 ,由 周期和 周期元素共同构成 |
副族 | 共有 个,包括 ,完全由 周期元素构成 | |
0族 | 占据元素周期表的第 纵列,最外层电子数为 (He是2),很难与其他物质发生化学反应,化合价定为0价 | |
②常见族的别称
族 | 别名 |
第ⅠA族(除 外) | 元素 |
第ⅦA族 | 元素 |
0族 | 稀有气体元素 |
4.元素周期表中方格里的符号的意义
(1)一个横行即是一个周期,一个纵列即是一个族( )
(2)同族元素的最外层电子数一定等于族序数( )
(3)0族元素的最外层电子数均为8( )
(4)第ⅠA族中元素均为金属元素,又称碱金属元素( )
(5)最外层电子数是2的元素一定为第ⅡA族的元素( )
(1)在现行周期表中第四、五、六、七周期均有18列,为什么第四、五周期各有18种元素,而第六、七周期各有32种元素?
(2)含有元素种类最多的族是哪一族?
(3)同周期的第ⅡA、ⅢA族元素间原子序数差值可能为多少?并说明原因。
元素周期表的结构
原子序数的定量关系
①同周期,第ⅡA族与第ⅢA族原子序数差可能为1、11、25;
②同族,相邻周期原子序数差:第ⅠA族~第ⅡA族:上一周期元素种类数;第ⅢA族~0族:下一周期元素种类数。如Na与K相差8,Cl与Br相差18。
③利用稀有气体元素的原子序数推断元素在周期表中的位置。
1.我国的纳米技术基础研究能力已跻身于世界前列,例如曾作为我国两年前十大科技成果之一的就是一种合成纳米材料,化学式为RN。已知该化合物中的Rn+核外有28个电子。则R元素位于元素周期表的( )
A.第三周期第ⅤA族
B.第四周期第ⅢA族
C.第五周期第ⅢA族
D.第四周期第ⅤA族
2.下列选项各截取了元素周期表的一部分,数字为原子序数,其中M的原子序数为37的是( )
二、核素 同位素
1.元素
(1)概念:具有相同 ( )的一类 的总称。
(2)决定元素种类的是 。
2.核素
(1)概念:具有一定数目 和一定数目 的一种原子。表示方法:X。
(2)实例
原子符号(X) | 原子名称 | 氢元素的原子核 | |
质子数(Z) | 中子数(N) | ||
H | 氕 |
|
|
H或D | 氘 |
|
|
H或T | 氚 |
|
|
3.同位素
(1)概念: 相同而 不同的同一 的不同原子互称为同位素(即同一 的不同 互称为同位素)。“同位”是指核素的 相同,在元素周期表中占有 的位置。
例如:氢元素有H、H、H三种核素;碳元素有C、C、C等核素;氧元素有O、O和O三种核素;铀元素有U、U、U等核素。
(2)同位素的特征
①同一种元素的各种同位素的化学性质几乎相同;物理性质略有差异。
②在天然存在的某种元素里,不论是游离态还是化合态,同位素相互之间保持一定的 。
(3)常见同位素的用途
①考古测定文物的年代的是C;
②制造氢弹的是 ;
③利用放射性同位素释放的射线 、金属 、诊断和治疗疾病等。
(1)任何原子都由质子、中子、电子构成( )
(2)23Na和23Mg互为同位素( )
(3)同位素原子的化学性质几乎相同,物理性质略有差异( )
(4)原子的种类大于元素的种类( )
(5)H和H+为同一元素的不同微粒( )
1.有①O、O、O ②H2O、D2O ③O2和O3 ④H、D、T四组微粒或物质,回答下列问题:
(1)互为同位素的是____________(填序号,下同)。
(2)互为同素异形体的是____________。
(3)由①和④中微粒能结合成含三个原子的化合物分子,这些化合物中相对分子质量最大的是__________(填化学式)。
答案 (1)①④ (2)③ (3)T2O
2.氯元素有两种稳定的核素,分别是Cl和Cl,它们的相对原子质量分别是34.969、36.966,在自然界中的丰度分别是75.77%、24.23%。
计算:
(1)氯元素的相对原子质量。
(2)氯元素的近似相对原子质量。
(1)元素、核素、同位素与同素异形体的比较
| 元素 | 核素 | 同位素 | 同素异形体 |
概念 | 质子数相同的同一类原子 | 质子数、中子数都一定的原子 | 质子数相同、中子数不同的不同核素 | 同种元素形成的不同单质 |
举例 | H、C、N三种元素 | H、H、H三种核素 | H、H、H互为同位素 | O2与O3互为同素异形体 |
(2)元素、核素、同位素、同素异形体的联系
1.下列关于元素周期表的叙述正确的是( )
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
B.元素所在周期数等于它的电子层数,所在的族序数等于它的最外层电子数
C.元素周期表有7个横行即7个周期,18个纵列即18个族
D.某种元素的相对原子质量取整数值,就是其原子序数
2.意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,下列说法正确的是( )
A.O4和O2互为同位素
B.O4转化为O2是物理变化
C.18O是氧元素的一种核素,它的中子数是8
D.同温同压下,等体积的O4和O2含有相同的分子数
3.金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关
Ti和Ti的说法正确的是( )
A.Ti和Ti原子中均含有22个中子
B.Ti和Ti具有相同的质子数
C.Ti和Ti的物理性质相同
D.Ti和Ti为同一种核素
4.A、B、C为短周期元素,在周期表中所处的位置如表所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
A |
| C |
| B |
|
(1)写出A、B、C三种元素的名称________________、______________、______________。
(2)B位于元素周期表中第______周期第______族。
(3)C的原子结构示意图为________。
题组一 元素周期表的结构
1.元素周期表揭示了化学元素间的内在联系,下列有关元素周期表的说法不正确的是( )
A.俄国化学家门捷列夫编制了第一张元素周期表
B.周期表中最外层电子数相同的元素都排列在同一列中
C.周期表中一共有18列,但只有16个族
D.随着人们的认识发展,周期表也在不断地发展变化着
2.下列不属于主族元素的是( )
A.S B.K C.Cu D.Br
题组二 同周期、同主族元素的序差规律
3.已知A为第ⅡA族元素,B为第ⅢA族元素,它们的原子序数分别为m和n,且A、B为同一周期的元素,下列关系式错误的是( )
A.n=m+1 B.n=m+11
C.n=m+25 D.n=m+10
4.如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为( )
A.5x+10 B.5x+11
C.5x+14 D.5x+16
题组三 元素、核素、同位素和同素异形体
5.下列各组互为同位素的是( )
A.O2和O3 B.CO和CO2
C.H2O和H2O2 D.Mg和Mg
6.(2022·广东佛山高一期末)科学家以钙离子撞击锎(Cf)靶,产生了一种超重元素——(Og),其反应可表示为:Cf+Ca―→Og+3n。下列说法正确的是( )
A.Cf的电子数为151
B.Og的中子数为294
C.Ca和Ca互为同素异形体
D. Cf和Cf互为同位素
7.同位素示踪技术已广泛应用在农业、工业、医学、地质及考古等领域。下列有关叙述正确的是( )
A.14C与12C是两种不同的元素或核素
B.通过化学变化可以实现16O与18O之间的相互转化
C.35Cl2与37Cl2互为同素异形体
D.铯元素的两种核素137Cs比133Cs多4个中子
8.美国夏威夷联合天文中心的科学家发现了新型的氢粒子,这种粒子是由3个氢原子核(没有中子)和2个电子构成的。下列关于这种粒子的说法正确的是( )
A.是氢的一种新单质
B.是氢的一种新的同位素
C.它的组成可用H3表示
D.它比普通H2分子多一个氢原子核
9.下列叙述正确的是( )
A.第ⅡA族某元素的原子序数为a,则原子序数为a+1的元素一定位于第ⅢA族
B.除短周期外,其他周期均有32种元素
C.原子最外层只有2个电子的元素可能不是金属元素
D.Ca是碱金属元素
10.元素周期表是学习化学的重要工具,如图是元素周期表中的一格,从该图中,我们获取的相关信息错误的是( )
A.该元素的名称是钠
B.该元素的原子序数为11
C.该元素在地壳中的含量为22.99%
D.该元素的元素符号为Na
11.某原子X的核内中子数为N,质量数为A,它与原子2H构成2HmX分子。a g 2HmX所含质子的物质的量是( )
A. mol B. mol
C. mol D. mol
12.回答下列问题:
(1)有下列微粒 H、H、H、14C、14N、16O、35Cl2、37Cl2。
①以上8种微粒中共有____种核素,共____种元素。
②互为同位素的是________________。
③质量数相等的是________和________,中子数相等的是________和________。
④H、H、H三种核素构成的氢气的相对分子质量有________种。
(2)质量相同的H2O和D2O与足量钠反应,放出的气体在标准状况下的体积之比为________。
13.结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。
(2)表中所列元素,属于短周期元素的有________(填字母,下同),属于主族元素的有________;g元素位于第________周期________族;i元素位于第________周期第________族。
(3)元素f是第________周期第________族元素,请在方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。
化学必修 第一册第二节 氯及其化合物第1课时学案设计: 这是一份化学必修 第一册第二节 氯及其化合物第1课时学案设计,文件包含第2章第2节第1课时氯气的性质学案教师版2022-2023学年高一化学人教版2019必修第一册docx、第2章第2节第1课时氯气的性质学案学生版2022-2023学年高一化学人教版2019必修第一册docx等2份学案配套教学资源,其中学案共23页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律第2课时学案设计: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律第2课时学案设计,文件包含第4章第2节第2课时元素周期表和元素周期律的应用学案教师版2022-2023学年高一化学人教版2019必修第一册docx、第4章第2节第2课时元素周期表和元素周期律的应用学案学生版2022-2023学年高一化学人教版2019必修第一册docx等2份学案配套教学资源,其中学案共21页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时导学案: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时导学案,文件包含第1章第2节第2课时离子反应学案教师版2022-2023学年高一化学人教版2019必修第一册docx、第1章第2节第2课时离子反应学案学生版2022-2023学年高一化学人教版2019必修第一册docx等2份学案配套教学资源,其中学案共20页, 欢迎下载使用。













