




初中第2节 物质的酸碱性获奖ppt课件
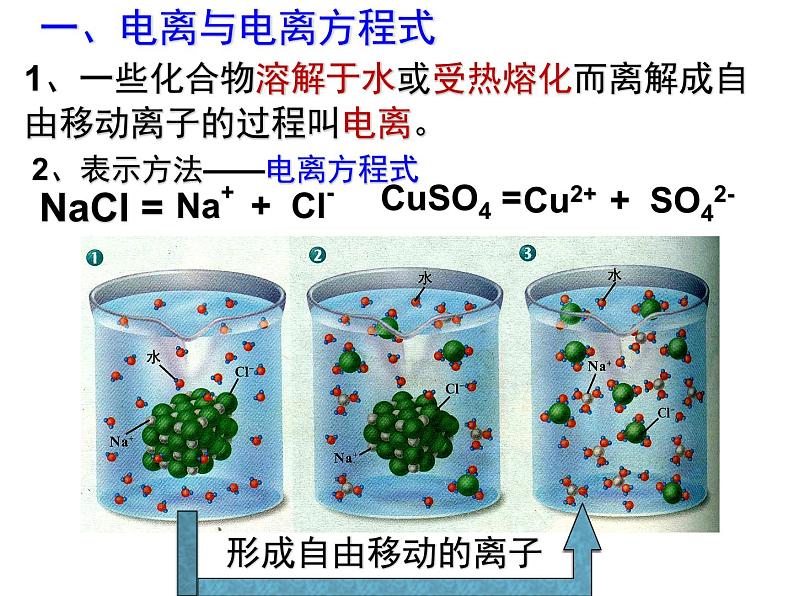
展开1、一些化合物溶解于水或受热熔化而离解成自由移动离子的过程叫电离。
2、表示方法——电离方程式
Na+ + Cl-
Cu2+ + SO42-
①在溶液里,所有的阳离子带的正电荷总数和所有阴离子带的负电荷总数相等,整个溶液不显电性。②书写时要注意配平,使方程式两边各元素的原子个数相等。③阴、阳离子所带的电荷数一般可以根据它们在化合物中的化合价来判断。
写电离方程式的注意事项:
你能将下列化学式拆分成哪些离子,并正确写出它的电离方程式。
Ca(OH) 2 、H2SO4、Na2CO3、KMnO4
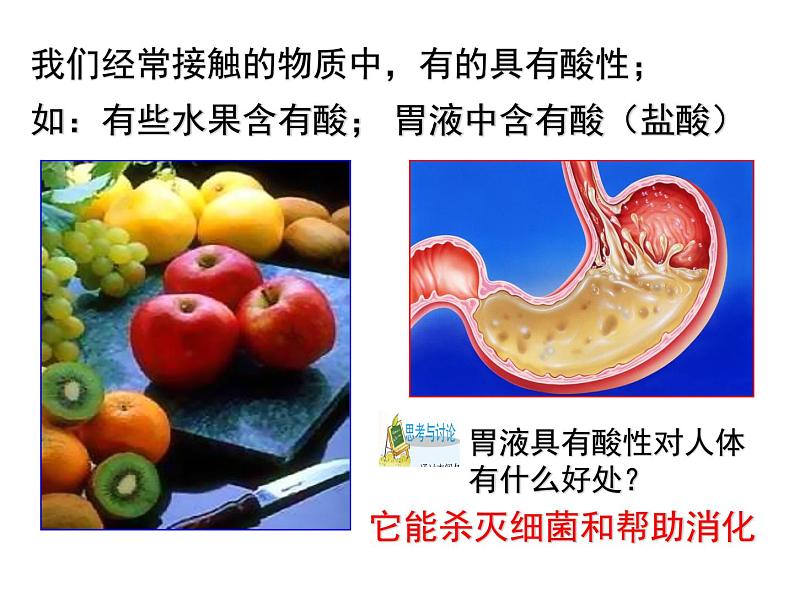
我们经常接触的物质中,有的具有酸性;
胃液具有酸性对人体有什么好处?
它能杀灭细菌和帮助消化
你还能说出生活中一些具有酸性的物质吗?
二、酸性物质和碱性物质
将少量食醋倒入烧杯中,如图1-8所示,用手扇动气流,闻一闻,它的气味是_________ 的。
食醋是一种酸性物质,有酸味,具有酸性
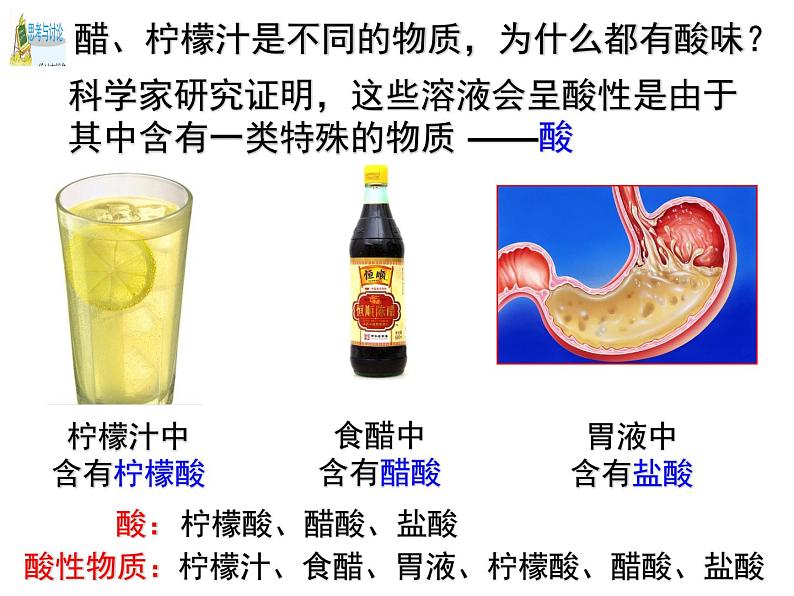
醋、柠檬汁是不同的物质,为什么都有酸味?
科学家研究证明,这些溶液会呈酸性是由于其中含有一类特殊的物质
柠檬汁、食醋、胃液、柠檬酸、醋酸、盐酸
实验室常见的盐酸、硫酸和硝酸等都是酸。
电离时生成的阳离子全部都是氢离子的化合物
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
NaHSO4属于酸吗?
NaHSO4 = Na+ + H+ + SO42-
③ 酸显酸性,一定是酸性物质
④ 酸性物质不一定是酸
① 酸电离时,阳离子全部是H+
② 酸性物质是电离含H+的物质
Na、H+、SO42-
食醋中含有醋酸,食醋是酸性物质,醋酸属于酸性物质也是酸。
酸溶液和酸性溶液相同吗?
③ 酸溶液显酸性,一定是酸性溶液。
④ 显酸性的溶液不一定属于酸溶液。
① 酸溶液是酸的水溶液。阳离子全部是H+
② 酸性溶液是含H+的溶液。
例:NaHSO4溶液,
Na+、H+、SO42-
A. 按酸性强弱分:强酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)弱酸:醋酸(CH3COOH)、碳酸(H2CO3)
B. 按是否含氧元素分:含氧酸: H2SO4 HNO3 H3PO4 H2CO3 CH3COOH无氧酸: HCl 氢氯酸 H2S(氢硫酸) HF(氢氟酸)
C. 按一个酸分子电离时产生的H+个数分:
一元酸:HCl、 HNO3、 HF、 CH3COOH二元酸:H2SO4、 H2CO3、 H2S多元酸: H3PO4
4. 常见的酸及分类:
你去尝一个未成熟的柿子,会有什么感觉?
这是因为柿子里含有 物质
食用碱性食品时会感到涩味,洗澡时不小心有肥皂泡溅到嘴里也有这种感觉。
你还能说出生活中一些具有碱性的物质吗?
NaOH = Na+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
NH3. H2O = NH4+ + OH-
电离时生成的阴离子全部都是氢氧根离子的化合物
Cu2(OH)2CO3是属于碱吗?
Cu2(OH)2CO3 = 2Cu2+ + 2OH- + CO32-
纯碱(碳酸钠Na2CO3)的水溶液能使无色酚酞变红色,纯碱是碱溶液吗?
纯碱是碱性溶液,但不是碱溶液。
NaOH、KOH、Ca(OH)2、Ba(OH)2、NH3·H2O等
Cu(OH)2、Fe(OH)3、Mg(OH)2、Al(OH)3等
NaOH、KOH、Ca(OH)2、Ba(OH)2等
Cu(OH)2、Fe(OH)3、Mg(OH)2、Al(OH)3、NH3·H2O等
凡酸与碱反应,生成的物质(除水外)都可叫做盐,它是数量庞大的一类物质。
盐:电离生成金属阳离子(或铵根离子)和酸根阴离子的化合物。
常见的盐:NH4NO3 K2SO4 KHSO4 NaNO3 NaCl CaCl2 BaCl2 BaSO4
用什么方法测定物质的酸碱性?
有一类物质,在酸性和碱性溶液里能呈现不同的颜色,因此能成为我们判断酸碱性的依据。
如:紫色石蕊试液,无色酚酞试液。
取4支试管,分别加入稀硫酸、稀盐酸、氢氧化钠溶液、氢氧化钙溶液。然后在4支试管内分别滴入几滴紫色石蕊试液,观察并记录石蕊试液在4种溶液中呈现的颜色。
在稀硫酸中:________________。在稀盐酸中: ________________ 。在氢氧化钠溶液中:______________。在氢氧化钙溶液中: ______________ 。
实验表明:酸能使紫色石蕊试液变____色, 碱能使紫色石蕊试液变____色。
紫色石蕊试液发生颜色变化,而不是酸或碱。
石蕊遇酸变红,遇碱变蓝;酚酞遇酸不变色,遇碱变红。
在酸性或碱性溶液里能显示出不同颜色的物质,叫做酸碱指示剂,通常简称指示剂。
变色的是指示剂,而不是酸或碱
3. 指示剂遇酸碱溶液时,颜色的变化
用无色酚酞测定某一溶液,若出现无色,则这溶液一定是中性溶液,说法对吗?
许多植物的花、果、茎、叶中都含有某些显色的物质,它们在酸性溶液或碱性溶液里会显示不同的颜色。如果你有兴趣,可以取这些植物的花、果、茎、叶切碎捣烂,用酒精浸制,所得的浸出液可以作为酸碱指示剂。
不同的酸性物质,酸性有强有弱
不同的碱性物质,碱性有强有弱
五、溶液酸碱性的强弱程度
1. 测定溶液酸碱性强弱的意义
土壤的酸碱性的强弱对农作物生长有很大的影响。所以,测定土壤的酸碱性非常必要。
土地的盐碱化使土壤碱性增强。
碱性土壤会腐蚀农作物并板结成块,草木难生。
一般的雨水具有微弱的酸性,但有些地方由于工业废气的过量排放,雨水酸性过强,形成酸雨。
2. 物质酸碱性强弱的测定
pH是反映物质酸碱性强弱的指标。
范围通常在 0 ~14 之间。
pH越低,酸性越强;pH越高,碱性越强。
pH小于7 的呈酸性;pH大于7 的呈碱性。
pH试纸能显示酸性的强弱(定量测定酸碱度),而酸碱指示剂则只能指示溶液是否显酸性(定性测定酸碱性)。
酸 性
pH数值越小,酸性越强;pH数值越大,碱性越强; pH数值等于7的物质呈中性。
测定物质酸碱性强弱最常用、最简单的方法是使用pH试纸。
原理:pH试纸在酸碱性强弱不同的溶液里会显示出不同的颜色。
1. 用洁净干燥的玻璃棒蘸取被测试的溶液;
2. 滴在pH试纸上;
3. 将试纸显示的颜色迅速与标准比色卡对照;
4. 看与哪种颜色最接近,从而确定溶液的pH。
pH试纸使用注意事项:1. 不能直接把pH试纸浸入待测的溶液中,以免引入杂质;2. 测定溶液pH值时,不能先用蒸馏水将pH试纸润湿,再向pH试纸上滴待测液,因为用蒸馏水湿润后的试纸测得的是稀释后溶液的pH;3. 不能使用未擦干的玻璃棒蘸取待测溶液;4. 检验气体的酸碱性时,可将试纸润湿后再用;5. 广泛pH试纸测得的pH为整数,不能有小数。
用pH试纸测试溶液酸碱性需要注意哪些问题?
1、试纸不可直接伸入溶液中。
2、不能先用蒸馏水将pH试纸润湿。
(因为润湿试纸相当于稀释被检测的溶液, 这会导致检测不准确)
用pH试纸测试溶液与红蓝石蕊试纸测试溶液有什么不同?
pH试纸能显示酸碱性的强弱(定量测定酸碱度),而红蓝石蕊试纸则只能指示溶液是否显酸性或碱性(定性测定酸碱性)。
用pH试纸测试的方法比较粗略。
精确的测试可使用一种称为酸度计的仪器。
用pH试纸测试溶液酸碱性的方法有什么缺点?
科学浙教版第2节 物质的酸碱性教案配套课件ppt: 这是一份科学浙教版第2节 物质的酸碱性教案配套课件ppt,共13页。PPT课件主要包含了不变色,酸碱指示剂,判断物质的酸碱性,pH试纸,最简单的方法,标准比色卡,PH试纸,使用方法,玻璃棒,pH值等内容,欢迎下载使用。
初中科学浙教版九年级上册第2节 物质的酸碱性精品课件ppt: 这是一份初中科学浙教版九年级上册第2节 物质的酸碱性精品课件ppt,共23页。PPT课件主要包含了是酸的吗,想一想,动手试一试,动动脑动动脑,pH56的降水,想一想想一想等内容,欢迎下载使用。
初中科学浙教版九年级上册第2节 物质的酸碱性教案配套课件ppt: 这是一份初中科学浙教版九年级上册第2节 物质的酸碱性教案配套课件ppt,共32页。PPT课件主要包含了酸性物质,碱性物质,酸碱性的测定,物质酸碱性的测定,酸碱性强弱的不同,使用方法,你能看出些什么,酸度计,酸雨的危害,比一比等内容,欢迎下载使用。













