









所属成套资源:高中化学新教材同步必修第一册课件PPT+讲义(教师版+学生版)
人教版 (2019)第二章 海水中的重要元素——钠和氯第三节 物质的量一等奖课件ppt
展开
这是一份人教版 (2019)第二章 海水中的重要元素——钠和氯第三节 物质的量一等奖课件ppt,文件包含高中化学新教材同步必修第一册第11讲物质的量一物质的量的单位-摩尔教师版docx、高中化学新教材同步必修第一册第11讲物质的量一物质的量的单位-摩尔学生版docx、高中化学新教材同步必修第一册第11讲物质的量一物质的量的单位-摩尔PPT课件pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
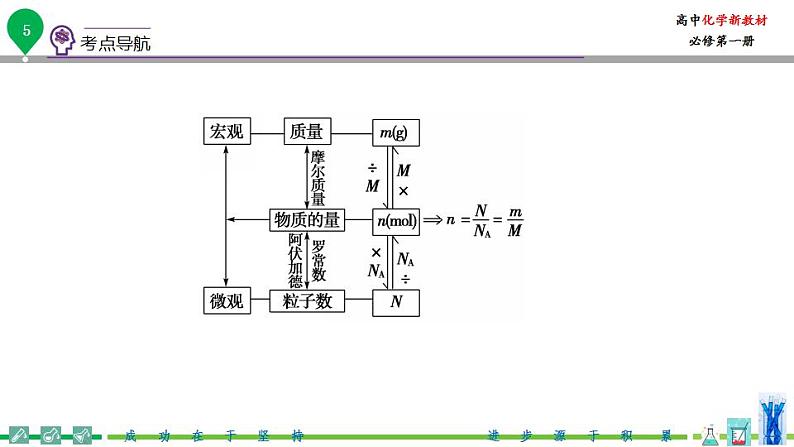
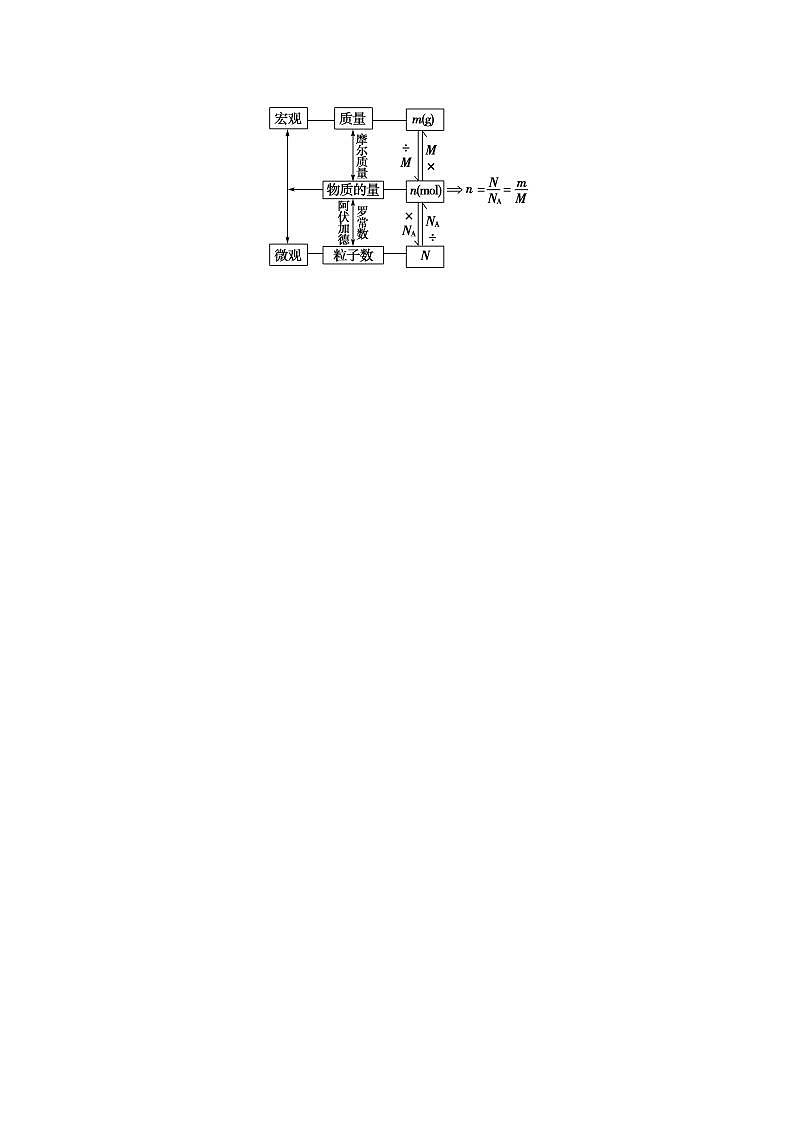
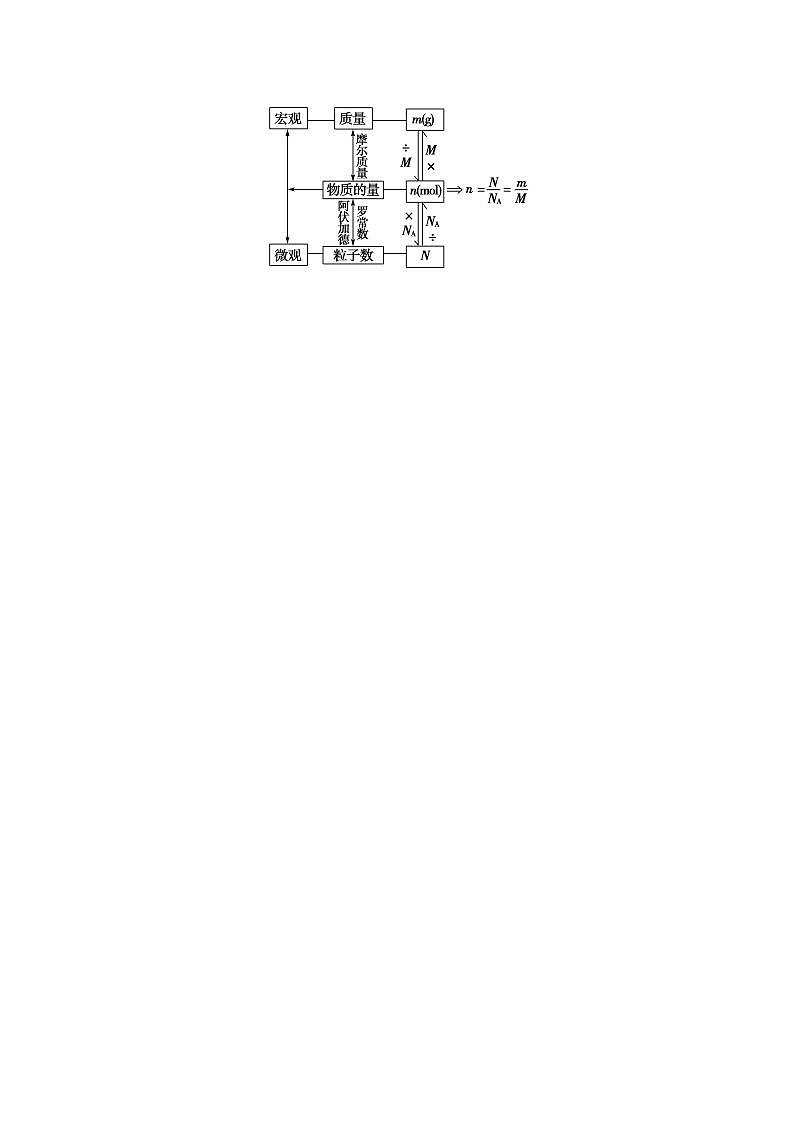
高中化学新教材特点分析及教学策略(一)化学基本概念和化学基本理论:全套教材的知识安排,注意各年级内及各年级间的联系,在保证知识结构的系统性和完整性的同时,对内容的安排采用了将各部分知识分散处理,相对集中的方法。(二)元素化合物知识:关于元素化合物知识,高一教材首先介绍了碱金属和卤素两个最典型的金属族和非金属族。(三)化工基础知识:高一介绍了硅酸盐工业和环境保护知识。高二主要介绍合成氨工业,删掉了硝酸工业、钢铁工业和铝的冶炼。重点突出了合成氨工业中合成氨条件的选择。 知识点一: 一、物质的量及其单位1.引入物质的量的意义物质的量是将可称量的物质与难以称量的微观粒子之间联系起来的“桥梁”。2.物质的量(1)定义:物质的量是一个物理量,表示含有一定数目粒子的 ,符号为n。(2)单位:物质的量的单位为摩尔,简称摩,符号为 。1 mol粒子集合体所含的粒子数约为 。(3)国际单位制(SI)的7个基本单位物理量 质量 电流热力学温度物质的量发光强度单位(符号)米(m) 秒(s)安(A)开(K) 坎(cd) 3.阿伏加德罗常数(1)阿伏加德罗常数是1摩尔任何粒子的粒子数,符号是 ,单位是 。NA= 。(2)物质的量、阿伏加德罗常数与粒子数之间的关系: 。4.摩尔的使用(1)mol可以计量所有微观粒子(包括 等),如1 mol Fe、1 mol O2、1 mol OH-、1 mol e-等。不能计量宏观粒子,不能说1 mol大米。(2)用mol作单位时,必须指明粒子种类,且粒子种类要用 或粒子符号。5.物质与构成粒子的物质的量关系(1)Na2CO3——2Na+——CO——3O (2)H2SO4——2H——S——4O 1 mol 2 mol 1 mol 3 mol 1 mol 2 mol 1 mol 4 mol【答案】2.物质的量(1)集合体,(2)mol。6.02×1023。(3)长度 千克(kg) 时间 摩(mol)3.(1)NA,mol-16.02×1023_mol-1。(2)n=。4.(1)原子、分子、离子、原子团、电子、质子、中子。(2)化学式。微警示1.物质的量——“四化”专有化“物质的量”四个字是一个整体,不能拆开,也不能添字。如不能说成“物质量”或“物质的数量”等微观化只用来描述微观粒子,如原子、分子、离子、中子、质子、电子等及这些粒子的特定组合,如NaCl;不能表示宏观的物质,如米具体化必须指明具体粒子的种类,常用化学式表示,如“1 mol O”“2 mol O2”“1.5 mol O3”;不能说“1 mol 氧”集体化物质的量可以表示多个微粒的特定组合或集合体,如1 mol NaCl,0.5 mol H2SO4 2.阿伏加德罗常数——“三量”
基准量0.012 kg 12C中所含的碳原子数准确量是一个物理量,用NA表示,单位是mol-1近似量6.02×1023 mol-1【即学即练1】1.下列关于摩尔的说法中正确的是A.摩尔是物理量之一 B.摩尔是物质的量的单位C.摩尔是表示物质结构微粒的数量单位 D.摩尔是以克为单位的质量单位【答案】B【解析】A.摩尔是物质的量的单位,不是物理量之一,A项错误;B.摩尔是物质的量的单位,B项正确;C.物质的量表示含有一定数目粒子的集体,故摩尔是表示含有一定数目粒子的集体的单位,C项错误;D.摩尔是以摩尔每升为单位的物质的量的单位,D项错误;答案选B。2.下列叙述错误的是A.1mol任何物质都含有约6.02×1023个原子B.1molC含有约6.02×1023个碳原子C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类D.物质的量是国际单位制中七个基本物理量之一【答案】A【解析】A.1mol任何物质都含有6.02×1023个微粒,微粒可能是分子,也可能是原子,A叙述错误;B.国际上规定,1mol粒子集体所含的粒子数与0.012kg12C中所含的碳原子数相同,把1mol任何粒子的粒子数叫做阿伏加德罗常数,所以0.012kg12C含有阿伏加德罗常数个碳原子,B叙述正确;C.在使用摩尔表示物质的量的单位时,应指明粒子的种类,C叙述正确;D.长度、质量、时间、电流强度、热力学温度、物质的量、光强度为七个基本物理量,则物质的量是国际单位制中七个基本物理量之一,D叙述正确;故选A。3.下列关于物质的量的叙述,正确的是A.1mol任何物质都含有个分子B.中含有约个碳原子C.1mol水中含有2mol氢和1mol氧
D.1molH含有个电子【答案】B【解析】A.物质不都是由分子构成的,有些物质是由分子构成的(例如水、硫酸等),有些物质是由离子构成的[例如NaCl、Ca(OH)2等],还有些物质是由原子直接构成的(例如金刚石等),1mol任何物质不一定都含有6.02×1023个分子,故A不符合题意;B.12C是由原子构成的,阿伏加德罗常数的精确值是0.012kg12C中含有的原子数,近似值约为6.02×1023个碳原子,故B符合题意;C.“2mol氢和1mol氧”没有指明粒子的种类,故C不符合题意;D.1个氢原子中含有1个电子,则1molH含有1×6.02×1023=6.02×1023个电子,故D不符合题意;答案选B。4.下列说法正确的是A.摩尔是一个物理量,每摩尔物质含有6.02×1023个微粒B.2H既可表示2个氢原子,又可表示2 mol氢原子C.1 mol氯含有6.02×1023个微粒D.阿伏加德罗常数数值约为6.02×1023【答案】D【解析】A.摩尔是物质的量的单位,有的物质不是有分子构成的,如氯化钠、二氧化硅等,所以每摩尔物质不一定含有6.02×1023个分子,故A错误;B.2H表示2个氢原子,不表示2mol氢原子,故B错误;C.1mol氯,没有指出是氯原子还是氯气分子,则无法计算微粒,故C错误;D.1mol物质中含有的微观离子数为阿伏加德罗常数,6.02×1023为阿伏加德罗常数的近似值,故D正确;故选:D。知识点二: 二、摩尔质量1.定义及符号: 的物质具有的质量,符号为 。2.定义式:M=。3.单位:g/mol或g·mol-1。4.数值:以g/mol为单位时,数值与该粒子的 相等 。5.示例:M(Na)= ,M(KCl)= ,M(CO)= ,M(Na2CO3)= 。
【答案】1.单位物质的量,M。4.相对原子质量或相对分子质量 。5.23g/mol,74.5g/mol,60g/mol,106g/mol。3.摩尔质量——“三性”等值性摩尔质量(单位为g·mol-1时)只是在数值上与相对分子质量或相对原子质量相等,其含义和单位是不同的。确定性对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。近似量由于电子的质量非常微小,所以离子的摩尔质量以g·mol-1为单位时,其数值近似等于该粒子的相对原子质量,如Na和Na+的摩尔质量都为23 g·mol-1。【即学即练2】1.1克氮气含有m个氮分子,则阿伏加德罗常数可表示为A. B. C. D.【答案】C【解析】1克氮气的物质的量为mol,又含有m个氮分子,故阿伏加德罗常数为==。故选C。2.下列关于物质的量的叙述正确的是A.的摩尔质量为44B.16g的物质的量为1molC.标准状况下,的体积约为22.4LD.在0.5mol中含有的数目约为个【答案】D【解析】A.的摩尔质量为44g/mol,故A错误;B.16g的物质的量为=0.5mol,故B错误;C.标准状况下,水不是气体,不能计算其物质的量,故C错误;D.0.5mol中含有的物质的量为1mol,数目为个,故D正确;故选D。3.下列说法不正确的是
A.H2的摩尔质量是2 gB.1 mol NaCl的质量是58.5 gC.氧气的摩尔质量是32 g·mol-1D.2 g H2含2 mol H【答案】A【解析】A.摩尔质量的单位为g/mol,所以H2的摩尔质量是2 g/mol,选项A不正确;B.1 mol NaCl的质量是1mol×58.5g/mol=58.5 g,选项B正确;C.氧气的相对分子质量为32,所以O2的摩尔质量是32 g/mol,选项C正确;D.2 g H2含H原子的物质的量为=2mol,选项D正确;答案选A。4.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是A.64g B.32g C.64g/mol D.32g/mol【答案】D【解析】根据n=N/NA,计算出1.505×1023个X气体分子的物质的量为0.25mol,结合其质量为8g,利用n=m/M的关系,可得M(X)=32g/mol。故选D。 (1)一种微观粒子的摩尔质量就是1 mol该微观粒子的质量,这种说法对吗?为什么?【细剖精析】不对。摩尔质量的单位是g·mol-1,物质的质量单位是g,二者的意义不同。(2)1 mol H、1 mol H+、1 mol H2的含义一样吗?为什么?能说1 mol大米吗?【细剖精析】意义不同。尽管都是1摩尔粒子,但粒子种类不同,它们分别表示1摩尔氢原子、1摩尔氢离子和1摩尔氢分子;mol后面只能是分子、原子等微观粒子,不能是大米、桌子等宏观物质。(3)“物质的量”与“物质的质量”有何不同?试从概念、研究对象、单位等方面进行比较。【细剖精析】①概念不同:“物质的量”是度量物质所含微观粒子集体多少的一个物理量,而“物质的质量”是描述物体所含物质多少的物理量。②研究对象不同:“物质的量”研究对象是微观粒子;“物质的质量”研究对象可以是宏观物质也可以是微观粒子。
③单位不同:“物质的量”单位是摩尔,“物质的质量”单位是克或千克。(4)“1 mol小米”和“1 mol氧”这两种说法是否正确?为什么?【细剖精析】不正确。①物质的量度量的对象是微观粒子,如原子、分子、离子、原子团、中子、质子、电子等,也可以是这些粒子的特定组合,而不能指宏观物体,因此“1 mol小米”说法错误。②在用“mol”为单位衡量物质时,要用化学式指明粒子的种类,表述要确切,如“1 mol O”表示1 mol氧原子,“1 mol O2”表示1 mol氧分子,“1 mol O2-”表示1 mol 氧离子,而不能说“1 mol氧”,因为“氧”是元素名称,不是微粒名称,也不是微粒的符号或化学式,这里的氧指代不明确,因此“1 mol氧”说法错误。(5)物质的量的单位——摩尔是如何规定的?【细剖精析】1 mol粒子数是指0.012 kg 12C含有的碳原子数,其数值约为6.02×1023。(6)阿伏加德罗常数与6.02×1023有何不同?【细剖精析】阿伏加德罗常数是单位为mol-1的物理量,其数值约为6.02×1023;而6.02×1023仅是一个数值。探究1 摩尔质量的含义(7)摩尔质量与物质的质量在概念和单位上有什么不同?【细剖精析】①概念不同。摩尔质量是指单位物质的量的物质所具有的质量,而质量是指物体所含物质多少的物理量。②单位不同。摩尔质量的单位是g·mol-1或kg·mol-1,而物质质量的单位是g或kg。(8)摩尔质量与相对原子或分子质量有何不同?【细剖精析】摩尔质量的单位是g/mol或kg/mol等,同种物质的摩尔质量因单位不同而数值不同;相对原子或分子质量的单位为1,同种原子或分子的相对原子或分子质量相同。(9)一种微粒的摩尔质量就是1 mol该微粒的质量,这种说法对吗?已知1个氧原子的质量为2.657×10-26 kg,请计算O2的摩尔质量为多少?【细剖精析】不对;摩尔质量的单位是g/mol,物质的质量单位是g,两者的意义不同。O2的摩尔质量为2×2.657×10-26 kg×103 g·kg-1×6.02×1023 mol-1≈32 g·mol-1。一、理解物质的量的有关概念物质的量“物质的量”四个字是一个整体,不能添字、漏字或换字,如不能说成“物质量”“物质的质量”“物质的数量”等摩尔只能用来描述微观粒子
,如原子、分子、离子、电子、质子、中子等,也可以是这些微观粒子的特定组合,如1 mol NaOH阿伏加德罗常数NA的基准是1 mol粒子集合体所含的粒子数约为6.02×1023,表示微观粒子数目时,可以用NA来表示,也可以用6.02×1023 mol-1表示,如1 mol O2中含有氧分子数为NA个或6.02×1023个摩尔质量(1)混合物的摩尔质量一般称为平均摩尔质量(2)以g·mol-1为单位时数值上等于物质的相对原子(分子)质量(单位为1),等于1 mol物质的质量(单位:g)(3)对于指定的物质,摩尔质量是确定不变的,与物质的多少无关 二、物质的量、阿伏加德罗常数、物质的质量及粒子数之间的相关计算计算关系式(公式)主要应用注意事项n=在n、N和NA中,已知任意两项求第三项①NA有单位:mol-1②求n或N时,概念性问题用NA;数字性问题用6.02×1023 mol-1M=① 在M、n和m中,已知任意两项求第三项②先求M,后求MrM的单位取g·mol-1,m的单位取g①在m、M、NA和N中已知任意三项求第四项②以n恒等列代数方程式解决较复杂的问题与N有关的问题莫忽视微粒的组成和种类 三、n、M、NA、m的有关计算与换算
题组A 基础过关练1.2018年11月13日至16日,第26届国际计量大会在巴黎召开,会上,对物质的量的单位——摩尔的定义进行了修改。摩尔来源于拉丁文moles,原意为大量、堆积,是在1971年10月,有41个国家参加的第14届国际计量大会决定增加的国际单位制(SI)的第七个基本单位。下列对于“摩尔”的理解正确的是A.1mol任何物质所含有的原子数都相同B.摩尔是物质的量的单位,简称摩,符号为molC.摩尔可以把物质的宏观数量与微观粒子的数量联系起来D.国际上规定,0.012kg12C中所含有的碳原子数目为1摩【答案】B【解析】A.因不同物质分子中所含有的原子个数不尽相同,A错误;B.摩尔是物质的量的单位,简称摩,符号为mol,B正确;C.物质的量是一个物理量,摩尔是物质的量的单位,不是物理量,物质的量把宏观物质与微观粒子联系起来,C错误;D.0.012kg12C中所含有的碳原子数目是阿伏加德罗常数,D错误;故选B。
2.下列说法中正确的是A.摩尔是表示物质质量的单位B.物质的量适用于计量分子、原子、离子等粒子的集合体C.摩尔是表示物质所含微粒个数的物理量D.物质的量就是指物质的质量【答案】B【解析A.摩尔是物质的量的单位,A错误;B.物质的量是表示一定数目粒子的集合体的物理量,适用于计量分子、原子、离子等粒子的集合体,B正确;C.摩尔是物质的量的单位,不是物理量,C错误;D.物质的量是表示一定数目粒子的集合体的物理量,不是物质的质量,D错误;选B。3.下列叙述错误的是①摩尔是国际单位制中七个基本物理量之一; ②1 mol任何物质都含有约6.02×1023个原子;③6.02×1023就是阿伏加德罗常数;④氢原子的摩尔质量是1 g;⑤HCl的摩尔质量等于1 mol HCl分子的质量;⑥1 mol CO2中含有1 mol碳和2 mol氧。A.①②③ B.②③④C.②③④⑥ D.全部【答案】D【解析】①摩尔不是物理量,是物质的量的单位,错误;②1 mol任何物质都含有约6.02×1023个结构粒子,不一定是原子,错误;③阿伏加德罗常数约为6.02×1023 mol-1,错误;④H的摩尔质量为1 g·mol-1,错误;⑤摩尔质量与质量单位不同,错误;⑥1 mol碳和2 mol氧均未指明粒子种类,错误。故答案选D。4.下列叙述错误的是①摩尔是国际单位制中七个基本物理量之一;②1mol任何物质都含有约6.02×1023个原子;③6.02×1023就是阿伏加德罗常数;④氢原子的摩尔质量是1g;⑤1mol CO2中含有1mol碳和2mol氧。A.①②③ B.②③④ C.②④⑤ D.全部
【答案】D【解析】①物质的量是国际单位制中七个基本物理量之一,摩尔是物质的量的单位,故①错误;②物质不一定由原子构成,故1mol物质中不一定都含有约6.02×1023个原子,还可能是分子或离子,故②错误;③12g12C原子含有的原子个数是阿伏加德罗常数,近似为6.02×1023mol-1,故③错误; ④摩尔质量的单位是g/mol,则氢原子的摩尔质量是1 g/mol,故④错误; ⑤用物质的量描述微粒的含量时要明确微粒的种类,则1 mol CO2中含有1 mol碳原子和2 mol氧原子,故⑤错误;答案选D。5.用NA表示阿伏加德罗常数值,下列叙述正确的是A.18gD2O和18gH2O中含有的质子数均为10NAB.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NAC.1molN2与3molH2充分反应生成的NH3分子数为2NAD.1mol碳正离子()所含的电子数为6NA【答案】B【解析】A.18gD2O的物质的量为=0.9mol,故含有的质子数为9NA,故A错误;B.CO2和O2组成的混合物中共有NA个分子,则该混合物为1mol,即1mol该混合物中含有氧原子物质的量为2mol,故B正确;C.该反应为可逆反应,反应不能进行到底,因此NH3的物质的量小于2mol,故C错误;D.1mol所含电子物质的量为1mol×(6+3-1)=8mol,故D错误。故选B。6.是阿伏加德罗常数的值。下列说法错误的是A.与的混合物中所含中子数为B.32g环状(如图)分子中含有的S—S键数为8C.9.2g乙醇完全燃烧,生成的数目为0.4D.1mol碘蒸气和1mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2
【答案】B【解析】A.H218O与D2O的中子数都为10,摩尔质量都为20g/mol,所以2.0gH218O与D2O的混合物中所含中子数为×10×NAmol—1=NA,故A正确;B.由图可知,环状S8分子中含有8个硫硫键,则32g环状S8分子中含有硫硫键的数目为×8×NAmol—1=NA,故B错误;C.1mol乙醇完全燃烧生成2mol二氧化碳,则9.2g乙醇完全燃烧生成二氧化碳的数目为×2×NAmol—1=0.4NA,故C正确;D.碘蒸气和氢气生成碘化氢的反应为可逆反应,可逆反应不可能完全反应,所以1mol碘蒸气和1mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA,故D正确;故选B。7.下列叙述中正确的是A.硫酸的摩尔质量是98gB.1molMg的质量在数值上等于镁的摩尔质量C.Fe2+与Fe3+的摩尔质量不相同D.铁的摩尔质量就是铁原子的相对原子质量【答案】B【解析】A.摩尔质量的单位是g/mol,硫酸的摩尔质量是98g /mol,A错误;B.如果质量的单位是g,则摩尔质量在数值上等于该物质的相对原子质量或相对分子质量,B正确;C.Fe2+与Fe3+的摩尔质量相同,都是56g/mol,C错误;D.摩尔质量与相对原子质量意义不同,D错误;故选B。8.40.5 g某金属氯化物RCl2含有0.6 mol氯离子,则金属R的摩尔质量为A.135g B.135g·mol−1 C.64 D.64g·mol−1【答案】D【解析】RCl2的物质的量为0.3 mol,RCl2的摩尔质量为,则R的摩尔质量为135 -35.5×2=64 g·mol-1,答案选D。题组B 能力提升练1.物质的量是表示含有一定数目微粒集合体的物理量。下列说法错误的是
A.常温下1molN2的质量为28gB.1mol某种微粒集合体含微粒数目约为6.02×1023C.化学反应中各物质的质量之比等于它们的物质的量之比D.该物理量不能用于描述宏观物质形成的集合体【答案】C【解析】A.N2的摩尔质量为28g/mol,所以1molN2的质量等于28g,A正确;B.国际计量大会规定:1mol粒子集合体所含的粒子数与0.012kg12C中所含的碳原子数相同,约为6.02×1023,B正确;C.根据公式m=n×M可知:质量之比不一定等于物质的量之比,C错误;D.物质的量的计量对象是构成物质的微观粒子或某些微观粒子的特定组合,不可用于描述宏观物质,D正确;答案选C。2.下列说法正确的是A.摩尔是国际单位制中的基本物理量B.1mol H2O中所含氧原子的质量为16gC.铁原子的摩尔质量和它的相对原子质量相等D.某物质含有6.02×1023个原子,则该物质的物质的量为1mol【答案】B【解析】A.摩尔是国际单位制中的基本单位,A项错误;B.1mol H2O中所含氧原子的物质的量为1mol,则氧原子的质量为,B项正确;C.铁原子的摩尔质量和它的相对原子质量在数值上相等,C项错误;D.某物质含有6.02×1023个原子,则该物质含有的原子为1mol,但该物质的物质的量不一定为1mol,D项错误;答案选B。3.下列关于阿伏加德罗常数的说法中正确的是A.6.02×1023叫做阿伏加德罗常数B.12 g 12C含有的碳原子数就是阿伏加德罗常数C.含有阿伏加德罗常数个微粒的物质是1摩尔D.1摩尔氯含有6.02×1023个氯分子【答案】B
【解析】A.阿伏加德罗常数是精确值,其近似值为6.02×1023mol-1,6.02×1023不是阿伏伽德罗常数,选项A错误;B.12g12C的物质的量是1mol,所以12g12C含有的碳原子数为阿伏加德罗常数,选项B正确;C.含有阿伏加德罗常数个微粒的物质不一定是1摩尔,例如含有阿伏加德罗常数个氢原子的氢气物质的量是0.5mol,选项C错误;D.1mol氯不知氯原子、离子、分子,应用物质的量要指明微粒种类,选项D错误;答案选B。4.ag单质碳和16g氧气在恒容密闭容器中反应生成CO、CO2,当恢复到原来的温度时,测得容器内的压强增大了0.8倍(忽略固体对压强的影响),下列数据不可能是A.a = 7.2 B.反应后混合气体≈29.8 g/mol C.n(CO) = 0.8 mol D.m(CO2) = 4.4 g【答案】A【解析】16g氧气的物质的量为0.5mol,容器内的压强增大了0.8倍,所以反应后生成的气体共0.5mol×1.8=0.9mol,设生成的气体中CO为x mol、CO2为y mol,则有x+2y=0.5×2、x+y=0.9,联立解得x=0.8mol、y=0.1mol,根据碳元素守恒可知反应前单质碳的物质的量为0.9mol。A.单质碳的物质的量为0.9mol,质量为0.9mol×12g/mol=10.8g,A错误;B.混合气体的平均摩尔质量为≈29.8 g/mol,B正确;C.根据分析可知CO的物质的量为0.8mol,C正确;D.CO2的物质的量为0.1mol,质量为0.1mol×44g/mol=4.4g,D正确;综上所述答案为A。5.下列叙述正确的是A.3.01 ×1023个 SO2分子的质量为32gB.CH4的摩尔质量为16gC.1 mol H2O的质量为18g/molD.1 mol氯气中含有电子总数为71 ×6.02 ×1023【答案】A【解析】A.3.01 ×1023个 SO2分子的质量为,故A正确;B.CH4的摩尔质量为16g/mol,故B错误; C.1 mol H2O的质量为18g,故C错误;
D.1 mol氯气中含有电子总数为1×34×6.02 ×1023,故D错误;选A。6.下列说法正确的是A.硫酸和磷酸的摩尔质量相等B.18g水中含有1mol微粒C.标况下CO的摩尔质量是22.4L/molD.O2的摩尔质量就是其相对分子质量【答案】A【解析】A.硫酸和磷酸的摩尔质量都是98g/mol,两者相等,故A正确;B.未指明微粒是什么,不能计算,故B错误;C.摩尔质量是不变值,CO的摩尔质量是28g/mol,故C错误;D.摩尔质量与它的相对分子质量在数值上相等,但是两个不同物理量,代表意义不同,不能直接相等,故D错误;故选:A。7.下列有关概念描述中不正确的是A.物质的量表示含有一定数目粒子的集合体B.某气体的摩尔质量在数值上与其相对分子质量相等C.0.012 kg12C中含有的碳原子的物质的量是1摩尔D.NA数值上等于6.02×1023【答案】D【解析】A.物质的量是国际单位制中一个基本物理量,其表示的意义是一定数目粒子的集合体,A正确;B.当摩尔质量是以g/mol为单位时,某气体的摩尔质量在数值上与其相对分子质量相等,B正确;C.C原子有多种,在国际上规定:0.012 kg12C中所含有的碳原子,其物质的量是1摩尔,C正确;D.NA是单位物质的量的物质中所含有的基本构成微粒数目,其近似值是6.02×1023,D错误;故合理选项是D。8.已知X-离子含a个中子,其质量数为b,则cg X-含电子的物质的量为( )molA. B. C. D.【答案】B【解析】X-离子含a个中子,其质量数为b,则质子数为b-a,电子数为b-a+1,cg X-的物质的量为
mol,则该离子含有电子的物质的量为,B项符合题意。答案选B。题组C 培优拔尖练1.完成下列计算:(1)硫原子的摩尔质量是___________。(2)0.5molH2SO4的质量是___________g,含___________个分子,含___________mol氧原子,能和___________molNaOH完全反应。(3)含0.4molCl-的氯化镁是___________mol,质量是___________g,它跟___________g氯化钠含有相同数目的Cl-。(4)0.3mol氨气和0.4mol二氧化碳的质量之比为___________,所含原子数之比___________。(5)已知4.8g某混合气体含分子数为0.15NA,该气体的平均摩尔质量为___________。【答案】(1)32g/mol(2) 49 0.5NA 2NA 1(3) 0.2 19 23.4(4) 51:176 1:1(5)32g/mol【解析】(1)硫原子的摩尔质量是32g/mol。(2)0.5molH2SO4的质量是0.5mol×98g/mol=49g,含有的分子个数为0.5NA,含有的氧原子数为4×0.5NA=2NA,共1molH+,故能和1molNaOH完全反应。(3)1mol氯化镁中含有2mol氯离子,故含0.4molCl-的氯化镁是0.2mol,质量是0.2mol×95g/mol=19g;与0.4mol氯化钠含有相同数目的Cl-,氯化钠的质量为0.4mol×58.5g/mol=23.4g。(4)0.3mol氨气和0.4mol二氧化碳的质量之比为0.3×17:0.4×44=51:176,所含原子数之比为0.3×4:0.4×3=1:1。(5)某混合气体的物质的量为=0.15mol,平均摩尔质量为=32g/mol。2.填写下列空白:(1)3.01×1023个SO2分子中含有氧原子的个数为___;SO2气体的质量为___。(2)常温常压下,92gNO2气体含有的原子数为(用NA表示阿伏加德罗常数的值)___。(3)NO和O2可发生反应:2NO+O2=2NO2,现有amolNO和bmolO2充分反应后氮原子与氧原子的个数比为___。
(4)4.5gH2O与___gH2SO4所含的分子数相等,它们所含氧原子数之比是___。【答案】(1) 6.02×1023 32g(2)6NA(3)a∶(a+2b)(4) 24.5 1∶4【解析】(1)根据n=可知3.01×1023个SO2分子为0.5mol,含有氧原子的个数为0.5mol2N =1.0NA=6.02×1023;SO2气体的质量m=nM=0.5mol64g/mol=32g,故答案:6.02×1023;32g。(2)根据n=可知92gNO2气体为2mol,含有的原子数N=3nNA=6NA,故答案:6NA。(3)已知NO和O2可发生反应:2NO+O2=2NO2,根据原子守恒规律可知:amolNO和bmolO2充分反应后,氮原子与氧原子的个数比为a:(a+b),故答案:a:(a+b)。(4)根据n=可知4.5gH2O为0.25mol, 0.25mol H2SO4的质量m=0.25 mol98g/mol=24.5g,H2O和H2SO4所含氧原子数之比为1:4。故答案:24.5;1:4。
相关课件
这是一份人教版 (2019)必修 第一册第三节 物质的量一等奖课件ppt,共16页。PPT课件主要包含了物质的量,微观粒子,宏观物质,物理量,单位名称,单位符号,电流强度,热力学温度,发光强度,开尔文等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量背景图ppt课件,共12页。PPT课件主要包含了资料在线等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量优质课件ppt,文件包含高中化学新教材同步必修第一册第13讲物质的量三物质的量浓度教师版docx、高中化学新教材同步必修第一册第13讲物质的量三物质的量浓度学生版docx、高中化学新教材同步必修第一册第13讲物质的量三物质的量浓度PPT课件pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。









