









所属成套资源:高中化学新教材同步必修第二册课件PPT+讲义(教师版+学生版)
人教版 (2019)必修 第二册第一节 硫及其化合物完美版ppt课件
展开
这是一份人教版 (2019)必修 第二册第一节 硫及其化合物完美版ppt课件,文件包含高中化学新教材同步必修第二册第03讲硫及其化合物三硫酸根离子的检验含硫物质的转化PPT课件pptx、高中化学新教材同步必修第一册第03讲硫及其化合物三硫酸根离子的检验含硫物质的转化教师版docx、高中化学新教材同步必修第一册第03讲硫及其化合物三硫酸根离子的检验含硫物质的转化学生版docx等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
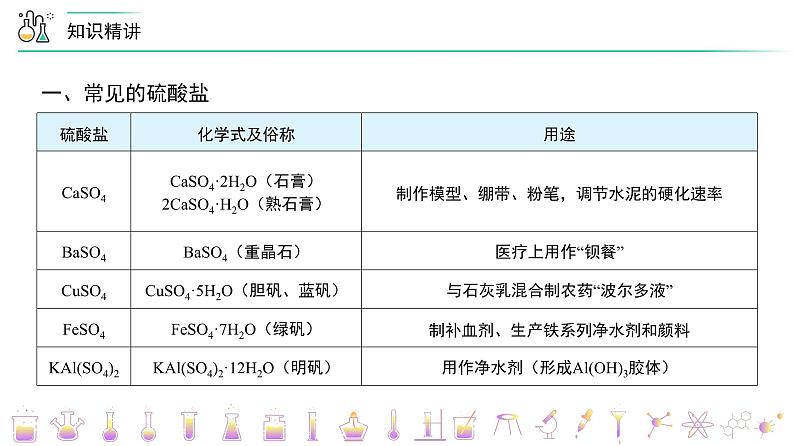
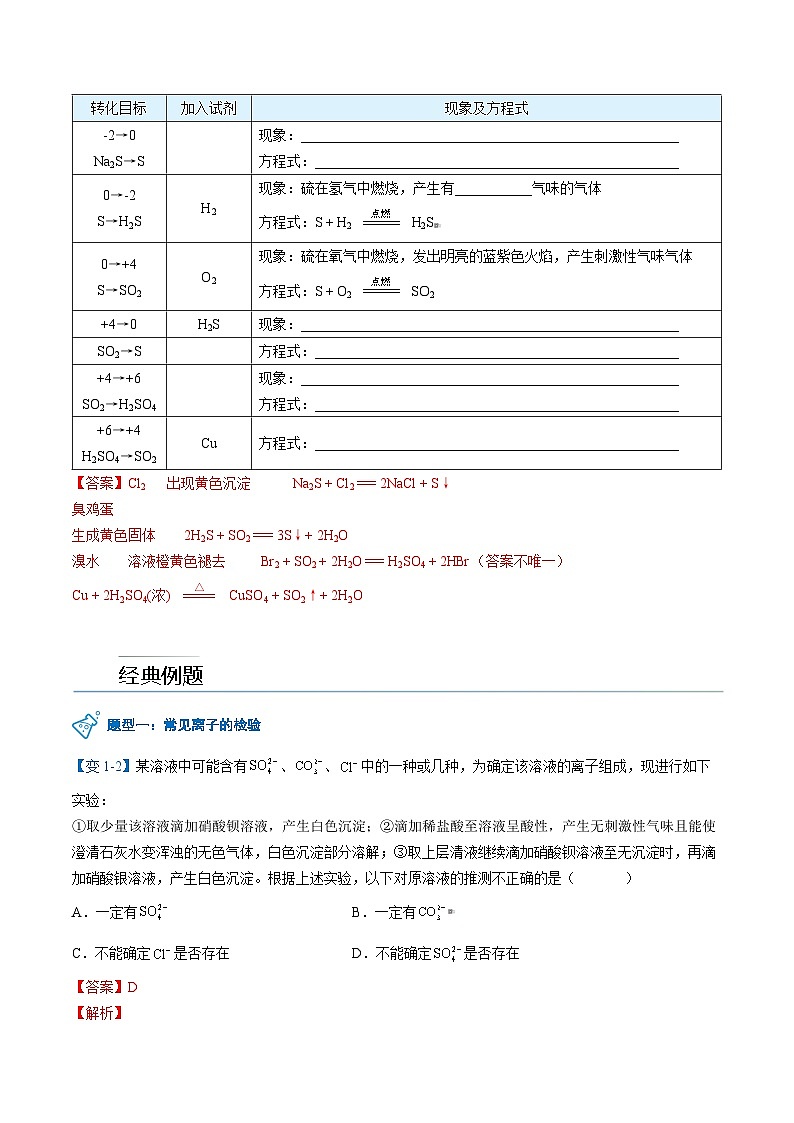
高中化学新教材特点分析及教学策略(一)化学基本概念和化学基本理论:全套教材的知识安排,注意各年级内及各年级间的联系,在保证知识结构的系统性和完整性的同时,对内容的安排采用了将各部分知识分散处理,相对集中的方法。(二)元素化合物知识:关于元素化合物知识,高一教材首先介绍了碱金属和卤素两个最典型的金属族和非金属族。(三)化工基础知识:高一介绍了硅酸盐工业和环境保护知识。高二主要介绍合成氨工业,删掉了硝酸工业、钢铁工业和铝的冶炼。重点突出了合成氨工业中合成氨条件的选择。 一、常见的硫酸盐硫酸盐化学式及俗称用途CaSO4CaSO4·2H2O(石膏)2CaSO4·H2O(熟石膏)制作模型、绷带、粉笔,调节水泥的硬化速率BaSO4BaSO4(重晶石)医疗上用作“钡餐”CuSO4CuSO4·5H2O(胆矾、蓝矾)与石灰乳混合制农药“波尔多液”FeSO4FeSO4·7H2O(绿矾)制补血剂、生产铁系列净水剂和颜料KAl(SO4)2KAl(SO4)2·12H2O(明矾)用作净水剂(形成Al(OH)3胶体) 二、硫酸根离子的检验检验原理Ba2+ + === BaSO4↓,BaSO4是一种不溶于稀盐酸的白色沉淀所需试剂BaCl2溶液,稀盐酸操作方法取适量待测液于试管中,加足量稀盐酸,无明显现象,再滴加BaCl2溶液,产生白色沉淀 三、粗盐提纯
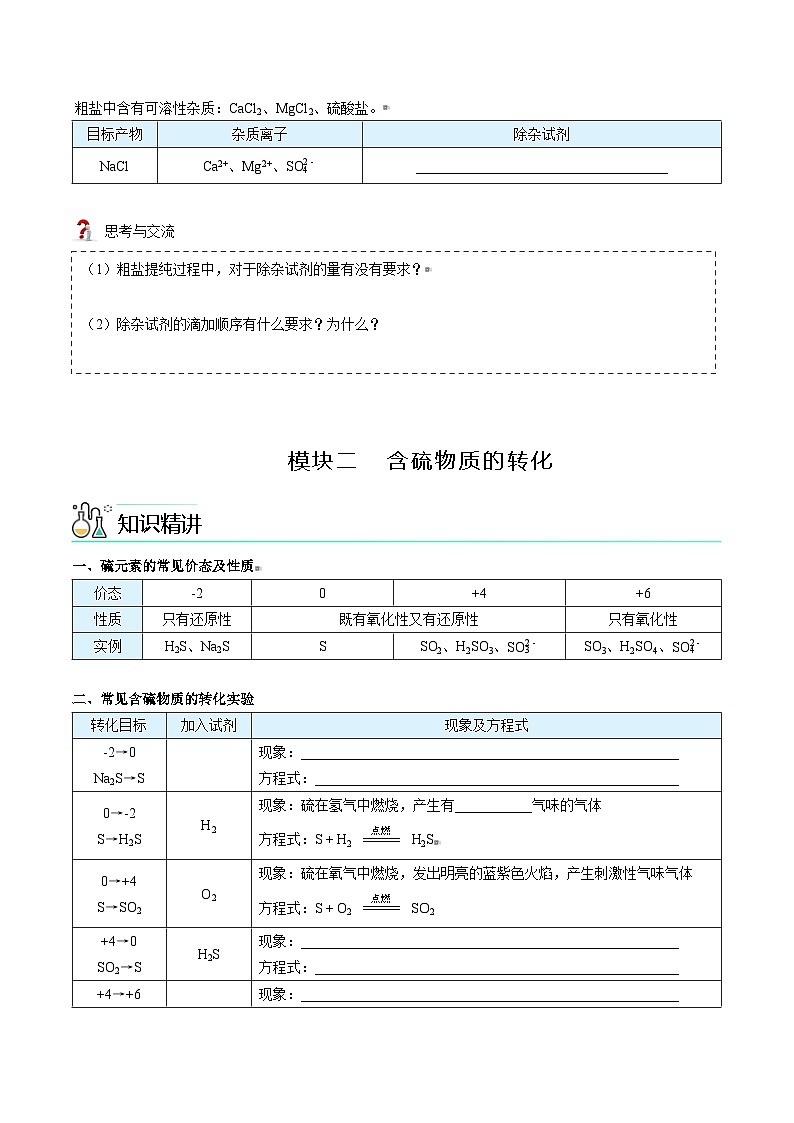
粗盐中含有可溶性杂质:CaCl2、MgCl2、硫酸盐。目标产物杂质离子除杂试剂NaClCa2+、Mg2+、____________________________________ 思考与交流 一、硫元素的常见价态及性质价态-20+4+6性质只有还原性既有氧化性又有还原性只有氧化性实例H2S、Na2SSSO2、H2SO3、SO3、H2SO4、 二、常见含硫物质的转化实验转化目标加入试剂现象及方程式-2→0Na2S→S 现象:______________________________________________________方程式:____________________________________________________0→-2S→H2SH2现象:硫在氢气中燃烧,产生有___________气味的气体方程式:S + H2 H2S0→+4S→SO2O2现象:硫在氧气中燃烧,发出明亮的蓝紫色火焰,产生刺激性气味气体方程式:S + O2 SO2+4→0SO2→SH2S现象:______________________________________________________方程式:____________________________________________________+4→+6 现象:______________________________________________________
SO2→H2SO4 方程式:____________________________________________________+6→+4H2SO4→SO2Cu方程式:____________________________________________________ 题型一:常见离子的检验【变1-2】某溶液中可能含有、、中的一种或几种,为确定该溶液的离子组成,现进行如下实验:①取少量该溶液滴加硝酸钡溶液,产生白色沉淀;②滴加稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的无色气体,白色沉淀部分溶解;③取上层清液继续滴加硝酸钡溶液至无沉淀时,再滴加硝酸银溶液,产生白色沉淀。根据上述实验,以下对原溶液的推测不正确的是( )A.一定有 B.一定有C.不能确定是否存在 D.不能确定是否存在 【例2】某溶液中含有硫酸镁和硫酸钠两种溶质,选择合适的试剂将溶液中的镁离子转化为沉淀分离出来,设计实验流程如下:(1)欲证明滤液中存在、,选用的方案是先取少量的滤液,向其中滴加过量的______,发现有气泡生成,再向其中加入______溶液,出现白色沉淀,则可证明、均存在。(2)洗涤碳酸镁沉淀的方法是____________。(3)如何检验碳酸镁沉淀是否洗涤干净?____________。 题型二:粗盐提纯 【变3】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
请回答下列问题:(1)写出实验流程中下列物质的化学式:试剂X_______,沉淀A________,沉淀B________。(2)上述实验流程中加入过量的Na2CO3的目的是_____________________________________。(3)按此实验方案得到的溶液3中肯定含有_________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,之后若要获得固体NaNO3需进行的实验操作是__________(填操作名称)。 题型三:含硫物质的转化【变4-1】硫元素的价类二维图如图所示。下列说法错误的是A.a与c、d、e都有可能反应生成bB.d溶液久置于空气中会生成e,溶液的减小C.盐g与盐f之间也可能发生反应D.铜与e的浓溶液共热产生的气体通入溶液中,无明显现象 【变4-2】“价一类”二维图是预测物质性质的重要思维工具。如图是硫元素的常见化合价与部分物质类别的对应关系:
(1)图中X、Y、Z三种物质中,属于电解质的是___、___(用化学式表示)。(2)Na2SO4的电离方程式为___。(3)硫代硫酸钠(Na2S2O3)俗称海波。从类别的角度分析,其属于___(填标号)。A.盐 B.碱 C.酸 D.氧化物从价态的角度分析,Na2S2O3___(填标号)A.只有氧化性 B.既有氧化性又有还原性 C.只有还原性(4)Z的浓溶液可用铝质容器储存的原因是___。(5)从物质的性质分析,Y不可用进行干燥___(填标号)。A.浓硫酸 B.碱石灰 C.P2O5固体(6)写出Y通过化合反应一步生成Z的化学方程式:___。 【例5】如图是硫元素在自然界中的循环示意图,下列说法不正确的是A.硫在自然界只有游离态B.煤中含有硫元素,燃煤中加入生石灰可脱硫C.硫具有弱氧化性,和变价金属反应,通常将金属氧化成低价态D.氢硫酸是弱酸,能与碱、碱性氧化物反应 【例7】利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:
(1)质量相同的a和b,物质的量之比为________。将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为________。(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为___________。(3)将足量的a通入BaCl2溶液中,下列说法正确的是___________(填标号)。A.溶液中出现白色沉淀 B.溶液没有明显变化C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2===2Ag2S + 2H2O。H2S在该反应中___________(填标号)。A.是氧化剂 B.是还原剂 C.既是氧化剂也是还原剂 D.既不是氧化剂也不是还原剂(5)已知e为正盐,且能被酸性K2Cr2O7氧化为Na2SO4,Cr2O72-被还原为Cr3+,写出此反应的离子方程式:___________________________________________________。 【例8】含硫化合物多为重要的化工原料。请回答下列问题:I.多硫化物是含多硫离子(Sx2-)的化合物,可用作废水处理剂、硫化剂等。(1)Na2S2的电子式为___。(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,该反应的离子方程式为___。(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,其煅烧的化学方程式为___。II.焦亚硫酸钠(Na2S2O5)是一种食品抗氧化剂,易溶于水。(4)焦亚硫酸钠(Na2S2O5)中硫元素的化合价为___。(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为__。(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠,发生反应的化学方程式为__。 【题1】向某溶液中滴入溶液,产生白色沉淀,再滴入稀盐酸,沉淀不溶解,则该溶液中( )
A.一定有 B.可能有或C.一定无 D.可能有 【题2】下列图示箭头方向表示与某种常见试剂在通常条件下发生转化,其中6步转化均能一步实现的一组物质是选项WXYZABCDSA.A B.B C.C D.D 【题4】已知硫代硫酸钠可作为脱氯剂,25.0 mL 0.100 mol·L-1的Na2S2O3溶液恰好把224 mL(标准状况下)Cl2转化为Cl-,则S2O将转化为A.S2- B.S C.SO D.SO 【题5】如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2C.反应③④⑤均属于氧化还原反应D.工业上可利用反应②和反应④回收SO2
【题8】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,在印染、医药及原子能工业中应用广泛,实验室以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛。已知:次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在120℃以上发生分解。实验装置及步骤如下: I.在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解后缓慢通入SO2至溶液pH约为4,制得NaHSO3溶液。II.将装置A中导气管换成橡皮塞。向三颈烧瓶中加入稍过量的锌粉和一定量37%甲醛溶液,在80℃~90℃下,反应约3h后,趁热过滤,温水洗涤。III.①将滤液蒸发浓缩,冷却结晶,过滤;②往滤液中加入适量试剂X,析出晶体,过滤;③合并滤渣,洗涤,干燥得到产品。请回答下列问题:(1)装置A中多孔球泡的作用是_________。(2)写出步骤I反应的化学方程式________。(3)步骤II中趁热过滤的目的是________。(4)步骤III蒸发浓缩时应注意________。(5)试剂X是______。A.饱和亚硫酸氢钠溶液 B.冷水 C.50%乙醇水溶液 D.无水乙醇(6)为测定该吊白块产品纯度,准确称取2.00g样品,完全溶于水后配成100mL溶液,取20.00mL所配溶液,加入过量I2(不能氧化HCHO,杂质不反应)完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得白色固体0.466g,则产品的纯度为______。 【练1】检验某溶液中是否含有SO42-离子,常用的方法是A.取样,滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有不溶于水的白色沉淀生成C.取样,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
D.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成 【练2】除去粗盐中的杂质CaCl2、MgCl2和Na2SO4,过程如图所示,下列有关说法中,不正确的A.除去Mg2+的主要反应:B.试剂①一定不是溶液C.检验是否除尽:取少量滤液,加稀盐酸酸化,再加BaCl2溶液D.滤液加稀盐酸时只发生反应: 【练3】某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是A.Na2CO3、NaCl、NaOH B.NaOH、NaCl、Na2CO3C.NaCl、NaOH、Na2CO3 D.NaCl、Na2CO3、NaOH 【练6】物质的类别和核心元素的化合价是研究物质化学性质的两个重要角度。某短周期元素的单质及其部分化合物的价类二维图如图所示。下列推断合理的是A.a到b、c、d、e、f均可直接转化B.标准状况下,1molb和c的混合物体积为22.4LC.可先加盐酸,再加氯化钡溶液检验e的钠盐是否变质D.f的水溶液在空气中放置,不易被氧化 【练7】食盐是人类生活中不可缺少的物质,海水中含有大量食盐。某地出产的粗盐中,所含杂质是CaCl2,通过下面的实验可制得纯净的NaCl。
请回答:(1)加入的A是__________,检验A已过量的方法是___________。(2)加入的B是__________,加入稍过量B的目的是__________。(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入_________________溶液。 【练8】化合价和物质类别是梳理元素及其化合物知识的两个线索,可表示为“价类”二维图。下图是硫元素的“价类”二维图。(1)X是_______(填化学式)。(2)可选取Y的浓溶液和反应来制备,该反应原理是______________________(填化学方程式);将排入大气中会引起________。(3)是一种食品添加剂,其应与图中_______(填化学式)在同一位置,其具有_______(填“氧化性”或“还原性”)导致中不可避免地存在。实验室中检验的常用方法是__________________________________________________________________________。(4)硫元素还有一种常见的价态-1价,如硫铁矿(主要成分为)中的硫元素。可以与溶液发生反应:。①该反应中的氧化剂是__________(填化学式)。②向反应后的溶液中通入空气就能使溶液再生,写出再生反应的离子方程式:____________________________________________。 【练9】含硫化合物的种类很多,分类依据也很多。、、、、、、是七种常见的含硫化合物。某同学按以下思路进行探究:(1)分类:若按酸、碱、盐、氧化物进行分类,则七种物质中属于盐的共有______
种;若将硫元素化合价相同的物质分为一类,则这七种物质可分为______类。(2)完成下列含硫化合物间的转化,写出相应的化学方程式(试剂可任选)。:______。:______。:______。(3)为减少的污染并变废为宝,我国正在探索在一定条件下用还原得到单质硫的方法来除去。该反应的化学方程式为____________。
相关课件
这是一份人教版 (2019)必修 第二册第一节 硫及其化合物集体备课ppt课件,共1页。
这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物公开课课件ppt,文件包含高中化学新教材同步必修第二册第01讲硫及其化合物一硫和二氧化硫PPT课件pptx、高中化学新教材同步必修第一册第01讲硫及其化合物一硫和二氧化硫教师版docx、高中化学新教材同步必修第一册第01讲硫及其化合物一硫和二氧化硫学生版docx等3份课件配套教学资源,其中PPT共42页, 欢迎下载使用。
这是一份人教版 (2019)必修 第二册第一节 硫及其化合物优秀ppt课件,共24页。PPT课件主要包含了硫酸的物理性质,硫酸的工业制法,硫酸的化学性质,根据元素组成分类,思考二,硫酸的用途,几种常见的硫酸盐,实验5-4,硫酸根离子的检验,待测液等内容,欢迎下载使用。











