



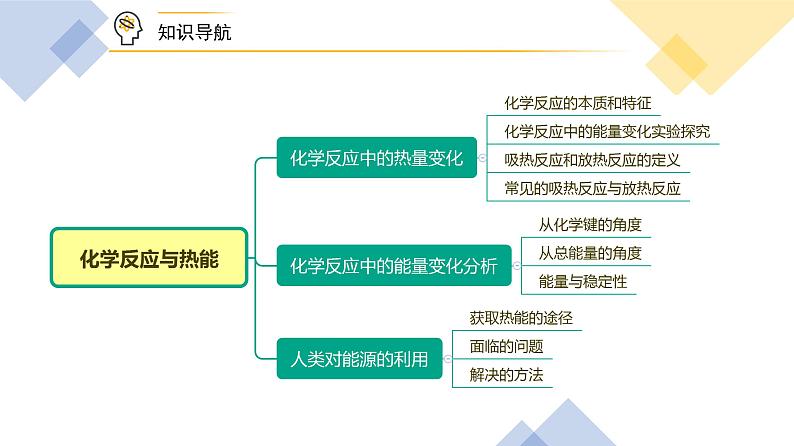






人教版 (2019)必修 第二册第一节 化学反应与能量变化精品ppt课件
展开高中化学新教材特点分析及教学策略
(一)化学基本概念和化学基本理论:全套教材的知识安排,注意各年级内及各年级间的联系,在保证知识结构的系统性和完整性的同时,对内容的安排采用了将各部分知识分散处理,相对集中的方法。
(二)元素化合物知识:关于元素化合物知识,高一教材首先介绍了碱金属和卤素两个最典型的金属族和非金属族。
(三)化工基础知识:高一介绍了硅酸盐工业和环境保护知识。高二主要介绍合成氨工业,删掉了硝酸工业、钢铁工业和铝的冶炼。重点突出了合成氨工业中合成氨条件的选择。
一、化学反应的本质和特征
1.本质:
(1)化学反应的本质是旧化学键的_______和新化学键的_______。
(2)断开化学键要_______能量,形成化学键要______能量,吸收的能量与释放的能量__________。
2.特征:
(1)生成新物质(符合质量守恒定律);
(2)释放能量或吸收能量(符合能量守恒定律)。
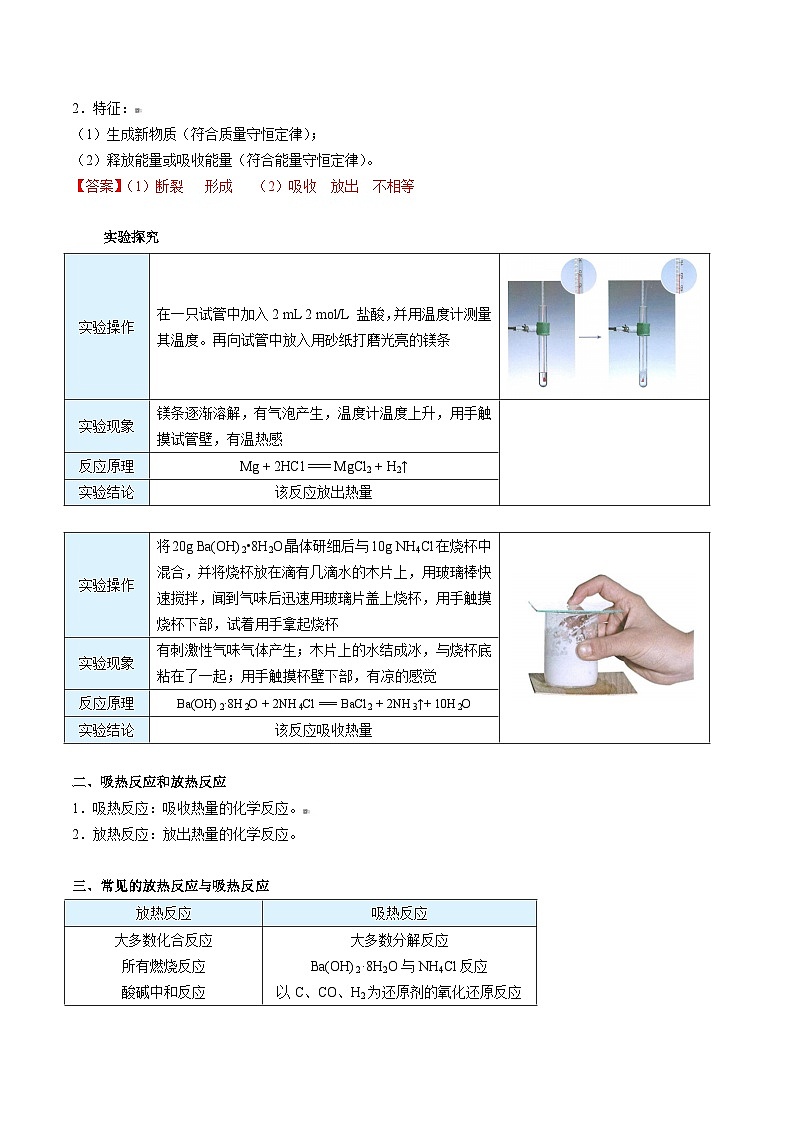
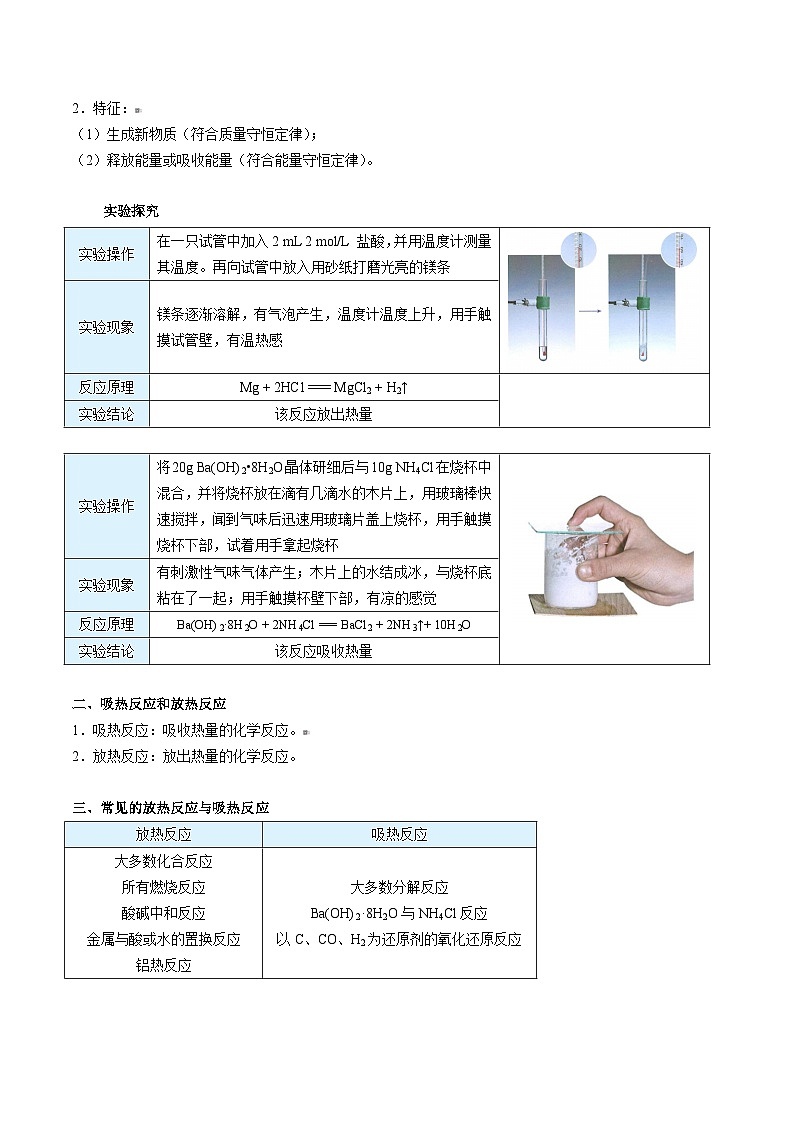
实验探究
实验操作 | 在一只试管中加入2 mL 2 mol/L 盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条 | |
实验现象 | 镁条逐渐溶解,有气泡产生,温度计温度上升,用手触摸试管壁,有温热感 | |
反应原理 | Mg + 2HCl === MgCl2 + H2↑ |
|
实验结论 | 该反应放出热量 |
实验操作 | 将20g Ba(OH)2•8H2O晶体研细后与10g NH4Cl在烧杯中混合,并将烧杯放在滴有几滴水的木片上,用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯下部,试着用手拿起烧杯 | |
实验现象 | 有刺激性气味气体产生;木片上的水结成冰,与烧杯底粘在了一起;用手触摸杯壁下部,有凉的感觉 | |
反应原理 | Ba(OH)2·8H2O + 2NH4Cl === BaCl2 + 2NH3↑+ 10H2O | |
实验结论 | 该反应吸收热量 |
二、吸热反应和放热反应
1.吸热反应:吸收热量的化学反应。
2.放热反应:放出热量的化学反应。
三、常见的放热反应与吸热反应
放热反应 | 吸热反应 |
大多数化合反应 所有燃烧反应 酸碱中和反应 金属与酸或水的置换反应 铝热反应 | 大多数分解反应 Ba(OH)2·8H2O与NH4Cl反应 以C、CO、H2为还原剂的氧化还原反应 |
注意
题型一:化学反应的本质与能量变化
【例1】下列说法正确的是( )
A.物质发生化学变化都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.物质变化时若伴有能量变化,则一定是化学变化
D.没有物质的化学变化,也就没有能量的变化
题型二:吸热反应与放热反应的判断
【变2-1】下列变化中属于吸热反应的是( )
①冰融化成水 ②胆矾受热分解 ③浓硫酸加水稀释 ④高锰酸钾分解制取氧气
⑤生石灰与水反应生成熟石灰 ⑥石灰石高温分解 ⑦CO2 + C 2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合 ⑨C + H2O(g) CO + H2
A.②④⑥⑦⑨ B.①②④⑥⑦⑧⑨
C.②③④⑤⑥⑧ D.②④⑥⑦⑧⑨
题型三:吸热反应与放热反应的实验探究
【变3】为了探究化学反应的热效应,某兴趣小组进行了如下实验:
(1)将纯固体物质分别装入有水的锥形瓶里(发生化学反应),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度如图所示。
①若如图1所示,发生的反应(假设没有气体生成)是________(填“放热”或“吸热”)反应,是________(填两种物质的化学式)。
②若如图2所示,发生的反应(假设没有气体生成)是________(填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是________(填序号)。
A.CO还原CuO的反应 B.CaCO3的分解反应 C.Al和Fe2O3的反应
(2)如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放几小块镁片,再滴入稀盐酸。试回答下列问题:
①实验中观察到的现象是:镁片逐渐溶解、有大量气泡产生、________________________________。
②产生上述现象的原因是____________________________________。
一、从化学键的角度分析化学反应的能量变化
1.键能:断开(形成)1 mol某化学键所吸收(放出)的能量叫键能。单位:kJ/mol。
例如,断开(形成)1 mol H-H键吸收(放出)的能量为436.0 kJ,那么H-H键的键能是436.0 kJ/mol 。
2.化学键的断裂和形成是化学反应中能量变化的主要原因:
(1)若吸收能量E1>释放能量E2,该反应为吸热反应;
(2)若吸收能量E1<释放能量E2,该反应为放热反应。
3.实例
化学键 | H﹣H | Cl﹣Cl | H﹣Cl |
键能kJ/mol | 436 | 243 | 431 |
从键能角度分析H2 +Cl2 2HCl 反应体系中能量变化情况。
1 mol H2与1 mol Cl2反应生成2 mol HCl分子的过程中, 了 kJ的能量。
及时小练
二、从总能量的角度分析化学反应的能量变化
1.一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
(1)若反应物总能量E反>生成物总能量E生,该反应为放热反应;
(2)若反应物总能量E反<生成物总能量E生,该反应为吸热反应。
E反 ___ E生 ,______ 反应 E反 ___ E生 ,______ 反应
2.吸热反应与放热反应的真实能量变化图:
E吸 < E放,放热反应 | E吸 > E放,吸热反应 |
资料卡片——能量与稳定性
题型四:能量变化图
【例4】已知反应A + B === C + D的能量变化如图所示,下列关于此反应的说法不正确的是( )
A.是吸热反应
B.该反应不符合能量守恒定律
C.生成物的总能量高于反应物的总能量
D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量
题型五:键能的计算
【例5】已知部分键能如下表所示,计算下列三个反应中的能量变化情况。
化学键 | H—H | H—N | N≡N | O=O | C—H | C=O | H—O | P—P | P—O |
键能 (kJ/mol) | 436 | 391 | x | 498 | 414 | 750 | 465 | 198 | 360 |
(1)CH4 + 2O2 CO2 + 2H2O,1 mol CH4完全反应时,_________(填吸收/放出)________ kJ能量。
(2)已知N2 + 3H2 2NH3,消耗1 mol N2 时放出92 kJ的热量,则上表中x的数值为 ________。
(3)如下图为白磷(P4)和P4O6的结构,1mol 白磷完全燃烧,________(填吸收/放出)________kJ能量。
题型六:能量越低越稳定
【变6-2】已知25℃、101 kPa下,含1 mol碳原子的石墨完全燃烧生成CO2放出热量393.51 kJ;含1 mol碳原子的金刚石完全燃烧生成CO2放出395.41 kJ的热量。据此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;石墨比金刚石稳定
B.由石墨制备金刚石是吸热反应;金刚石比石墨稳定
C.由石墨制备金刚石是放热反应;石墨比金刚石稳定
D.由石墨制备金刚石是放热反应;金刚石比石墨稳定
一、人类对能源的利用
1.获取热能的途径——物质的燃烧
(1)早期:以树枝杂草为主要能源。
(2)现代:以煤、石油和天然气为主要能源。
2.面临问题
(1)短期内不可再生,储量有限;
(2)煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等造成大气污染。
3.解决方法
(1)节能减排
(2)开发利用新能源
明辨是非
题型七:能源的利用
【例7】下列叙述不正确的是( )
A.开发氢能、太阳能、风能、生物质能等新能源是践行低碳生活的有效途径
B.火力发电是将燃料中的化学能直接转化为电能的过程
C.利用生物质能就是间接利用太阳能
D.绿色植物进行光合作用时,将太阳能转化为化学能
【变7】氢气是未来的理想能源,理由是( )
①燃烧放热多 ②燃烧时不污染环境
③用于制取H2的水资源丰富 ④密度小,便于运输
A.①②③ B.②③④ C.①③④ D.①②③④
【题1】意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,N4分子结构与白磷(P4)相同,如图所示,已知断裂1mol N—N键吸收167kJ能量,而生成1mol N≡N放出942kJ能量,根据以上信息和数据判断下列说法不正确的是
A.N4中每个N均满足8e—稳定结构
B.N4和N2互为同素异形体
C.N4只含有非极性共价键
D.1molN4完全转化为N2时会释放60kJ能量
【题2】关于能源和能量转化,下列说法正确的是
A.太阳能电池的能量转化:光能→化学能→电能
B.生物光合作用中的能量转化:光能(太阳能)→生物质能(化学能)
C.化学反应过程中,除了物质变化外,可能伴有能量变化
D.燃气灶具中的能量转化:化学能全部转化为热能
【题3】下列反应既是氧化还原反应又是放热反应的是
A.NaOH和HCl反应 B.Zn和HCl反应
C.Ba(OH)2.8H2O和NH4Cl反应 D.C与CO2反应
【题4】下列逻辑关系图示中正确的是
A. | B. | C. | D. |
【题5】将V1mL 1.0 mol•L-1NaOH 溶液和V2mL未知浓度的HCl溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是
A.做该实验时环境温度为 22℃
B.该实验表明热能可以转化为化学能
C.HCl 溶液的浓度约是 1.5 mol•L-1
D.该实验表明有水生成的反应都是放热反应
【题6】根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况判断,下列说法正确的是
A.N2(g)和O2(g)反应生成NO(g)是放热反应
B.2 mol O原子结合生成O2(g)时需要吸收498 kJ能量
C.1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量
D.2 mol N(g)和2 mol O(g)的总能量为1444 kJ
【题7】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是
A.该反应是化合反应
B.催化剂参加了化学反应过程
C.CH4→CH3COOH过程中,有C—H键的断裂和形成
D.①→②过程中,形成了C—C键,断裂的化学键的总键能<形成的化学键的总键能
【题8】已知:H﹣H的键能为436kJ/mol,N﹣H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为 _______kJ/mol。
【题9】为了探究化学能与热能的转化,某实验小组设计了如下图所示的三套实验装置:
(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是________(填装置序号)。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了Ba(OH)2溶液与稀硫酸,U形管中可观察到的现象是_________________________________。说明该反应属于________(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在丙试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_________________。
②若观察到烧杯中产生气泡,则说明M溶于水________(填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是_________________________________________。
(4)至少有两种实验方法能验证超氧化钾与水的反应(4KO2+2H2O===4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择装置________(填装置序号)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到脱脂棉燃烧,则说明该反应是________(填“吸热”或“放热”)反应。
【题10】化学反应过程中伴随着能量变化,请回答下列问题:
(1)下列反应中,属于放热反应的是___________(填序号,下同),属于吸热反应的是___________。
①物质燃烧 ②二氧化碳通过炽热的碳 ③生石灰溶于水的过程 ④炸药爆炸 ⑤碳酸钙高温分解
(2)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。
实验发现,反应后①中的温度升高,②中的温度降低。由此判断铝条与盐酸的反应是___________反应(填“放出”或“吸收”,下同),Ba(OH)2·8H2O与NH4Cl的反应是___________反应。反应___________(填①或②)的能量变化可用图(b)表示。
(3)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1___________(填大于、小于或等于)Q2。
(4)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。
图中所示反应是___________(填“吸热”或“放热”)反应。
(5)已知拆开1molH-H键、1molI-I键、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则反应掉1mol氢气和1mol碘,生成HI会___________(填“放出”或“吸收”)___________kJ的热量。
(6)已知:4HCl+O2=2Cl2+2H2O,该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为___________ kJ。
【练1】下列说法错误的是( )
A.化学反应放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量的相对大小
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.需要加热才能发生的化学反应一定是吸热反应
D.反应物的总能量高于生成物的总能量时,发生放热反应
【练2】如图所示,有关化学反应和能量变化的说法正确的是( )
A.图a表示的是吸热反应的能量变化
B.图b中生成物比反应物稳定
C.图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
D.图a不需要加热就一定能发生,图b一定需要加热才能发生
【练3】“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是( )
A.煤炭、石油、潮汐能 B.水能、生物质能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能
【练4】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂 1 mol N—N键吸收193 kJ热量,断裂 1 mol N≡N键吸收941 kJ热量,则下列说法不正确的是( )
A.N4与N2互为同素异形体
B.1 mol N4气体转化为N2时要放出724 kJ能量
C.N4变成N2是化学变化
D.2 mol N2的能量比1 mol N4的能量高
【练5】下列反应中旧化学键断裂吸收的总能量大于新化学键形成放出总能量的是( )
A.电解水制取H2和O2 B.甲烷燃烧
C.铝粉与氧化铁粉末反应 D.铁与稀盐酸反应
【练6】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O形成了具有极性共价键的CO2
D.状态Ⅰ → 状态Ⅲ 表示CO与O2反应的过程
【练7】化学反应A2 + B2 === 2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂1 mol A—A键和1 mol B—B键能放出x kJ能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
【练8】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是_________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是__________________________________,说明该反应属于_______(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是______________________________________________
______________________________________________;
②若观察到烧杯里产生气泡,则说明M溶于水_________________________(填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是_________________________________________________
______________________________________________。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2 + 2H2O === 4KOH + 3O2↑)是放热反应。
方法①:选择上述装置_________________(填“Ⅰ”、“Ⅱ”或“Ⅲ”)进行实验。
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到_________________,则说明该反应是放热反应。
化学人教版 (2019)第一节 化学反应与能量变化备课课件ppt: 这是一份化学人教版 (2019)第一节 化学反应与能量变化备课课件ppt,共52页。PPT课件主要包含了新课情景呈现,课前素能奠基,木片黏在烧杯上,放出热量,吸收热量,热量的释放和吸收,释放热量,吸收能量,放出能量,课堂素能探究等内容,欢迎下载使用。
必修 第二册第六章 化学反应与能量第二节 化学反应的速率与限度一等奖课件ppt: 这是一份必修 第二册第六章 化学反应与能量第二节 化学反应的速率与限度一等奖课件ppt,文件包含高中化学新教材同步必修第一册第14讲化学反应的速率与限度二化学反应的限度教师版docx、高中化学新教材同步必修第一册第14讲化学反应的速率与限度二化学反应的限度学生版docx、高中化学新教材同步必修第二册第14讲化学反应的速率与限度二化学反应的限度PPT课件pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
化学必修 第二册第二节 化学反应的速率与限度精品ppt课件: 这是一份化学必修 第二册第二节 化学反应的速率与限度精品ppt课件,文件包含高中化学新教材同步必修第一册第13讲化学反应的速率与限度一化学反应速率教师版docx、高中化学新教材同步必修第一册第13讲化学反应的速率与限度一化学反应速率学生版docx、高中化学新教材同步必修第二册第13讲化学反应的速率与限度一化学反应速率PPT课件pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













