






高中化学人教版 (2019)选择性必修1第一节 电离平衡备课课件ppt
展开1.通过预习回顾电解质、非电解质的概念,以此概念为标准对常见物质进行分类。2.通过实验探究、合作交流,理解强、弱电解质的概念。3.学会书写常见电解质的电离方程式。
醋酸的腐蚀性比盐酸小,比较安全,为什么不用醋酸代替盐酸呢?
盐酸和醋酸是生活中经常用到的酸。盐酸常用于卫生洁具的清洁,比如某些洁厕灵有效成分是盐酸。
【实验探究1】常温时,测定0.1 ml/L 盐酸、0.1 ml/L 醋酸的pH。
问题一:为什么相同浓度的盐酸和醋酸溶液PH值会不一样呢?
资料卡片:pH= - lgC(H+)pH=1 C(H+) =0.1ml/L pH=3 C(H+) =0.001ml/L
0.1 ml/L 盐酸 > 0.1 ml/L 醋酸
【实验探究2】用灯泡的亮度来检测0.1 ml/L 盐酸、0.1 ml/L 醋酸的导电性。
问题二:同学们通过观察到的这个实验现象可以想到什么呢?
等体积、浓度均为0.1 ml/L的盐酸和醋酸溶液分别跟等量镁条的反应
问题三:请同学们思考一下,为什么在相同条件下的两种酸,与等量镁条反应,一个慢而另一个快呢? 原理是什么呢?
我们通过实验对等体积、浓度均为0.1 ml/L的盐酸和醋酸溶液测其pH值、试验其导电能力,并将其分别跟等量镁条的反应。实验结果如下表。
剧烈反应,迅速产生大量气泡
反应缓慢,产生少量气泡
浓度均为0.1 ml/L 的盐酸与醋酸两种溶液中 H+浓度不同,即HCl和CH3COOH的电离程度不同。
HCl=H++Cl- 全部电离
知识精讲——强电解质和弱电解质
HCl在水中电离示意图 CH3COOH在水中电离示意图
H3O+ CH3COO- CH3COOH
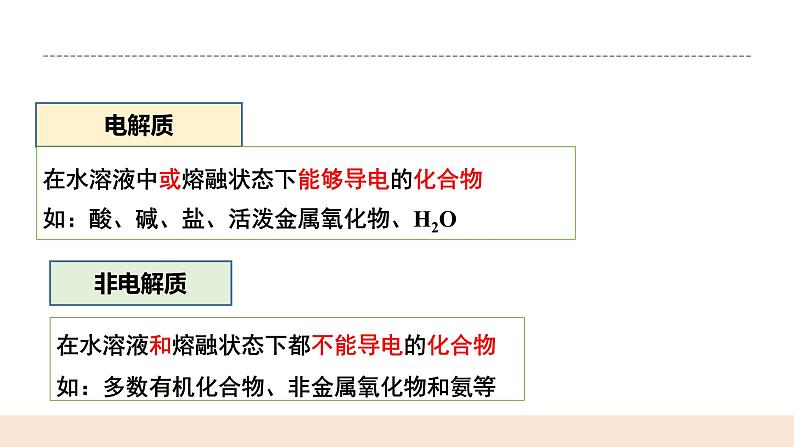
类别:强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4 强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2 大部分盐:(包括难溶盐)NaCl、NH4Cl、Fe(NO3)3、BaSO4等 活泼金属氧化物:Na2O等
特点:完全电离,只有离子,无分子,不可逆, 电离方程式用“=”连接
类别:弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3、 CH3COOH等 弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等 H2O是极弱电解质 注意:少数盐也是弱电解质(醋酸铅、HgCl2等)
【例1】下列物质能导电的是 ,属于强电解质的是______, 属于弱电解质的是_____,属于非电解质的是_______。 a.铜丝 b.NaCl c.石墨 d.冰醋酸 e.HCl的水溶液 f.蔗糖 g.SO2 h.NaHCO3 i. BaSO4 j.氨水
【例2】在下列性质中,可以证明CH3COOH是弱电解质的是( ) A.CH3COOH与水以任意比互溶 B. 10 mL 1 ml/L的醋酸恰好与10 mL 1 ml/L的NaOH溶液 完全反应 C.醋酸的导电性比盐酸弱 D.1 ml/L的醋酸中,c(H+)=0.001 ml/L
知识精讲——电离方程式的书写
(1)强电解质用等号,弱电解质用可逆号。
H2SO4 = 2H+ + SO42-
(2)多元弱酸的电离分步完成, 并以第一步电离为主。
(3)多元弱碱的电离认为一步完成。
(4)强酸酸式盐的电离:NaHSO4=Na++H++SO42- (水溶液中) NaHSO4=Na++HSO4-(熔融状态)
(5)弱酸酸式盐的电离:NaHCO3= Na++HCO3-
【例3】请写出H2SO4、NH3·H2O 、H2CO3、Al(OH)3、 Ba(OH)2在水溶液中的电离方程式。
H2SO4=2H++SO42-
Ba(OH)2=Ba2++2OH-
都是电解质,在水溶液和熔融状态下均能电离
强酸、强碱、大多数盐、活泼金属氧化物
(1)氯化钾溶液在电流作用下电离成钾离子和氯离子。( )(2)二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质。( )(3)碳酸钡难溶于水,所以碳酸钡属于弱电解质。( )(4)纯净的强电解质在液态时,有的导电有的不导电。( )
1.判断正误(正确的打“√”,错误的打“×”)
作业:1.梳理强电解质和弱电解质相关笔记。 2.完成课后练习题。
高中化学人教版 (2019)选择性必修1第一节 电离平衡精品课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡精品课件ppt,文件包含311强电解质和弱电解质弱电解质的电离平衡练习解析版docx、311强电解质和弱电解质弱电解质的电离平衡练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
人教版 (2019)第一节 电离平衡评优课课件ppt: 这是一份人教版 (2019)第一节 电离平衡评优课课件ppt,文件包含人教版高中化学选择性必修一311《强电解质和弱电解质弱电解质的电离平衡》课件pptx、人教版高中化学选择性必修一311《强电解质和弱电解质弱电解质的电离平衡》学案docx等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
人教版 (2019)选择性必修1第一节 电离平衡备课课件ppt: 这是一份人教版 (2019)选择性必修1第一节 电离平衡备课课件ppt,文件包含311强电解质和弱电解质教学课件高二化学同步备课系列人教版2019选择性必修1pptx、311强电解质和弱电解质分层作业解析版--上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、311强电解质和弱电解质分层作业原卷版--上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。













