











所属成套资源:高中化学新教材同步选择性必修第1册课件PPT+讲义(教师版+学生版)
高中化学人教版 (2019)选择性必修1第三节 金属的腐蚀与防护公开课课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修1第三节 金属的腐蚀与防护公开课课件ppt,文件包含高中化学新教材同步选择性必修第1册第28讲金属的腐蚀与防护教师版docx、高中化学新教材同步选择性必修第1册第28讲金属的腐蚀与防护学生版docx、高中化学新教材同步选择性必修第1册第28讲金属的腐蚀与防护PPT课件pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
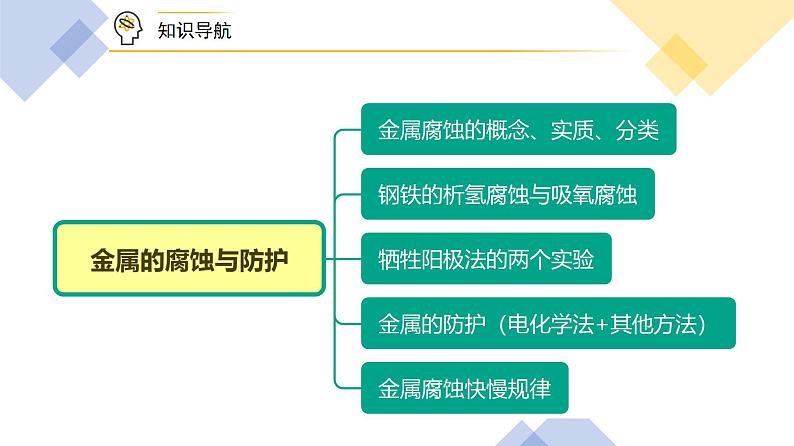
高中化学新教材特点分析及教学策略(一)化学基本概念和化学基本理论:全套教材的知识安排,注意各年级内及各年级间的联系,在保证知识结构的系统性和完整性的同时,对内容的安排采用了将各部分知识分散处理,相对集中的方法。(二)元素化合物知识:关于元素化合物知识,高一教材首先介绍了碱金属和卤素两个最典型的金属族和非金属族。(三)化工基础知识:高一介绍了硅酸盐工业和环境保护知识。高二主要介绍合成氨工业,删掉了硝酸工业、钢铁工业和铝的冶炼。重点突出了合成氨工业中合成氨条件的选择。 一、金属的腐蚀1.概念:金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。2.实质:金属失电子变成阳离子,被氧化,其反应为:M - ne- === Mn+(M为金属元素)。杨sir化学,侵权必究3.分类: 分类化学腐蚀电化学腐蚀条件金属与其表面接触的一些物质(如O2、Cl2、SO2等)直接反应不纯的金属或合金与电解质溶液接触,形成原电池现象无电流产生有微弱电流产生本质金属被氧化较活泼的金属被氧化联系化学腐蚀和电化学腐蚀往往同时发生,但电化学腐蚀更普遍,速率更快 二、钢铁的析氢腐蚀与吸氧腐蚀 析氢腐蚀吸氧腐蚀图示条件水膜呈较强酸性(pH≤4.3)水膜呈弱酸性、中性或碱性负极反应 正极反应 总反应式 其他反应Fe2+ + 2OH- === Fe(OH)2↓4Fe(OH)2 + 2H2O + O2 === 4Fe(OH)32Fe(OH)3 === Fe2O3·xH2O + (3﹣x)H2O联系通常两种腐蚀同时存在,但吸氧腐蚀更普遍 实验探究——铁钉的吸氧腐蚀杨sir化学,侵权必究实验操作实验现象实验解释 实验操作实验现象实验解释导管中液面上升装置中铁、碳和饱和食盐水构成原电池,铁钉发生吸氧腐蚀,导致压强变小 两只试管均冒出气泡,且①试管中产生气泡的速率更快Zn置换出Cu,Zn、Cu、稀盐酸构成原电池,形成电化学腐蚀,能加快反应速率 实验探究——牺牲阳极法实验实验操作如图装置反应一段时间后,从Fe电极区取少量溶液于试管中,再向试管中滴入2滴黄色的K3[Fe(CN)6](铁氰化钾)溶液。已知3Fe2+ + 2 [Fe(CN)6]3- ==== Fe3[Fe(CN)6]2↓(带有特征蓝色) 电流表阳极(负极区)阴极(正极区)现象指针偏转锌片逐渐溶解有气泡产生,无蓝色沉淀生成有关反应—Zn-2e-===Zn2+2H++2e-===H2↑结论溶液中不含Fe2+,铁作正极时,并未被腐蚀实验操作培养皿中加入含NaCl的琼脂液,并滴入5~6滴酚酞和K3[Fe(CN)6]溶液,取两个2~3 cm的铁钉,用砂纸擦光放入培养皿中。裹有锌皮的铁钉(a)缠有铜丝的铁钉(b)现象(a)锌片逐渐溶解,铁钉附近变红 (b)铁钉逐渐溶解,附近产生蓝色沉淀,铜丝附近变红 结论(a)铁作正极,不反应,被保护(b)铁作负极,发生氧化反应,被腐蚀 三、金属的防护1.电化学防护法杨sir化学,侵权必究 牺牲阳极的阴极保护法外加电流的阴极保护法图示原理________原理________原理电极要求被保护的金属作______极,活泼性更强的金属作______极被保护的金属作为_____极,与电源的____极相连应用锅炉内壁、船舶外壳安装镁合金或锌块钢铁闸门,地下管道连接电源负极 2.其他保护方法(1)改变金属组成和结构把金属制成防腐的合金,如含铬、镍、硅等合金元素的不锈钢具有很好的抗腐蚀性能。(2)金属表面覆盖保护层在金属表面覆盖致密的保护层,如喷油漆、涂油脂、镀抗腐蚀金属等。杨sir化学,侵权必究 四、金属腐蚀快慢规律同一金属在相同电解质溶液中,腐蚀快慢如下: 题型一:金属的化学腐蚀与电化学腐蚀杨sir化学,侵权必究【变1】以下现象与电化学腐蚀无关的是A.生铁比纯铁容易生锈B.银质物品久置表面变暗C.铁质器件附有铜质配件,在接触处易生铁锈D.黄铜(铜锌合金)制作的铜锣不易产生铜绿 题型二:析氢腐蚀与吸氧腐蚀杨sir化学,侵权必究【变2-1】利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间,下列说法不正确的是A.a管发生吸氧腐蚀,b管发生析氢腐蚀 B.一段时间后,a管液面高于b管液面C.a、b处溶液的pH增大 D.a、b两处具有相同的电极反应式:Fe-3e-=Fe3+ 【变2-3】如图,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。实验观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀C.墨水回升时,碳电极反应式为O2+2H2O+4e-=4OH-D.具支试管中溶液酸性增强 【变2-4】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。回答下列问题:(1)液滴边缘是_______(填“正”或“负”)极区,发生的电极反应为____________________________ 。(2)液滴中的Cl-由_______区向_______区迁移(填“b”或“a”)。(3)在b区出现铁锈环的原因是液滴下的Fe因发生氧化反应而被腐蚀,生成的Fe2+ _____________________进一步氧化、脱水形成铁锈。杨sir化学,侵权必究(4)若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为 ___________________________。 题型三:金属的防护杨sir化学,侵权必究【变3-1】电化学保护法是常用的金属防腐的手段,在题图所示的情境中,下列有关说法正确的是A.图1正极的电极反应式为B.图1中钢铁的活动性比金属M的活动性强C.图2高硅铸铁的作用是作为损耗阳极材料和传递电流D.图2防止金属腐蚀的方法叫做阴极电保护法杨sir化学,侵权必究 题型四:金属的腐蚀与防护综合杨sir化学,侵权必究【例4】铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
序号内容实验现象1常温下将铁钉放在潮湿空气中一小时铁钉表面依然光亮2常温下将铁钉放在潮湿的空气中一个月铁钉表面已变得灰暗3常温下将铁钉放在干燥空气中一个月干燥的铁钉表面依然光亮4将潮湿的铁钉放在常温的氧气流中一小时铁钉表面略显灰暗5将潮湿的铁钉放在高于常温的氧气流中一小时铁钉表面已变得灰暗6将铁钉放在燃煤的厨房中一个月铁钉表面已变得灰暗7将浸过氯化钠溶液的铁钉放在高于常温的氧气流中一小时铁钉表面灰暗程度比实验5严重(1)上述实验中发生了吸氧腐蚀的是___________(根据实验现象填序号,下同),正极反应式是___________;(2)发生的腐蚀是析氢腐蚀的是___________(填序号)负极反应式是___________。(3)由该实验可知,可以影响铁锈蚀速率的因素有_____(填两项);(4)为防止铁的锈蚀,地下埋的水管可采用外加电流的阴极保护法,请列举工业上普遍采用的其它方法是___________(答两种方法)。 【例5】如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:(1)若两装置中均为溶液,反应一段时间后:①有红色物质析出的是甲装置中的___________棒,乙装置中的___________棒;②乙装置的电化学防护法称为___________,其中碳极的电极反应式是:___________。③取少量甲装置中负极附近溶液加入2滴溶液,现象为___________,生成沉淀的化学式为___________。(2)若两装置中均为饱和溶液:①写出乙装置中总反应的离子方程式:___________。
②将湿润的淀粉试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因___________(3)用铂作电极电解饱和的下列物质的水溶液,一会儿后,向剩余电解液中加适量水,能使溶液和电解前相同的是___________。A. B. C. D.杨sir化学,侵权必究 【例7】研究金属腐蚀和防护的原理很有现实意义。(1)图甲为探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置进行实验,发现导管中水柱上升缓慢,下列措施可以更快、更清晰地观察到水柱上升现象的有_______(填序号)。A.用纯氧气代替具支试管内空气B.用酒精灯加热具支试管提高温度C.将铁钉换成铁粉和碳粉混合粉末并加入少许食盐水杨sir化学,侵权必究D.将玻璃导管换成更细的导管,水中滴加红墨水(2)该小组将图甲装置改进成图乙装置并进行实验,导管中红墨水液柱高度随时间的变化如表所示,根据数据可判断腐蚀的速率随时间变化逐渐_______(填“加快”“减慢”或“不变”),你认为影响钢铁腐蚀的因素为_______。时间/min13579液柱高度/cm0.82.13.03.74.2 (3)为探究图乙中a、b两点所发生的反应,进行以下实验,请完成表中空白:实验操作实验现象实验结论向NaCl溶液中滴加2~3滴酚酞溶液a点附近溶液出现红色a点电极反应为_______一段时间后再滴加2~3滴铁氰化钾溶液b点周围出现蓝色沉淀b点电极反应为Fe-2e-=Fe2+(4)设计图丙装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化如图丁所示,从图丁中可分析,t1~t2s之间主要发生_______(填“吸氧”或“析氢”)腐蚀,原因是_______。
(5)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应_______。 【题1】某地下了一场酸雨,在这种环境中的铁制品极易被腐蚀。对该条件下铁制品发生电化学腐蚀的叙述正确的是A.该电化学腐蚀是析氢腐蚀 B.正极反应式:C.原电池反应减缓了铁制品的腐蚀 D.负极反应式: 【题2】研究小组将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入醋酸溶液,容器中的压强随时间的变化曲线如图2。下列说法不正确的是A.0-t1时压强增大的原因不一定是铁发生了析氢腐蚀B.铁粉发生反应:Fe-3e-=Fe3+C.碳粉上发生了还原反应D.t2时,容器中压强明显小于起始压强,原因是铁发生了吸氧腐蚀 【题3】下列事实不能用原电池原理解释的是A.白铁(镀锌)制品比一般铁器耐腐蚀
B.铁片、铝片在冷的浓硫酸中钝化C.工程施工队在铁制水管外刷一层“银粉”杨sir化学,侵权必究D.纯锌与稀硫酸反应时,滴入少量溶液后反应速率加快 【题5】深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(一种厌氧微生物,适宜pH为7~8)的作用下,能被硫酸根离子腐蚀,原理如图。下列有关说法正确的是A.腐蚀过程中,土壤酸性逐渐增强B.输送暖气铁管道温度越高,越易发生此类腐蚀C.正极反应为杨sir化学,侵权必究D.管道壁镶嵌锌块或锡块都可保护管道不易被腐蚀 【题7】2018年7月至9月,国家文物局在辽宁开展水下考古,搜寻、发现并确认了甲午海战北洋水师沉舰——经远舰。已知:正常海水呈弱碱性。(1)经远舰在海底“沉睡”124年后,钢铁制成的舰体腐蚀严重。舰体发生电化学腐蚀时,负极的电极反应式为_______。(2)为了保护文物,考古队员采用“牺牲阳极的阴极保护法”对舰船进行了处理。①下列说法不正确的是________。A.锌块发生氧化反应:Zn-2e-=Zn2+B.舰体有电子流入,可以有效减缓腐蚀杨sir化学,侵权必究C.若通过外加电源保护舰体,应将舰体与电源正极相连D.地下钢铁管道用导线连接锌块与该种舰体保护法原理相同②采用“牺牲阳极的阴极保护法”后,舰体上正极的电极反应式为_________。(3)船上有些器皿是铜制品,表面有铜锈。
①据了解铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。下列说法正确的是________A.疏松的Cu2(OH)3Cl属于有害锈B.Cu2(OH)2CO3既能溶于盐酸也能溶于氢氧化钠溶液C.青铜器表面涂一层食盐水可以做保护层D.用HNO3溶液除锈可以保护青铜器的艺术价值,做到“修旧如旧”②文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,可以使CuCl转化为难溶的Cu2(OH)2CO3反应的离子方程式为______。(4)考古队员将舰船上的部分文物打捞出水后,采取脱盐、干燥等措施保护文物。从电化学原理的角度分析“脱盐、干燥”的防腐原理:________。 【练1】下列关于金属腐蚀的说法错误的是A.河水中的钢闸门连接电源的负极,使用的是外加电流的阴极保护法B.金属腐蚀的实质就是金属原子失去电子被氧化的过程C.镀锌铁皮(白铁皮)的镀层破损后铁皮仍耐腐蚀D.钢铁在潮湿的空气中生锈,主要发生了析氢腐蚀 【练2】锥形瓶内壁用某溶液润洗后,放入混合均匀的新制铁粉和碳粉,塞紧瓶塞,同时测量锥形瓶内压强的变化,如图所示。下列说法错误的是A.0~t1时,铁可能发生了析氢腐蚀B.t1~t2时,铁一定发生了吸氧腐蚀C.负极反应为:Fe-3e-=Fe3+
D.用于润洗锥形瓶的溶液一定显酸性 【练3】一定条件下,碳钢腐蚀与溶液pH的关系如下:pH2466.5813.514腐蚀快慢较快慢较快主要产物Fe2+Fe3O4Fe2O3FeO下列说法不正确的是A.在pH<4的溶液中,碳钢腐蚀的负极反应式为Fe-2e-=Fe2+B.在pH>6的溶液中,碳钢主要发生吸氧腐蚀C.在pH>14的溶液中,碳钢腐蚀的正极反应式为O2+4OH-+4e-=2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢杨sir化学,侵权必究 【练4】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和稀醋酸溶液,各加入生铁块,放置一段时间,下列有关描述错误的是A.生铁块中的碳是原电池的正极B.红墨水柱两边的液面为左低右高C.两试管中相同的电极反应式是: Fe- 2e-=Fe2+D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 【练5】下列不能有效防止钢铁锈蚀的措施是A.将钢铁与锌板相连 B.将钢铁置于潮湿的空气中C.在钢铁表面喷油漆 D.将钢铁与直流电源负极相连 【练6】下列关于电化学腐蚀及防护的说法不正确的是A.“牺牲阳极的阴极保护法”就是将被保护的钢铁设备连接到外接直流电源的负极杨sir化学,侵权必究B.白铁皮是在薄钢板表面镀锌,即便镀层破损,仍然可以保护钢板不被腐蚀C.在钢铁制品表面喷漆、涂油、镀铬或覆盖搪瓷、塑料都可以避免钢铁腐蚀D.钢铁表面吸附的溶有氧气的水膜酸性很弱时,仍然以吸氧腐蚀为主 【练7】如图, 水槽中试管内有一枚铁钉,放置数天观察:
(1)若液面上升,则溶液呈______性,发生______腐蚀,电极反应式为:负极:______________,正极:___________________。(2)若液面下降,则溶液呈________性,发生_________腐蚀,电极反应式为:负极:______________;正极:__________________。 【练8】金属腐蚀的电化学原理可用下图模拟。请写出有关电极反应式:①铁棒上的电极反应式:_______________________碳棒上的电极反应式:_________________________(2)该图所表示的是_________________________(填“析氢”或“吸氧”)腐蚀。(3)若将O2撤走,并将NaCl溶液改为稀H2SO4溶液,则此图可表示__________(填“析氢”或“吸氧”)腐蚀原理;若用牺牲阳极法来保护铁棒不被腐蚀溶解,即可将碳棒改为_________棒。杨sir化学,侵权必究 【练9】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。I.如图装置中,U 形管内为红墨水,a、b 试管内分别盛有氯化铵(显酸性)溶液和食盐水,各加入生铁块,放置一段时间均被腐蚀,这两种腐蚀都属于____腐蚀。(1)红墨水柱两边的液面变为左低右高,则_____(填“a”或“b”)边盛有食盐水。(2)b 试管中铁发生的是_____腐蚀。II.下面两个图都是金属防护的例子。
(3)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R 可以采用_______(从下面选项中选择),此方法叫做_____保护法。 A.铜 B.钠 C.锌 D.石墨(4)图乙方案也可以降低铁闸门腐蚀的速率,其中铁闸门应该连接在直流电源的______极。(5)采取以上两种方法,_________(填“甲”或“乙”)种能使铁闸门保护得更好。杨sir化学,侵权必究
相关课件
这是一份化学选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解公开课课件ppt,文件包含高中化学新教材同步选择性必修第1册第19讲盐类的水解一PPT课件pptx、高中化学新教材同步选择性必修第1册第19讲盐类的水解一教师版docx、高中化学新教材同步选择性必修第1册第19讲盐类的水解一学生版docx等3份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第四节 化学反应的调控精品ppt课件,文件包含高中化学新教材同步选择性必修第1册第12讲化学反应的调控教师版docx、高中化学新教材同步选择性必修第1册第12讲化学反应的调控学生版docx、高中化学新教材同步选择性必修第1册第12讲化学反应的调控PPT课件pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份人教版 (2019)选择性必修1第三节 化学反应的方向精品课件ppt,文件包含高中化学新教材同步选择性必修第1册第11讲化学反应的方向教师版docx、高中化学新教材同步选择性必修第1册第11讲化学反应的方向学生版docx、高中化学新教材同步选择性必修第1册第11讲化学反应的方向PPT课件+pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。










