


所属成套资源:【高考三轮冲刺】2024年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版)
- 必刷题06 元素周期表与元素周期律——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版) 试卷 4 次下载
- 必刷题07 化学反应机理——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版) 试卷 5 次下载
- 必刷题09 有机化学基础知识——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版) 试卷 4 次下载
- 必刷题10 原电池工作原理的应用——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版) 试卷 4 次下载
- 必刷题11 电解池工作原理的应用——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版) 试卷 4 次下载
必刷题08 化学反应的速率与限度——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版)
展开
这是一份必刷题08 化学反应的速率与限度——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版),文件包含必刷题08化学反应的速率与限度高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷解析版docx、必刷题08化学反应的速率与限度高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷原卷版docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。
2023高考化学考前名校必杀题(全国卷)
选择题基础必杀
必杀08 化学反应的速率与限度(20题)
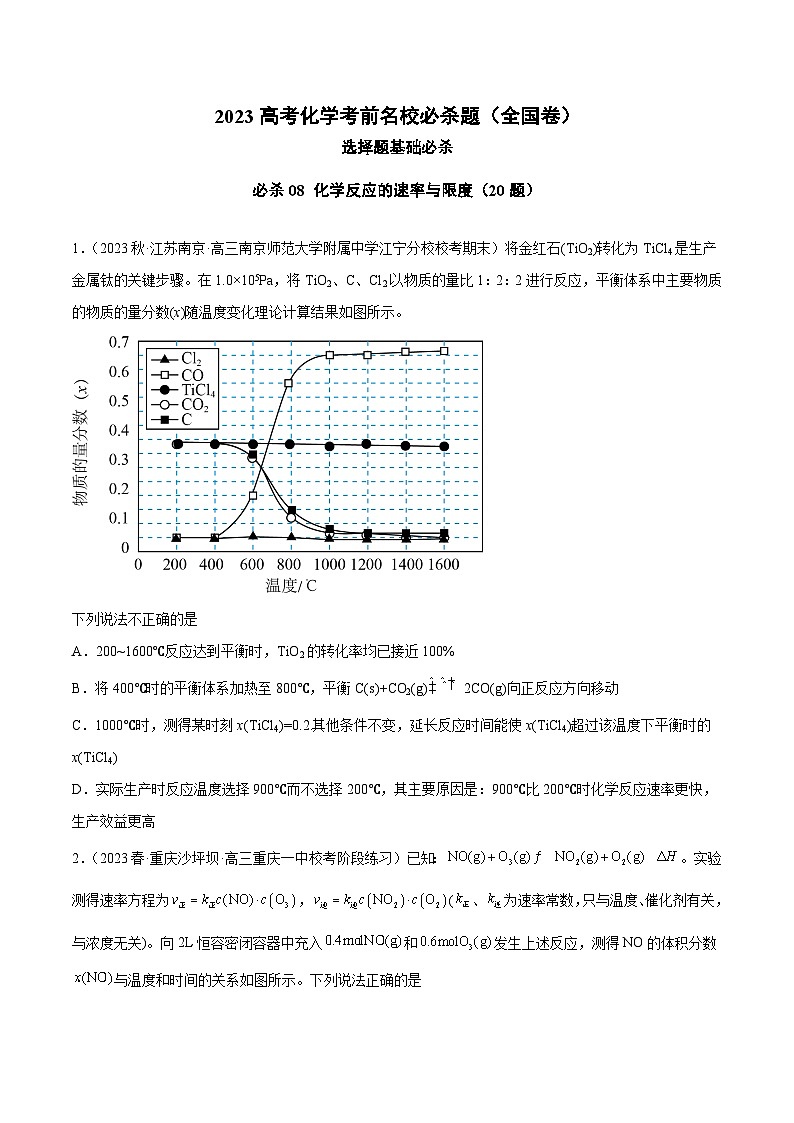
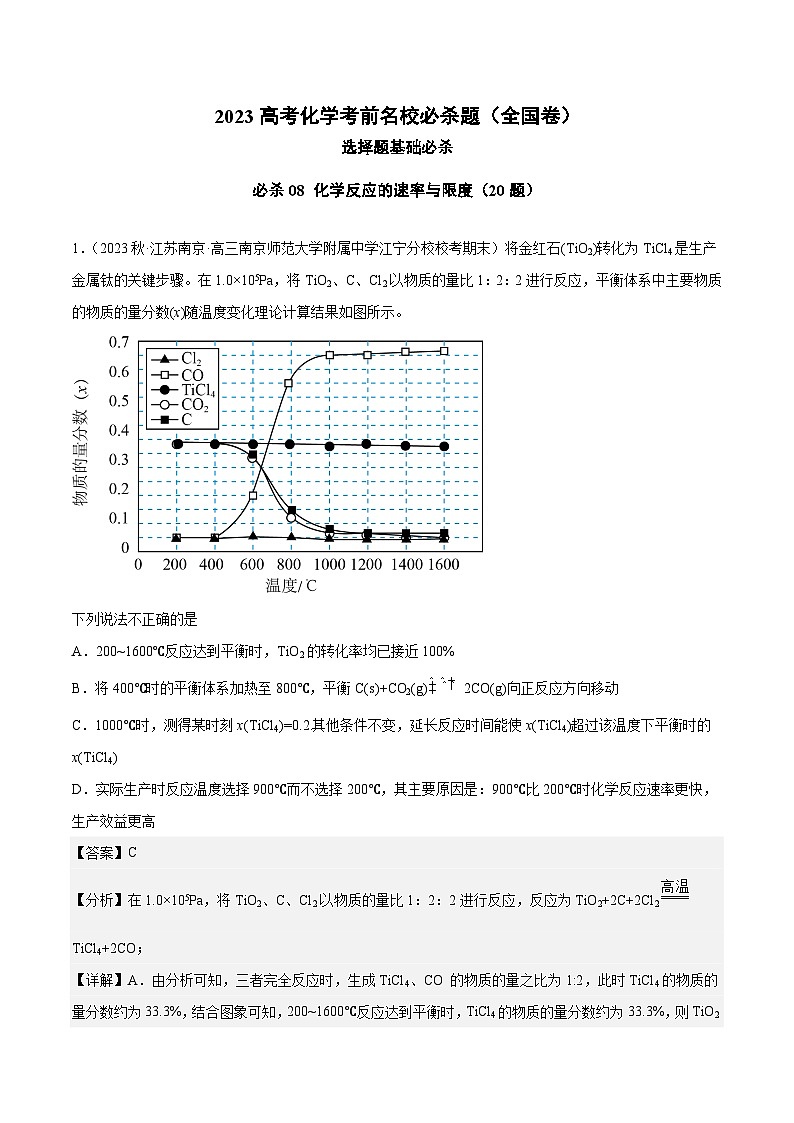
1.(2023秋·江苏南京·高三南京师范大学附属中学江宁分校校考期末)将金红石(TiO2)转化为TiCl4是生产金属钛的关键步骤。在1.0×105Pa,将TiO2、C、Cl2以物质的量比1:2:2进行反应,平衡体系中主要物质的物质的量分数(x)随温度变化理论计算结果如图所示。
下列说法不正确的是
A.200~1600℃反应达到平衡时,TiO2的转化率均已接近100%
B.将400℃时的平衡体系加热至800℃,平衡C(s)+CO2(g)2CO(g)向正反应方向移动
C.1000℃时,测得某时刻x(TiCl4)=0.2.其他条件不变,延长反应时间能使x(TiCl4)超过该温度下平衡时的x(TiCl4)
D.实际生产时反应温度选择900℃而不选择200℃,其主要原因是:900℃比200℃时化学反应速率更快,生产效益更高
【答案】C
【分析】在1.0×105Pa,将TiO2、C、Cl2以物质的量比1:2:2进行反应,反应为TiO2+2C+2Cl2TiCl4+2CO;
【详解】A.由分析可知,三者完全反应时,生成TiCl4、CO 的物质的量之比为1:2,此时TiCl4的物质的量分数约为33.3%,结合图象可知,200~1600℃反应达到平衡时,TiCl4的物质的量分数约为33.3%,则TiO2转化率均已接近100%,A正确;
B.结合图象可知,将400℃时的平衡体系加热至800℃,二氧化碳含量减小、一氧化碳含量增加,则平衡C(s)+CO2(g)2CO(g)向正反应方向移动,B正确;
C.延长时间不能改变平衡时物质的转化率和产率,C错误;
D.温度越高反应速率越快,单位时间产率越高,实际生产时反应温度选择900℃而不选择200℃,其主要原因是:900℃比200℃时化学反应速率更快,生产效益更高,D正确;
故选C。
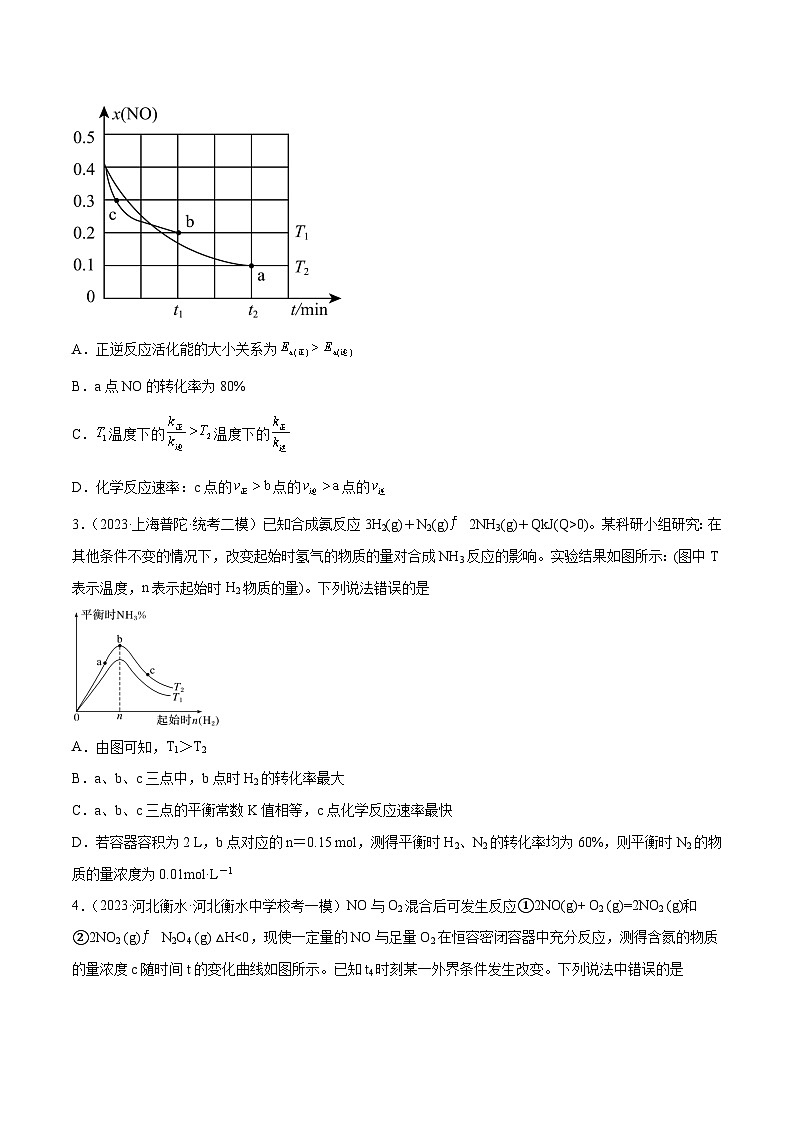
2.(2023春·重庆沙坪坝·高三重庆一中校考阶段练习)已知:。实验测得速率方程为,(、为速率常数,只与温度、催化剂有关,与浓度无关)。向2L恒容密闭容器中充入和发生上述反应,测得NO的体积分数与温度和时间的关系如图所示。下列说法正确的是
A.正逆反应活化能的大小关系为
B.a点NO的转化率为80%
C.温度下的温度下的
D.化学反应速率:c点的点的点的
【答案】D
【详解】根据先拐先平数值大可知,>,温度高的时大,说明升高温度平衡逆向移动,逆反应为吸热反应,正反应为放热反应,△H0)。某科研小组研究:在其他条件不变的情况下,改变起始时氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)。下列说法错误的是
A.由图可知,T1>T2
B.a、b、c三点中,b点时H2的转化率最大
C.a、b、c三点的平衡常数K值相等,c点化学反应速率最快
D.若容器容积为2 L,b点对应的n=0.15 mol,测得平衡时H2、N2的转化率均为60%,则平衡时N2的物质的量浓度为0.01mol·L-1
【答案】B
【详解】A.由图可知,n(H2)相同时,温度T2对应氨气含量高,反应为放热反应,降低温度有利于生成氨气,则T1>T2,A正确;
B.a、b、c三点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大,H2的转化率却越小,a点时氢气的物质的量最小,a点H2的转化率最高,B错误;
C.温度不变化学平衡常数不变,故a、b、c三点的平衡常数K值相等,c点时H2起始的物质的量浓度最大,化学反应速率最快,C正确;
D.b点时,初始加入n(H2)=0.15mol,n(N2)为xmol,平衡时H2和N2的转化率均为60%,则转化的氢气为0.09mol,则:,则×100%=60%,则x=0.05mol,则平衡时N2的物质的量浓度为=0.01 mol•L-1,D正确;
故答案为:B。
4.(2023·河北衡水·河北衡水中学校考一模)NO与O2混合后可发生反应①2NO(g)+ O2 (g)=2NO2 (g)和②2NO2 (g)N2O4 (g) △HK(t4)=K(t1), D正确;
答案选C。
5.(2023秋·辽宁丹东·高三统考期末)一定温度下,在两个容积均为1L的密闭容器中,充入一定量的反应物,发生反应: 。相关反应数据如下表所示:
容器编号
温度/℃
起始物质的量/mol
10s时物质的量/mol
NO
CO
Ⅰ
0.2
0.2
0.05
Ⅱ
0.2
0.2
0.05
下列说法正确的是A.前10s,容器Ⅰ中的化学反应速率
B.该反应在任何温度下均能自发进行
C.10s时,容器Ⅰ中的反应一定处于平衡状态
D.若向容器Ⅱ中再充入0.08mol NO和,反应将向正反应方向进行
【答案】D
【详解】A.根据反应方程式,该时间段内,生成二氧化碳物质的量为2×0.05mol=0.1mol,依据反应速率,v(CO2)==0.01mol/(L·s),故A错误;
B.该反应为放热反应,根据反应方程式,该反应为气体物质的量减少的反应,即ΔS<0,根据ΔG=ΔH-TΔS,自发进行,需要ΔG<0,即低温下能自发进行,故B错误;
C.假设容器Ⅰ达到平衡,因为容器Ⅱ的温度高于容器Ⅰ,因此升高温度,平衡向逆反应方向进行,氮气物质的量小于0.05mol,现在是等于0.05mol,说明容器Ⅰ没有达到平衡,故C错误;
D.容器Ⅱ中平衡时氮气的物质的量为0.05mol,则二氧化碳的生成量为0.1mol,CO、NO的物质的量均为0.2mol-0.05mol×2=0.1mol,容积为1L,则平衡常数K=,若起始时,向容器Ⅱ中充入0.08mol NO、0.04molN2,2.8<5=K,反应将向正反应方向进行,故D正确;
故答案为D。
6.(2023·重庆渝中·高三重庆巴蜀中学校考阶段练习)如图所示实验操作不能达到实验目的的是
A.用装置甲将氨气通入FeSO4和H2SO4的混合溶液制备少量摩尔盐[(NH4)2Fe2(SO4)2•6H2O]
B.用图乙装置探究硫酸浓度对化学反应速率的影响
C.用图丙装置探究KCl浓度是否对FeCl3+3KSCN3KCl+Fe(SCN)3平衡移动有影响
D.用图丁装置制备Fe(OH)2沉淀
【答案】A
【详解】A.氨气极易溶于水,容易引发倒吸,应用防倒吸装置,故A错误;
B.两组实验中硫酸浓度不同,实验室产生沉淀所需的时间不同,可以探究硫酸浓度对化学反应速率的影响,故B正确;
C.KCl浓度增大不会引起该平衡移动,通过观察加入前后溶液颜色可判断其对平衡的影响,故C正确;
D.Fe作阳极失电子生成,阴极上放电使溶液pH升高,与结合生成沉淀,故D正确;
故选:A。
7.(2023·辽宁·朝阳市第一高级中学校联考一模)氨气去除NO的反应原理为: ,反应速率与浓度之间存在如下关系:,,、为速率常数,只受温度影响。350℃时,在2L恒容密闭容器中,通入和发生反应,保持温度不变,5min后反应达平衡,NO的转化率为50%。下列说法正确的是
A.用表示的化学反应速率为
B.350℃时,该反应的平衡常数为0.5
C.其他条件不变,往反应后的容器中再通入和,重新达平衡时NO的体积分数减小
D.当温度改变为T℃时,若,则
【答案】D
【分析】由题意可列如下三段式:
【详解】A.由三段式数据可知,用氨气表示的化学反应速率为=0.02mol·L-1·min-1,故A错误;
B.由三段式数据可知,350℃时,反应的平衡常数为K==0.125,故B错误;
C.其他条件不变,往反应后的容器中再通入0.45mol氨气和0.6mol一氧化氮,相当于增大压强,该反应是气体体积增大的反应,增大压强,平衡向逆反应方向移动,一氧化氮的体积分数增大,故C错误;
D.反应达到平衡时,正反应速率和逆反应速率相等,则反应速率k正·c4(NH3)·c6(NO) =k逆·c5(N2)·c6(H2O),==K,当k正=k逆时,平衡常数K=1>0.125,说明平衡向正反应方向移动,该反应为放热反应,则反应温度小于350℃,故D正确;
故选D。
8.(2023春·湖南长沙·高三长沙一中校考阶段练习)某反应可有效降低汽车尾气污染物的排放,一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。下列说法正确的是
A.提高反应温度,反应物转化率增加
B.使用催化剂可以降低反应的活化能,提高活化分子百分数,提高反应物的转化率
C.该化学反应的速率主要由反应③决定
D.
【答案】D
【详解】A.由图可知,该过程的总反应为2CO+2NO=N2+2CO2,根据盖斯定律可知,反应①+反应②+反应③=总反应,因此∆H=+298.4kJ/mol+(-513.5kJ/mol)+(-306.6kJ/mol)=-620.9kJ/mol,即总反应的热化学方程式为:2CO(g)+2NO(g)=N2(g)+2CO2(g) ∆H=-620.9kJ/mol,总反应为放热反应,提高反应温度,平衡逆移,反应物转化率降低,A错误;
B.一般使用催化剂可以降低反应的活化能,部分活化分子变为活化分子,则增大活化分子百分数,增大活化分子有效碰撞几率,加快化学反应速率,但不影响平衡移动,所以不能提高反应物的平衡转化率,B错误;
C.由图可知,正反应活化能最大的是①,活化能越大,反应速率越慢,整个反应是由最慢的一步决定的,则该化学反应的速率主要由反应①决定,C错误;
D.由图可知,该过程的总反应为2CO+2NO=N2+2CO2,根据盖斯定律可知,反应①+反应②+反应③=总反应,因此∆H=+298.4kJ/mol+(-513.5kJ/mol)+(-306.6kJ/mol)=-620.9kJ/mol,即总反应的热化学方程式为:2CO(g)+2NO(g)=N2(g)+2CO2(g) ∆H=-620.9kJ/mol,因此,D正确;
故选D。
9.(2023秋·湖南湘潭·高三湘潭一中校考阶段练习)CH4联合H2O和CO2制取H2时,发生的主要反应如下:
①CH4(g)+H2O(g)CO(g)+3H2(g) △H1=+206kJ·mol-1
②CH4(g)+CO2(g)2CO(g)+2H2(g) △H2=+247kJ·mol-1
将CH4、H2O和CO2按一定比例通入填充有催化剂的恒容反应器,在不同温度下,反应相同时间内(反应均未达到化学平衡状态)测得的值如图所示。
下列说法正确的是
A.由①②可知,CO(g)+H2O(g)CO2(g)+H2(g) △H=+41kJ·mol-1
B.反应条件不变,若反应足够长时间,①比②先达到化学平衡状态
C.其他条件不变时,升高温度,①的化学反应速率减小,②的化学反应速率增大
D.其他条件不变时,增大原料中H2O的浓度可以提高产物中的值
【答案】D
【分析】由图可得,在不同温度下,反应相同时间内(反应均未达到化学平衡状态)测得的值,随温度升高而减小。
【详解】A. ①CH4(g)+H2O(g)CO(g)+3H2(g) △H1=+206kJ·mol-1,②CH4(g)+CO2(g)2CO(g)+2H2(g) △H2=+247kJ·mol-1,由①-②可知,CO(g)+H2O(g)CO2(g)+H2(g) △H=206kJ·mol-1-247kJ·mol-1= -41kJ·mol-1,故A错误;
B. 反应条件不变,若反应足够长时间,无法确定2个反应的速率,无法确定谁先达到化学平衡状态,故B错误;
C. 其他条件不变时,升高温度,增大活化分子百分数,化学反应速率增大,①的化学反应速率增大,②的化学反应速率增大,故C错误;
D. 其他条件不变时,增大原料中H2O的浓度,①CH4(g)+H2O(g)CO(g)+3H2(g)平衡正向移动,氢气增大的幅度大于CO,可以提高产物中的值,故D正确;
故选D。
10.(2023秋·江苏常州·高二常州市第一中学校考期末)溶液与溶液发生反应:,达到平衡。下列说法不正确的是
A.加入苯,振荡,平衡正向移动
B.经苯2次萃取分离后,在水溶液中加入,溶液呈血红色,表明该化学反应存在限度
C.加入固体,平衡逆向移动
D.该反应的平衡常数
【答案】D
【详解】A.加入苯振荡,苯将I2萃取到苯层,水溶液中c(I2)减小,平衡正向移动,A正确;
B.将5mL0.1mol/LKI溶液与1mL0.1mol/LFeCl3溶液混合,参与反应的Fe3+与I-物质的量之比为1:1,反应后I-一定过量,经苯2次萃取分离后,在水溶液中加入KSCN溶液呈血红色,说明水溶液中仍含有Fe3+,即Fe3+没有完全消耗,表明该化学反应存在限度,B正确;
C.加入FeSO4固体溶于水电离出Fe2+,c(Fe2+)增大,平衡逆向移动,C正确;
D.该反应的平衡常数K=,D错误;
答案选D。
11.(2023·北京海淀·北理工附中校考模拟预测)工业上消除氮氧化物的污染,可用如下反应: 在温度和时,分别将和充入体积为1L的密闭容器中,测得随时间变化数据如下表:下列说法错误的是
温度
时间/min
n/mol
0min
10min
20min
40min
50min
T1
n(CH4)
0.50
0.35
0.25
0.10
0.10
T2
n(CH4)
0.50
0.30
0.18
…
0.15
A.10min内,时的化学反应速率比时小 B.温度:
C.平衡常数: D.
【答案】C
【详解】A.10min内,时的化学反应速率为,时的化学反应速率,故A正确;
B.温度越高反应速率越快,时的化学反应速率小于,所以温度:,故B正确;
C.时的化学反应速率小于,时,40min反应达到平衡,时,40min反应一定达到平衡,时甲烷的平衡浓度小于,平衡常数:,故C错误;
D. 时的化学反应速率小于,所以,时甲烷的平衡浓度小于,可知升高温度,平衡逆向移动,正反应放热,,故D正确;
选C。
12.(2023春·湖南长沙·高二长沙一中校考阶段练习)体积为1L的恒温恒容密闭容器中发生反应:,A、B浓度随时间变化关系如下图所示。下列说法不正确的是
A.曲线X表示A的浓度随时间的变化
B.25~30min内用A表示的平均化学反应速率是
C.气体总压不随时间变化可以说明该反应达到平衡状态
D.反应进行至25min时,曲线发生变化的原因是增加A的浓度
【答案】B
【分析】10min内X变化量为0.6-0.2=0.4mol/L,Y的变化量为0.6-0.4=0.2mol/L,根据反应方程式可知X为A,Y为B;
【详解】A.根据分析可知曲线X表示A的浓度随时间的变化,故A正确;
B.25~30min内,,A表示的平均化学反应速率是,故B错误;
C.该反应是前后气体分子数变化的反应,当压强不变了可以说明该反应达到平衡状态,故C正确;
D.反应进行至25min时,曲线A瞬间增大,B是连续的点,所以发生变化的原因是增加A的浓度,故D正确;
故答案为B。
13.(2023春·河北石家庄·高三石家庄二中校考开学考试)一种研究酸雨中水催化促进硫酸盐形成的化学新机制如图所示,下列说法错误的是
A.图中有关含硫和含氮化合物的化学反应均为氧化还原反应
B.“水分子桥”,可以加快或将电子转移给分子的速率
C.空气中浓度大时,能加快硫酸盐的形成速率
D.与反应的总离子方程式为
【答案】A
【详解】A.图中与的反应未发生元素化合价的变化,为非氧化还原反应,故A错误;
B.由题意可知,水为催化剂,“水分子桥”可以加快或将电子转移给分子的速率,故B正确;
C.为反应物,反应物浓度增大时,反应速率加快,所以空气中浓度大时,能加快硫酸盐的形成速率,故C正确;
D.根据图示,与反应分为三步进行,第一步:,第二步:,第三步:。三步反应加和得到总反应离子方程式:,故D正确;
选A。
14.(2023秋·江苏盐城·高三校联考期末) 炼钢厂排放的烟气中主要含SO2、NO、N2等。臭氧(O3)具有强氧化性,可用于烟气的脱硫脱硝,其空间构型与SO2相同。向含NO的模拟烟气中通入足量O3,发生的反应为2NO(g)+3O3(g)=N2O5(g)+3O2(g) ΔH0,由自发进行的判据∆G=∆H-T∆S
相关试卷
这是一份必刷题18 有机化学基础的综合——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版),文件包含必刷题18有机化学基础的综合高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷解析版docx、必刷题18有机化学基础的综合高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷原卷版docx等2份试卷配套教学资源,其中试卷共67页, 欢迎下载使用。
这是一份必刷题17 物质结构与性质的综合——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版),文件包含必刷题17物质结构与性质的综合高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷解析版docx、必刷题17物质结构与性质的综合高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷原卷版docx等2份试卷配套教学资源,其中试卷共57页, 欢迎下载使用。
这是一份必刷题15 化学实验综合题——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版),文件包含必刷题15化学实验综合题高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷解析版docx、必刷题15化学实验综合题高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷原卷版docx等2份试卷配套教学资源,其中试卷共64页, 欢迎下载使用。