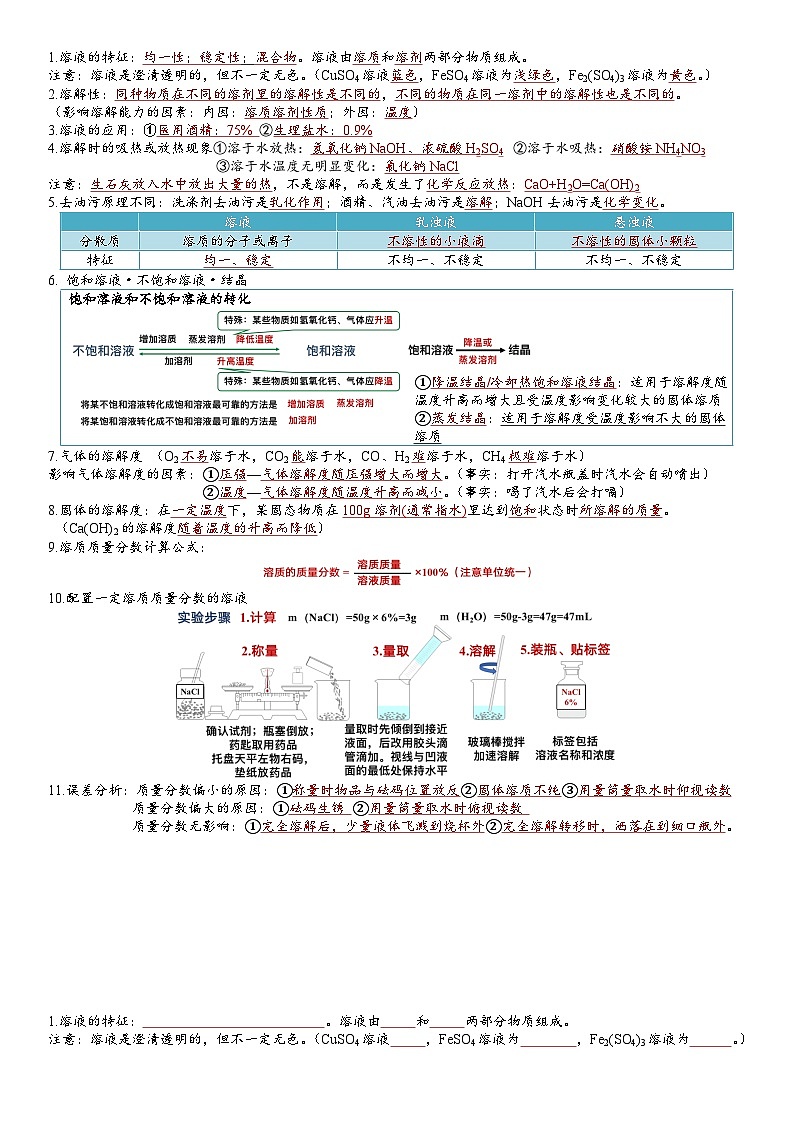
人教版初中化学中考一轮复习必备知识点---第九单元溶液
展开1.溶液的特征:均一性;稳定性;混合物。溶液由溶质和溶剂两部分物质组成。
注意:溶液是澄清透明的,但不一定无色。(CuSO4溶液蓝色,FeSO4溶液为浅绿色,Fe2(SO4)3溶液为黄色。)
2.溶解性:同种物质在不同的溶剂里的溶解性是不同的,不同的物质在同一溶剂中的溶解性也是不同的。
(影响溶解能力的因素:内因:溶质溶剂性质;外因:温度)
3.溶液的应用:①医用酒精:75% ②生理盐水:0.9%
4.溶解时的吸热或放热现象①溶于水放热:氢氧化钠NaOH、浓硫酸H2SO4 ②溶于水吸热:硝酸铵NH4NO3
③溶于水温度无明显变化:氯化钠NaCl
注意:生石灰放入水中放出大量的热,不是溶解,而是发生了化学反应放热:CaO+H2O=Ca(OH)2
5.去油污原理不同:洗涤剂去油污是乳化作用;酒精、汽油去油污是溶解;NaOH去油污是化学变化。
| 溶液 | 乳浊液 | 悬浊液 |
分散质 | 溶质的分子或离子 | 不溶性的小液滴 | 不溶性的固体小颗粒 |
特征 | 均一、稳定 | 不均一、不稳定 | 不均一、不稳定 |
6. 饱和溶液·不饱和溶液·结晶
饱和溶液和不饱和溶液的转化
①降温结晶/冷却热饱和溶液结晶:适用于溶解度随温度升高而增大且受温度影响变化较大的固体溶质 ②蒸发结晶:适用于溶解度受温度影响不大的固体溶质 |
7.气体的溶解度 (O2不易溶于水,CO2能溶于水,CO、H2难溶于水,CH4极难溶于水)
影响气体溶解度的因素:①压强—气体溶解度随压强增大而增大。(事实:打开汽水瓶盖时汽水会自动喷出)
②温度—气体溶解度随温度升高而减小。(事实:喝了汽水后会打嗝)
8.固体的溶解度:在一定温度下,某固态物质在100g溶剂(通常指水)里达到饱和状态时所溶解的质量。
(Ca(OH)2的溶解度随着温度的升高而降低)
9.溶质质量分数计算公式:
10.配置一定溶质质量分数的溶液
11.误差分析:质量分数偏小的原因:①称量时物品与砝码位置放反②固体溶质不纯③用量筒量取水时仰视读数
质量分数偏大的原因:①砝码生锈 ②用量筒量取水时俯视读数
质量分数无影响:①完全溶解后,少量液体飞溅到烧杯外②完全溶解转移时,洒落在到细口瓶外。
1.溶液的特征: 。溶液由 和 两部分物质组成。
注意:溶液是澄清透明的,但不一定无色。(CuSO4溶液 ,FeSO4溶液为 ,Fe2(SO4)3溶液为 。)
2.溶解性: , 。
(影响溶解能力的因素:内因: ;外因: )
3.溶液的应用:① ②
4.溶解时的吸热或放热现象①溶于水放热: ②溶于水吸热:
③溶于水温度无明显变化:
注意: ,不是溶解,而是发生了 :
5.去油污原理不同:洗涤剂去油污是 ;酒精、汽油去油污是 ;NaOH去油污是 。
| 溶液 | 乳浊液 | 悬浊液 |
分散质 | 溶质的分子或离子 |
|
|
特征 |
| 不均一、不稳定 | 不均一、不稳定 |
6. 饱和溶液·不饱和溶液·结晶
饱和溶液和不饱和溶液的转化
① :适用于溶解度随温度升高而增大且受温度影响变化较大的固体溶质 ② :适用于溶解度受温度影响不大的固体溶质 |
7.气体的溶解度 (O2 溶于水,CO2 溶于水,CO、H2 溶于水,CH4 溶于水)
影响气体溶解度的因素:① — 。(事实:打开汽水瓶盖时汽水会自动喷出)
② — 。(事实:喝了汽水后会打嗝)
8.固体的溶解度:在 下,某固态物质在 里达到 状态时 。
(Ca(OH)2的溶解度 )
9.溶质质量分数计算公式:
10.配置一定溶质质量分数的溶液
11.误差分析:质量分数偏小的原因:① ② ③
质量分数偏大的原因:① ②
质量分数无影响:① ② 。








