

所属成套资源:中考三轮冲刺之中考常考题专题复习
中考三轮冲刺之中考常考题专题复习-----质量守恒定律大题计算
展开
这是一份中考三轮冲刺之中考常考题专题复习-----质量守恒定律大题计算,共7页。试卷主要包含了如图装置常用于实验室制取气体,化学实验是科学探究的重要方法,根据所学知识回答等内容,欢迎下载使用。
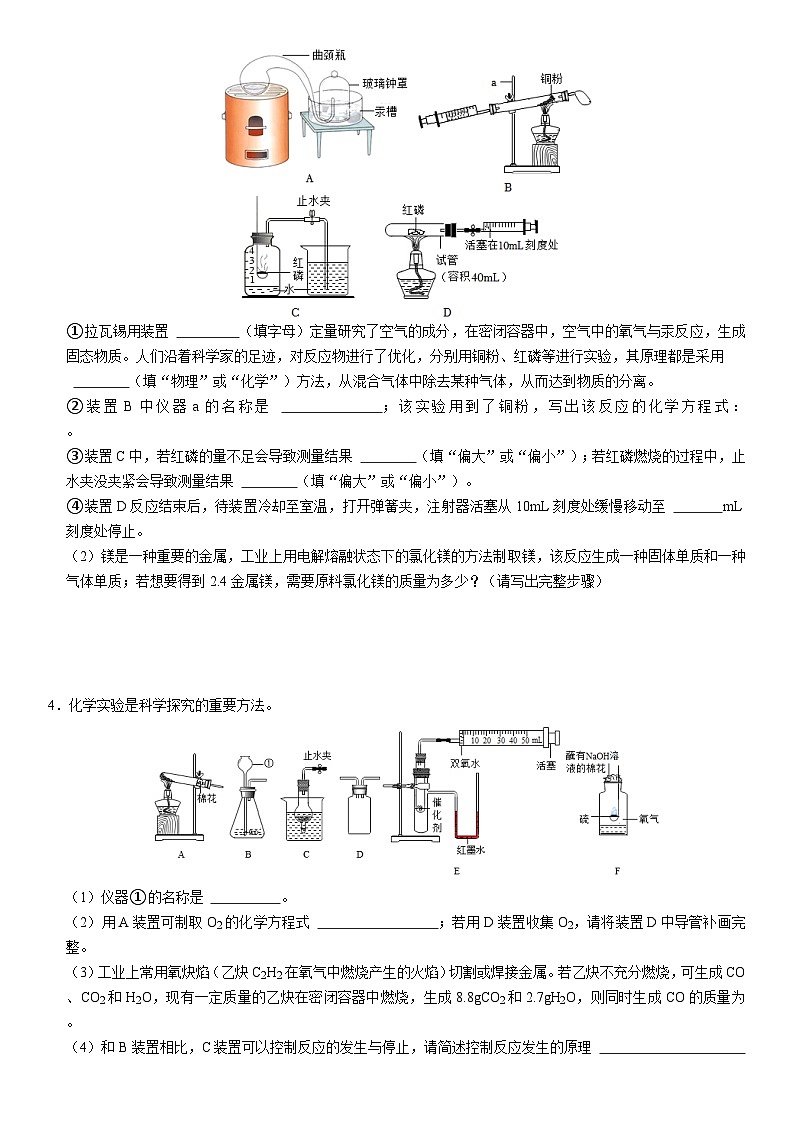
一.实验题(共6小题)1.结合下列化学实验装置,回答有关问题。(1)写出图1中标有字母仪器的名称:a ;实验室可用氯酸钾制取氧气,请将图1方框中气体的发生装置补充完整(只需画出试管) 。(2)实验室用高锰酸钾制取氧气,发生反应的化学方程式为 。(3)某同学甲用过氧化氢制取氧气时,既想得到平稳的氧气流,又想收集到较纯净的氧气,请你在图1中帮他选择一套气体装置的组合为 ;与装置B相比较,C的优点为 。(4)为了测量生成氧气的体积可用图2装置,氧气从 端进入(填字母),量筒的作用是 。(5)将氯酸钾与二氧化锰的混合物28.5克加热到不再产生氧气为止,得到固体残留物的质量为18.9克。试计算原固体混合物中氯酸钾的质量。 2.如图装置常用于实验室制取气体。(1)仪器①的名称是 。(2)用装置甲制取氧气,采用该收集方法的依据是 ;检验集气瓶中已经充满氧气的方法是 ;发生反应需要的催化剂是 。(3)用装置乙制取气体,实验结束时,为防止水槽里的水倒流,应采取的操作是 。(4)在加热条件下,用醋酸钠(CH3COONa)固体与碱石灰中氢氧化钠反应制取甲烷,同时生成碳酸钠,应选用的装置是 (填“甲”或“乙”),反应的化学方程式为 。(5)取氯酸钾和二氧化锰的混合物13g,用乙装置加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为8.2g,计算:①生成氧气的质量是多少②原混合物中氯酸钾的质量是多少?3.(1)如图四个实验装置均可用于测定空气中氧气的含量。请认真分析,回答下列问题。①拉瓦锡用装置 (填字母)定量研究了空气的成分,在密闭容器中,空气中的氧气与汞反应,生成固态物质。人们沿着科学家的足迹,对反应物进行了优化,分别用铜粉、红磷等进行实验,其原理都是采用 (填“物理”或“化学”)方法,从混合气体中除去某种气体,从而达到物质的分离。②装置B中仪器a的名称是 ;该实验用到了铜粉,写出该反应的化学方程式: 。③装置C中,若红磷的量不足会导致测量结果 (填“偏大”或“偏小”);若红磷燃烧的过程中,止水夹没夹紧会导致测量结果 (填“偏大”或“偏小”)。④装置D反应结束后,待装置冷却至室温,打开弹簧夹,注射器活塞从10mL刻度处缓慢移动至 mL刻度处停止。(2)镁是一种重要的金属,工业上用电解熔融状态下的氯化镁的方法制取镁,该反应生成一种固体单质和一种气体单质;若想要得到2.4金属镁,需要原料氯化镁的质量为多少?(请写出完整步骤) 4.化学实验是科学探究的重要方法。(1)仪器①的名称是 。(2)用A装置可制取O2的化学方程式 ;若用D装置收集O2,请将装置D中导管补画完整。(3)工业上常用氧炔焰(乙炔C2H2在氧气中燃烧产生的火焰)切割或焊接金属。若乙炔不充分燃烧,可生成CO、CO2和H2O,现有一定质量的乙炔在密闭容器中燃烧,生成8.8gCO2和2.7gH2O,则同时生成CO的质量为 。(4)和B装置相比,C装置可以控制反应的发生与停止,请简述控制反应发生的原理 。(5)E装置可用来比较MnO2、CuO对过氧化氢分解的催化效果。实验时,分别将过氧化氢溶液一次性注入盛有等质量的催化剂的小试管中,测量并记录数据。实验中发现U型管内右侧液面上升,说明过氧化氢分解过程 热量(“吸收”或“放出”)。(6)硫在氧气中燃烧产生的SO2污染空气,实验装置可改进为F装置。SO2可溶解在NaOH溶液中,该反应与CO2溶解在NaOH溶液中的反应类似,请写出SO2与NaOH反应的化学方程式 。(7)工业上制二氧化碳的原理和实验室不同。某工厂为了分析一批石灰石的纯度,取样品70g,充分煅烧后剩余固体48g(杂质不参与反应),试计算样品的纯度(计算结果精确到0.1%)。 5.2022年“世界水日”的主题是“珍惜地下水,珍惜隐藏的资源”,生活、生产中我们都离不开水。(1)为研究水的组成,某同学进行了电解水实验。①如图是电解水实验示意图,试管a、b中产生气体的体积比约为 (填最简比),试管a和b产生气体的质量比约为 ,电解水的化学方程式为 。②电解水的实验证明水是由 组成的。(2)小刚同学从海河中取一瓶河水,他在实验室模拟自来水厂的净水过程,最终制成自来水。其实验流程如图所示。请回答以下问题操作①的名称是 ;操作②加入活性炭,主要利用活性炭的 性。经过净化后的液体D是硬水,日常生活中常用 的方法使其软化后使用。(3)某工厂需要64kg氧气作为燃料。若用双氧水来制取这些氧气,则需要双氧水的质量是多少?6.根据所学知识回答:(1)镁、锌、铁各65g,含原子数目最多的是 。质量相等的四种物质①KMnO4②KClO3、③H2O2、④H2O完全分解后所制得氧气的质量由大到小的顺序为 (填序号)。(2)小明和几位同学在实验室用下列装置制取几种气体,请按要求作答。①仪器X的名称是 ;加热氯化铵和熟石灰的固体混合物可制取氨气,氨气极易溶于水,密度小于空气,则制取氨气的一套装置为 (填字母代号)。②B和C装置均可制取O2,与B相比较,C的主要优点是 。③若制取的O2用G装置收集,请将图G补画完整 。④小明用选用高锰酸钾制取氧气,该反应的化学方程式为 。⑤现已知:钠与水反应生在氢氧化钠和氢气。小明在实验室里用6.9g钠理论上可以制得氢气多少克? 二.计算题(共8小题)7.现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,欲测定其组成。现取该混合物粉末8.0g放入烧杯中,将140.0g14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量的数据记录如下:次数1234加入稀硫酸的质量/g35.035.035.035.0剩余固体的质量/g6.85.64.44.2(1)该混合物粉末中铜的质量分数 。(2)该混合物粉末中另一金属是 。(3)求充分反应后生成氢气的质量(写计算过程)。 8.为测定某食盐样品中氯化镁的质量分数,学习小组的同学称取20g该食盐样品,加水配制成100g溶液,再加入100g氢氧化钠溶液恰好完全反应。经测定,生成沉淀的质量为5.8g。请完成下列分析和计算:(1)反应后溶液的质量为 。(2)计算该食盐样品中氯化镁的质量分数(写出计算过程)。 9.三星堆文明令世人瞩目,考古发现众多青铜像。青铜是铜锡合金,明代宋应星所著《天工开物》曾记载下列炼锡(Sn)方法:SnO2+2CSn+2CO↑。理论上消耗302kg的SnO₂可以炼制多少 kg的锡? 10.为了测定某石灰石样品中碳酸钙的质量分数,取该样品与足量稀盐酸在烧杯中反应,有关实验数据如表。 反应前反应后实验数据烧杯和稀盐酸的质量/g石灰石样品的质量/g烧杯和其中混合物的质量/g10012107.6请计算:(1)该反应生成二氧化碳的质量为 g;(2)该石灰石样品中碳酸钙的质量分数为多少?(请写出计算过程) 11.测定混合物中氢氧化钠的质量分数现有氢氧化钠和碳酸钠的固体混合物10g,将其全部放入一洁净的烧杯中,然后加入足量蒸馏水,搅拌,使固体完全溶解。再向烧杯中逐滴加入溶质质量分数为10%的氯化钡溶液,反应过程中产生沉淀的质量与所滴入氯化钡溶液的质量关系如下图所示,试计算固体混合物中氢氧化钠的质量分数。12.小王同学利用石灰石样品和稀盐酸进行如下实验,操作过程和数据如图所示(样品中的杂质不与酸反应,也不溶于水)。(1)15g石灰石样品中CaCO3的质量为 g;操作①的名称是 。(2)反应结束生成二氧化碳的质量是多少?(3)石灰石样品中碳酸钙的质量分数是多少?(结果精确到0.1%) 13.用“侯氏联合制碱法”制得的纯碱中常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的质量分数,学习小组同学称取该纯碱样品12.5g,完全溶解于足量的水中,再滴加一定溶质质量分数的氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示。(1)反应中生成碳酸钙的质量是 g。(2)计算该纯碱样品中碳酸钠的质量分数。 14.小文用如图所示实验测量粗锌中锌的质量分数(粗锌中的杂质既不溶于水,也不与稀硫酸反应)。试计算:粗锌中锌的质量分数。
参考答案一.实验题(共6小题)1.酒精灯;;2KMnO4K2MnO4+MnO2+O2↑;C、F;能通过控制液体的滴加速率来控制反应速率;d;测量排出水的体积; 2.长颈漏斗;氧气的密度比空气大;将带火星的木条放在集气瓶口,若木条复燃则已集满;二氧化锰;先移出导管,再熄灭酒精灯;乙;CH3COONa+NaOHCH4↑+Na2CO3; 3.A;化学;铁架台;2Cu+O22CuO;偏小;偏大;2; 4.长颈漏斗;2KMnO4K2MnO4+MnO2+O2↑;2.8g;打开止水夹,内部气体输出,压强减小,烧杯内的液体重新进入球形干燥管,固液接触,反应发生;放出;SO2+2NaOH=Na2SO3+H2O; 5.2:1;1:8;2H2O2H2↑+O2↑;氢元素和氧元素;过滤;吸附;煮沸; 6.镁;④③②①;长颈漏斗;AD;能使反应随时进行或停止;;2KMnO4K2MnO4+MnO2+O2↑;二.计算题(共8小题)7.52.5%;镁或Mg; 8.194.2; 9.238; 10.4.4; 11.47%。; 12.10;过滤; 13.10; 14.81.25%。;声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布日期:2023/4/10 8:29:21;用户:初中化学;邮箱:xueshen03@xyh.com;学号:30236074
相关试卷
这是一份中考三轮冲刺之中考常考题专题复习-----基础填空,共3页。试卷主要包含了人的生存离不开空气和水,回答下列问题,水是一切生命活动所必需的物质,请从微观角度解释等内容,欢迎下载使用。
这是一份中考三轮冲刺之中考常考题专题复习-----填空题计算,共2页。
这是一份中考三轮冲刺之中考常考题专题复习-----选择计算专练,共3页。








