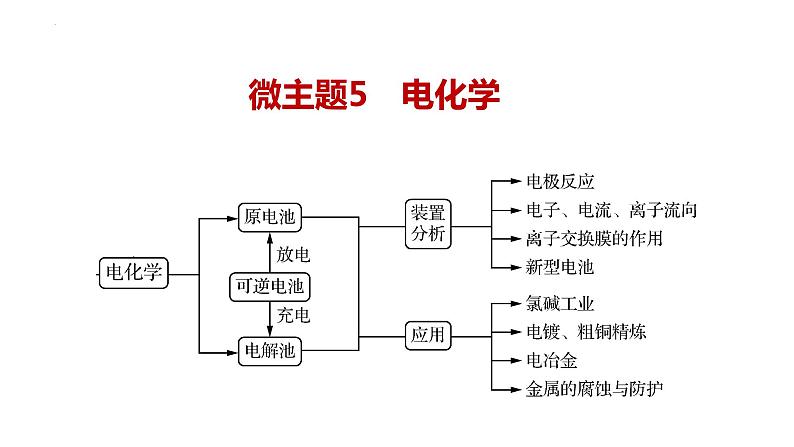


2023届高三二轮复习 微专题电化学专题课件PPT
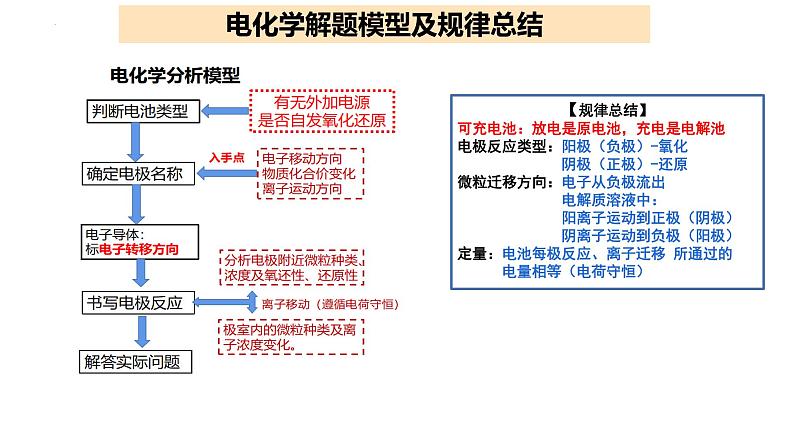
展开【规律总结】可充电池:放电是原电池,充电是电解池电极反应类型:阳极(负极)-氧化 阴极(正极)-还原微粒迁移方向:电子从负极流出 电解质溶液中: 阳离子运动到正极(阴极) 阴离子运动到负极(阳极)定量:电池每极反应、离子迁移 所通过的 电量相等(电荷守恒)
电化学解题模型及规律总结
电极反应的书写(几乎每年都考)
(1)电极反应的书写实际上就是氧化还原离子方程式的配平 考虑三个守恒:得失电子守恒、电荷守恒、质量守恒
(3)不同介质在电极反应式中的“去留”
具体情境中还可能出现:质子交换膜(只允许H+通过)、熔融盐碳酸盐燃料电池(只允许CO32—离子定向移动)、固体氧化物燃料电池(只允许O2—定向迁移)、锂离子电池(只允许Li+定向迁移等)、有机物电解质。
考向一 原电池工作原理的应用
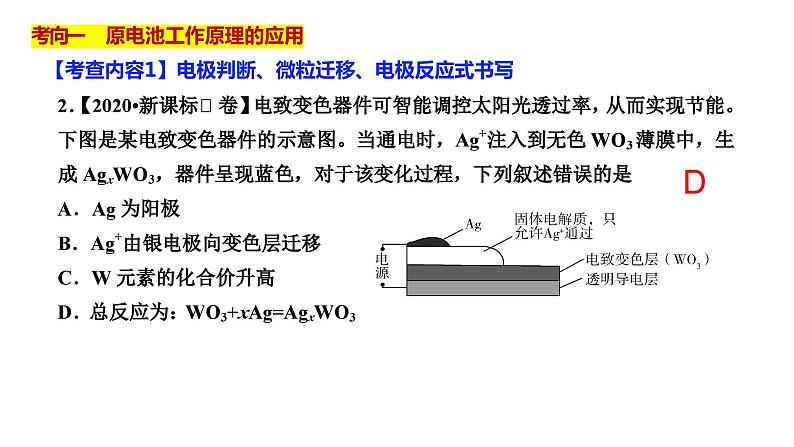
【考查内容1】电极判断、微粒迁移、电极反应式书写
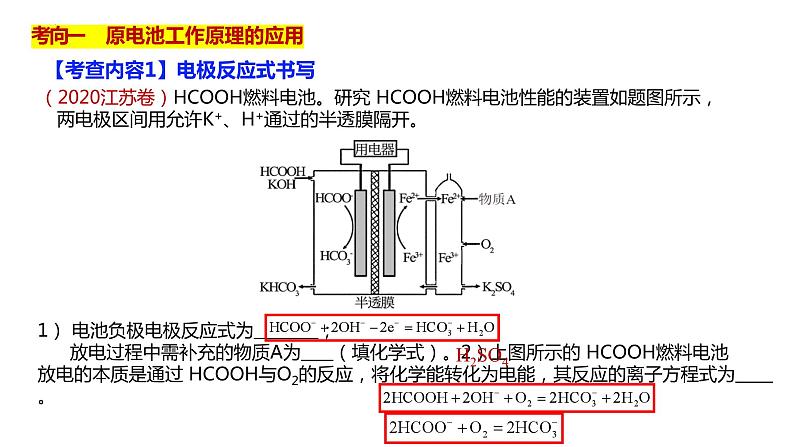
(2020江苏卷)HCOOH燃料电池。研究 HCOOH燃料电池性能的装置如题图所示,两电极区间用允许K+、H+通过的半透膜隔开。
1) 电池负极电极反应式为 ; 放电过程中需补充的物质A为 (填化学式)。2)上图所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 。
【考查内容1】电极反应式书写
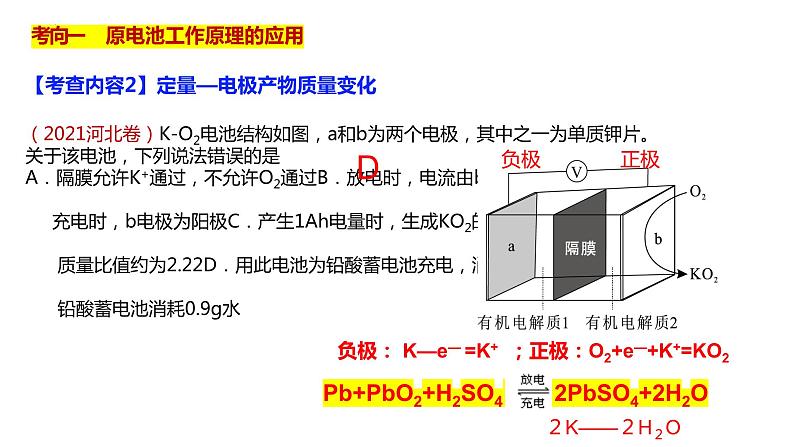
(2021河北卷)K-O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是A.隔膜允许K+通过,不允许O2通过B.放电时,电流由b电极沿导线流向a电极; 充电时,b电极为阳极C.产生1Ah电量时,生成KO2的质量与消耗O2的 质量比值约为2.22D.用此电池为铅酸蓄电池充电,消耗3.9g钾时, 铅酸蓄电池消耗0.9g水
【考查内容2】定量—电极产物质量变化
负极: K—e— =K+ ;正极:O2+e—+K+=KO2
(2020全国III卷)一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:
该电池工作时,下列说法错误的是
A.负载通过0.04 ml电子时,有0.224 L(标准状况)O2参与反应B.正极区溶液的pH降低、负极区溶液的pH升高C.电池总反应为 D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
【考查内容2】定性—正负极区域酸碱性变化;定量—电极产物质量变化
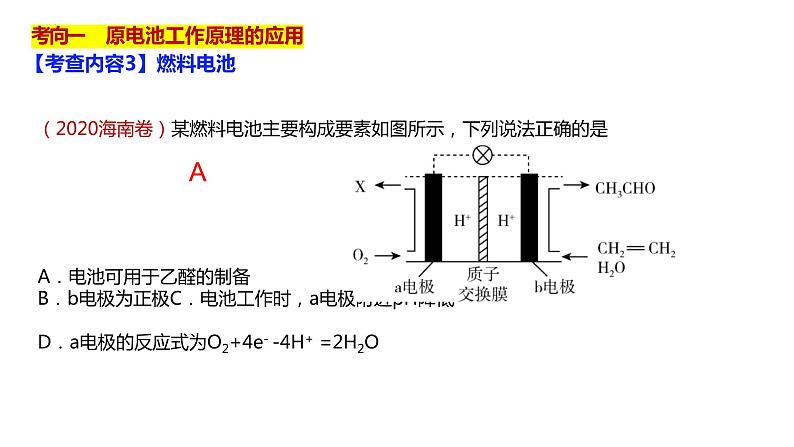
(2020海南卷)某燃料电池主要构成要素如图所示,下列说法正确的是
A.电池可用于乙醛的制备 B.b电极为正极C.电池工作时,a电极附近pH降低 D.a电极的反应式为O2+4e- -4H+ =2H2O
【考查内容3】燃料电池
(2019全国I卷)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能B.阴极区,在氢化酶作用下发生反应H2+2MV2+ == 2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3 D.电池工作时质子通过交换膜由负极区向正极区移动
5. (2022·湖南卷)海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如图。下列说法错误的是( )A. 海水起电解质溶液作用B. N极仅发生电极反应:2H2O+2e-===2OH-+H2↑C. 玻璃陶瓷具有传导离子和防水的功能D. 该锂-海水电池属于一次电池
【考查内容4】新型电池
(2020天津卷)熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为(x=5~3,难溶于熔融硫),下列说法错误的是
A.Na2S4的电子式为 B.放电时正极反应为C.Na和Na2Sx分别为电池的负极和正极 D.该电池是以 为隔膜的二次电池
(2019天津卷)我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
A.放电时,a电极反应为I2Br- + 2e- = 2I- + Br- B.放电时,溶液中离子的数目增大C.充电时,b电极每增重0.65g, 溶液中有0.02ml I-被氧化D.充电时,a电极接外电源负极
下图是“海水河水”浓差电池装置示意图(不考虑溶解氧的影响),其中a、b均为复合电极,b的电极反应式为AgCl+e— =Ag+Cl— 。下列说法正确的是( )
A. a的电极反应式为Ag-e—=Ag+B. 内电路中,Na+由b极区向a极区迁移C. 工作一段时间后,两极NaCl溶液的浓度差减小D. 电路中转移时1ml电子,理论上a极区模拟海水的质量减少23g
负极:Ag—e— +Cl— =AgCl正极:AgCl+e—=Ag+Cl—
电动势产生的原因是因为两侧电极Na+ 浓度不一样产生的,Na+移向b极,a极失去电子,b极AgCl 得电子生成Ag,形成闭合回路,产生电流。
Na+ 通过阳离子交换膜进入河水中,电路中每转移1ml电子,负极区域损失的NaCl为1ml,理论上减少的质量为58.5克。D不正确。
(2022浙江卷)pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag—AgCl电极)和另一Ag—AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059。下列说法正确的是
A.如果玻璃薄膜球内电极的电势低,则该电极反应式为: AgCl(s)+e-=Ag(s)+Cl- (0.1ml·L-1)B.玻璃膜内外氢离子浓度的差异不会引起电动势的变化 C.分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pHD.pH计工作时,电能转化为化学能
6. (2022·广东卷)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中( )A. 阴极发生的反应为Mg-2e-=== Mg2+B. 阴极上Al被氧化C. 在电解槽底部产生含Cu的阳极泥D. 阳极和阴极的质量变化相等
考向二 电解池工作原理的应用
7. (2022·海南卷)一种采用H2O(g)和N2(g)为原料制备NH3(g)的装置示意图如图。下列有关说法正确的是( )A. 在b电极上,N2被还原B. 金属Ag可作为a电极的材料C. 改变工作电源电压,反应速率不变D. 电解过程中,固体氧化物电解质中O2-不断减少
(2022·汕尾期末)利用电化学法能将NO转化为N2,其工作原理如图所示:①电极Ⅰ应连接外电源______极。②电极Ⅱ上发生的电极反应式为____________________________________。
2H2O-4e-===O2↑+4H+
14. (1) (2021·肇庆月考)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图所示。电解过程中阳极上发生的电极反应式为________________。
Cl--2e-+2OH-===ClO-+H2O
(2022·广州二模)金属镓拥有电子工业脊梁的美誉,镓与铝同族,化学性质相似。一种从高铝粉煤灰(主要成分是Al2O3,还含有少量Ga2O3和Fe2O3等)中回收镓的工艺如图(略):
“电解”所用装置如图所示,阴极的电极反应为_______________。若电解获得1 ml Ga,则阳极产生的气体在标准状况下的体积至少为_______L,电解后,阳极室所得溶液中的溶质经加热分解生成_______(填化学式)可循环利用。
【考查内容2】电极反应式书写、定量—电极质量变化
GaO2-+3e-+2H2O===Ga+4OH-
9. (2021·广东卷)钴(C)的合金材料广泛应用于航空航天、机械制造等领域。下图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )A. 工作时,Ⅰ室和Ⅱ室溶液的pH均增大B. 生成1ml C,Ⅰ室溶液质量理论上减少16 gC. 移除两交换膜后,石墨电极上发生的反应不变
【考查内容3】定性—电解液浓度变化、定量—电极质量变化
可充电电池的解题、审题思路
考向三 二次电池(可充电池)
12. (2022·全国乙卷)Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===2Li++O2)对电池进行充电。下列叙述错误的是( )A. 充电时,电池的总反应:Li2O2===2Li+O2B. 充电效率与光照产生的电子和空穴量有关C. 放电时,Li+从正极穿过离子交换膜向负极迁移D. 放电时,正极发生反应:O2+2Li++2e-===Li2O2
考向三 二次电池
2. (2022·广东二模)M(碱金属)-CO2电池可以实现对CO2的利用并具有较高的理论比能量(“理论比能量”是指单位质量的电极材料理论上能释放出的最大电能)。该类电池放电的电极总反应式为4M+3CO2===2M2CO3+C,下列说法错误的是( )A. 放电时,电子流动方向为碱金属片→外电路→玻碳电极B. Na-CO2电池比Li-CO2电池的理论比能量高C. 吸入CO2时发生反应:3CO2+4M++4e-===2M2CO3+CD. 充电时,玻碳电极接电源正极
(2021浙江卷)镍镉电池是二次电池,其工作原理示意图如下(L 为小灯泡,K1、K2为开关,a、b为直流电源的两极)。
下列说法不正确的是A.断开K2、合上K1,镍镉电池能量转化形式:化学能→电能B.断开K1、合上K2,电极A为阴极,发生还原反应C.电极B发生氧化反应过程中,溶液中KOH浓度不变D.镍镉二次电池的总反应式:Cd+ 2NiOOH+2H2OCd(OH)2+2Ni(OH)2
【考查内容2】电极判断、电极反应式书写、定性—溶液酸碱性变化
11. (2022广东)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )A. 充电时电极b是阴极B. 放电时NaCl溶液的pH减小C. 放电时NaCl溶液的浓度增大D. 每生成1 ml Cl2,电极a质量理论上增加23 g
考向三 二次电池
11. 一种新型水锂充电电池采用复合膜包裹的金属锂和锰酸锂(LiMn2O4) 作电极材料,以Li2SO4水溶液作电解质,工作时电池的总反应为LiMn2O4+Li = Li2Mn2O4。下列有关该电池的说法错误的是( )
A. 该电池放电时,溶液中的SO42-)向电极a移动B. 该电池的负极反应式为Li-e-===Li+C. 电池充电时,阳极的锂元素质量分数减小D. 去掉包裹金属锂的复合膜能使金属锂的利用率更高
【考查内容4】新型二次电池
【考查内容5】多池串联问题
7. (2022·深圳一调)利用电化学原理可对海水(主要成分NaCl和H2O,还含有少量微生物)进行消毒,并能清除残留的含氯消毒物质(工作原理如图,其中电极均为惰性电极)。已知:工作时,先断开K2,闭合K1,一段时间后,断开K1,闭合K2。下列说法不正确的是( )
A. 闭合K1后的总反应为 2Cl-+2H2O Cl2↑+H2↑+2OH-B. 闭合K2后,Na+通过离子交换膜从Ⅱ室迁移至Ⅲ室C. 工作完成后,Ⅱ室中有金属Na剩余D. 残留的含氯消毒物质在Ⅲ室放电被脱除
(2022山东卷)(双选)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCO2(s)转化为C2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
A.装置工作时,甲室溶液pH逐渐增大B.装置工作一段时间后,乙室应补充盐酸C.乙室电极反应式为
D.若甲室C2+减少200mg,乙室C2+增加300mg,则此时已进行过溶液转移
【2020新课标Ⅰ卷】
【2020新课标Ⅲ卷】
考向四 电化学中的离子交换膜的应用
(2021山东)(4)利用膜电解技术(装置如图所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为:4Na2CrO4+4H2O Na2Cr2O7+4NaOH+2H2↑+O2↑。 则Na2Cr2O7在___(填“阴”或“阳”)极室制得,电解时通过膜的离子主要为___。
【考查内容1】离子选择性膜的应用
A. Ⅱ区的K+通过隔膜向Ⅲ区迁移C. MnO2电极反应: MnO2+4H++2e-===Mn2++2H2OD. 电池总反应:Zn+4OH-+MnO2+
A.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜C.当电路中转移1 ml电子时,模拟海水理论上除盐58.5 gD.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
(2020山东)微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是( )
负极(a极) CH3COO-+2H2O-8e-=2CO2↑+7H+正极(b极) 2H+ +2e-=H2↑
5. (2022·佛山二模)有机物电极材料具有来源丰富、可降解等优点,一种负极材料为固态聚酰亚胺-水系二次电池的结构如图所示。下列说法正确的是( )
A. 充电时有机电极发生了氧化反应B. 充电时每转移2 ml e-,右室离子数目减少2 mlC. 放电时负极电极反应为
D. 将M+由Li+换成Na+,电池的比能量会下降
正极:I3- +2e-=3I-
8. 某锂离子电池的总反应为2Li+FeS===Fe+Li2S。某小组以该电池为电源电解处理含Ba(OH)2废水和含Ni2+、Cl-的酸性废水,并分别获得BaCl2溶液和单质镍。电解处理的工作原理如图所示[LiPF6·SO(CH3)2为锂离子电池的电解质]。下列说法正确的是( )
A. X与锂离子电池的Li电极相连B. a室的电极反应式为 2H2O-4e- == O2↑+4H+C. 离子膜M为阳离子交换膜,离子膜N为阴离子交换膜D. 若去掉离子膜M将a、b两室合并,则X电极的反应不变
3. (2022·珠海期末) 一种三室可充电Zn-MnO2电池如图所示,膜N为阳离子交换膜。充电时Zn电极反应式为[Zn(OH)4]2-+2e-===Zn+4OH-。下列说法不正确的是( )
A. 放电时,c室的pH减小B. 放电时,Zn电极电势比MnO2电极低C. 充电时,SO42-由b室透过M膜到a室D. 充电时,MnO2电极反应式为 Mn2++2H2O+2e-===MnO2+4H+
1、微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法不正确的是( )
A.A极为电池的负极,电子从A电极流出B.B极的电极反应式为2NO3— +12H++10e—=N2+6H2OC.好氧微生物反应器中反应为:NH4++2O2=NO3—+2H+ +3H2O D.当生成22.4 L CO2(标准状况)时,电路中共转移NA个电子
负极:CH3COO— —8e— +2H 2O =2CO2+7H+
正极:2NO3— +12H++10e—=N2+6H2O
【考查内容2】质子交换膜的应用
(2021天津)如下所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是
A.a是电源的负极B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色C.随着电解的进行,CuCl2溶液浓度变大D.当0.1 ml Fe2O3完全溶解时,至少产生气体336mL (折合成标准状况下)
【考查内容3】Li+、Na+交换膜的应用
8. (2021·广东化学模拟)以石墨负极(C)、LiFePO4正极组成的锂离子电池的工作原理如图所示(实际上正负极材料是紧贴在锂离子导体膜两边的)。充放电时,Li+在正极材料上脱嵌或嵌入,随之在石墨中发生了LixC6生成与解离。下列说法正确的是( )
A. 锂离子导电膜应有保护成品电池安全性的作用B. 该电池工作过程中Fe元素化合价没有发生变化C. 放电时,负极材料上的反应为 6C+xLi++xe-===LixC6D. 放电时,正极材料上的反应为 LiFePO4-xe-===Li1-xFePO4+xLi+
9. (2021·湛江二模)氢能源电池是目前研究的热点之一。一种可实现氢气循环利用新型电池的放电工作,原理如图所示,下列说法正确的是( )
A. 该装置化学能与电能之间的能量转化效率可达100%B. 充电时,电极M接电源的负极C. 放电过程中Na+由左池通过交换膜向右池移动D. 放电时,N极电极反应式为 H2+2OH--2e-===2H2O
10. (2021·全国甲卷)乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是( )
A. KBr在上述电化学合成过程中只起电解质的作用C. 制得2 ml乙醛酸,理论上外电路中迁移了1 ml电子D. 双极膜中间层中的H+在外电场作用下向铅电极方向迁移
【考查内容4】双极膜的应用
(2020全国I卷)科学家近年发明了一种新型Zn−CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是A.放电时,负极反应为B.放电时,1 ml CO2转化为HCOOH,转移的电子数为2 mlC.充电时,电池总反应为: D.充电时,正极溶液中OH−浓度升高
11. (2022·肇庆三模)我国科研工作者提出通过电解原理联合制备环氧乙烷同时处理酸性含铬废水,其工作原理示意图如图所示。其中双极膜由阳离子交换膜和阴离子交换膜组成,工作时内层H2O解离为H+和OH-,并分别直流电源向两极迁移。下列说法正确的是( )
A. 电极a为电源正极B. 膜q为阳离子交换膜C. 工作时,NaOH溶液浓度保持不变D. N极的电极反应式为 Cr2O72-+14H++6e- == 2Cr3++7H2O
考向五 金属腐蚀与防护
13. (2020·江苏卷)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是( )A. 阴极的电极反应式:Fe-2e-===Fe2+B. 金属M的活动性比Fe的活动性弱C. 钢铁设施表面因积累大量电子而被保护D. 钢铁设施在河水中的腐蚀速率比在海水中的快
14. (2019·江苏卷)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )A. 铁被氧化的电极反应式:Fe-3e-===Fe3+B. 铁腐蚀过程中化学能全部转化为电能C. 活性炭的存在会加速铁的腐蚀D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
15. (2017·新课标Ⅰ卷)支持海港码头基础的钢管桩常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性 辅助阳极。下列有关表述不正确的是( )A. 通入保护电流使钢管桩表面腐蚀电流接近于零B. 通电后外电路电子被强制从高硅铸铁流向钢管桩C. 高硅铸铁的作用是作为损耗阳极材料和传递电流D. 通入的保护电流应该根据环境条件变化进行调整
(2021全国乙卷)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是A.阳极发生将海水中的Cl-氧化生成Cl2的反应B.管道中可以生成氧化灭杀附着生物的NaClOC.阴极生成的H2应及时通风稀释安全地排入大气D.阳极表面形成的Mg(OH)2等积垢需要定期清理
【考查内容1】新型应用
考向六 电化学原理的综合应用(与物质制备、实验、平衡融合)
12. (2022·汕头一模)硬水除垢可以让循环冷却水系统稳定运行。某科研团队改进了主动式电化学硬水处理技术,原理如图所示(其中R为有机物)。下列说法不正确的是( )
A. b端为电源正极,处理后的水垢沉淀在阳极底部B. 处理过程中Cl-可循环利用C. 流程中发生反应: HCO3-+Ca2++OH- == CaCO3↓+H2O, Mg2++2OH-===Mg(OH)2↓D. 若R为CO(NH2)2,则消耗1 ml CO(NH2)2生成N2时, 铂电极N处产生的H2应大于3 ml
13. (2022·东莞期末)电化学修复技术是近年迅速发展的一种污染土壤绿色原位修复技术。处理土壤重金属污染时,在污染土壤区域插入电极(如图),土壤中污染物定向迁移,富集在电极区域,再通过其他方法(电镀、沉淀/共沉淀、抽出、离子交换树脂等)去除。下列说法正确的是( )
A. H+在阳极区反应B. 土壤中胶体粒子不带电C. 阴极区抽提物发生的是阴离子交换D. 金属离子在碱性区域去除
(2021北京高考)环氧乙烷( ,简称EO)是一种重要的工业原料和消毒剂。 由乙烯经电解制备EO的原理示意图如下。
(1)①阳极室产生Cl2后发生的反应有:__、 CH2=CH2+HClO→HOCH2CH2Cl。 ②结合电极反应式说明生成溶液a的原理__。
2Cl— —2e— =Cl2↑
阴极反应:2H2O + 2e—= H2↑ + 2OH—;K+穿过阳离子膜进入阴极室形成 KOH
【考查内容2】电化学原理与物质制备融合
(2021北京高考)环氧乙烷( ,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如下。
(2)一定条件下,反应物按一定流速通过该装置。 电解效率η和选择性S的定义:
①若η(EO)=100%,则溶液b的溶质为_______。
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%, 推测η(EO)≈70%的原因:I.阳极有H2O放电;II.阳极有乙烯放电;III阳极室流出液中含有Cl2和HClO……i.检验电解产物,推测I不成立。需要检验的物质是_______。
分析:阳极、有还原性的物质都可能放电,如果水要在阳极放电,会产生氧气。
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%,推测η(EO)≈70%的原因:I.阳极有H2O放电;II.阳极有乙烯放电;III阳极室流出液中含有Cl2和HClO……ii.假设没有生成EO的乙烯全部在阳极放电生成CO2,η(CO2)≈_______%。经检验阳极放电产物没有CO2。
解:设消耗的乙烯为aml,转移的电子数为xml.设CO2的电解效率为b%
C2H4 —12e— =2CO2
C2H4 —12e— +4H2O=2CO2+12H+
C2H4 =2CO2
(2)一定条件下,反应物按一定流速通过该装置。电解效率η和选择性S的定义:
①若η(EO)=100%,则溶液b的溶质为_______。②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%,推测η(EO)≈70%的原因:I.阳极有H2O放电;II.阳极有乙烯放电;III阳极室流出液中含有Cl2和HClO……iii.实验证实推测III成立,所用试剂及现象是_。可选试剂:AgNO3溶液、KI溶液、淀粉溶液、品红溶液。
KI 溶液和淀粉溶液,溶液变蓝
KI 溶液,溶液颜色变成棕黄色
(18年北京高考改)验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
下列说法不正确的是( )A . 对比①②,K3[Fe(CN)6]可能将Fe氧化B. 对比②③,可以判定Zn保护了Fe C. 验证Zn保护Fe时不能用①的方法 D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
注意:探究实验要注意对比、排除干扰、控制变量、空白对照
考向七 电化学原理的综合应用(与物质制备、实验、平衡融合)
【考查内容3】电化学原理与实验、平衡融合
(22年北京)利用下图装置进行铁电极上电镀铜的实验探究。
下列说法不正确 ( )
(1)实验验证实验I:将0.0100 ml/L Ag2SO4溶液与0.0400 ml/L FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。实验II:向少量Ag粉中加入0.0100 ml/L Fe2(SO4)3溶液(pH=1),固体完全溶解。
固体溶解,产生红棕色气体
酸性条件下,NO3—有氧化性,
【考查内容2】电化学原理与实验、平衡融合
③小组同学采用电化学装置从平衡移动角度进行验证。补全电化学装置示意图,写出操作及现象_______。
建立平衡;改变条件平衡会移动
a:石墨电极/Au电极/Pt电极
b:酸性FeSO4溶液、酸性Fe2(SO4)3溶液、酸性FeSO4与Fe2(SO4)3混合液体、Fe2+、Fe3+
C:AgNO3溶液、Ag2SO4溶液
装好溶液后,闭合K,当灵敏电流计当指针归零(反应达到平衡)向左池加入较浓Fe2(SO4)3溶液,指针偏转(改变条件,平衡发生移动)向右池加入较浓AgNO3溶液,指针反向偏转(改变条件,平衡发生移动)
实验Ⅲ:一定温度下,待实验Ⅰ中反应达到平衡状态时,取v mL上层清液,用C1 ml/L KSCN标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液v1 mL。
①滴定过程中Fe3+的作用是_______。
资料:Ag+ +SCN— AgSCN↓ k=1012 Fe3++SCN— FeSCN2+ K=102.3
(2)测定平衡常数 实验Ⅲ:一定温度下,待实验Ⅰ中反应达到平衡状态时,取v mL上层清液,用C1 ml/L KSCN标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液v1 mL。
②测得平衡常数K=_______。
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化优秀课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化优秀课件ppt,共37页。PPT课件主要包含了常用解题步骤,阳极产物,阴极产物,原电池,电解池,+O2↑等内容,欢迎下载使用。
专题6 电化学与金属防腐课件PPT: 这是一份专题6 电化学与金属防腐课件PPT,共60页。PPT课件主要包含了应用说明等内容,欢迎下载使用。
化学选择性必修1第二单元 化学能与电能的转化背景图课件ppt: 这是一份化学选择性必修1第二单元 化学能与电能的转化背景图课件ppt,共37页。PPT课件主要包含了常用解题步骤,阳极产物,阴极产物,原电池,电解池,+O2↑等内容,欢迎下载使用。












