


四川省宜宾市部分中学2022-2023学年高一下学期期中考试化学试题(Word版含答案)
展开宜宾市部分中学2022-2023学年高一下学期期中考试
化学试题
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在本试卷和答题卡上。
2.满分100分 时间75分钟
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Na 23 Fe 56
第I卷(选择题 42分)
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与人类生活密切相关,下列叙述错误的是
A.向煤中添加生石灰可以降低温室气体的排放
B.小苏打可作发酵剂、灭火剂
C.体积分数为75%的乙醇抑菌、消毒效果最好
D.高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂
2.下列有关物质的性质和用途具有对应关系的是
A.活性炭具有还原性,可用作制糖业的脱色剂
B.晶体硅的熔点高、硬度大,可用作制造半导体材料
C.二氧化氯具有强氧化性,可用作饮用水消毒
D.氯化铁溶液具有酸性,可用作刻蚀铜电路板
3.下列表达方式不正确的是
A.四氯化碳 B.氟化钠的电子式
C.硫离子的结构示意图 D. 碳-12原子
4.下列各组物质中化学键的类型相同的是
A.HCl MgCl2 NH4Cl
B.NH3 H2O CO2
C.CaCl2 NaOH H2S
D.H2O Na2O CO2
5.下列方程式书写正确的是
A.实验室制氨气: NH4ClNH3↑+HCl↑
B.氢氧化亚铁与硝酸反应: Fe(OH)2+ 2H+ =Fe2+ +2H2O
C.在氯化铝溶液中加入足量氨水: Al3++4OH- =AlO +2H2O
D.硫代硫酸钠与稀硫酸反应: S2O +2H+=SO2↑+S↓+H2O
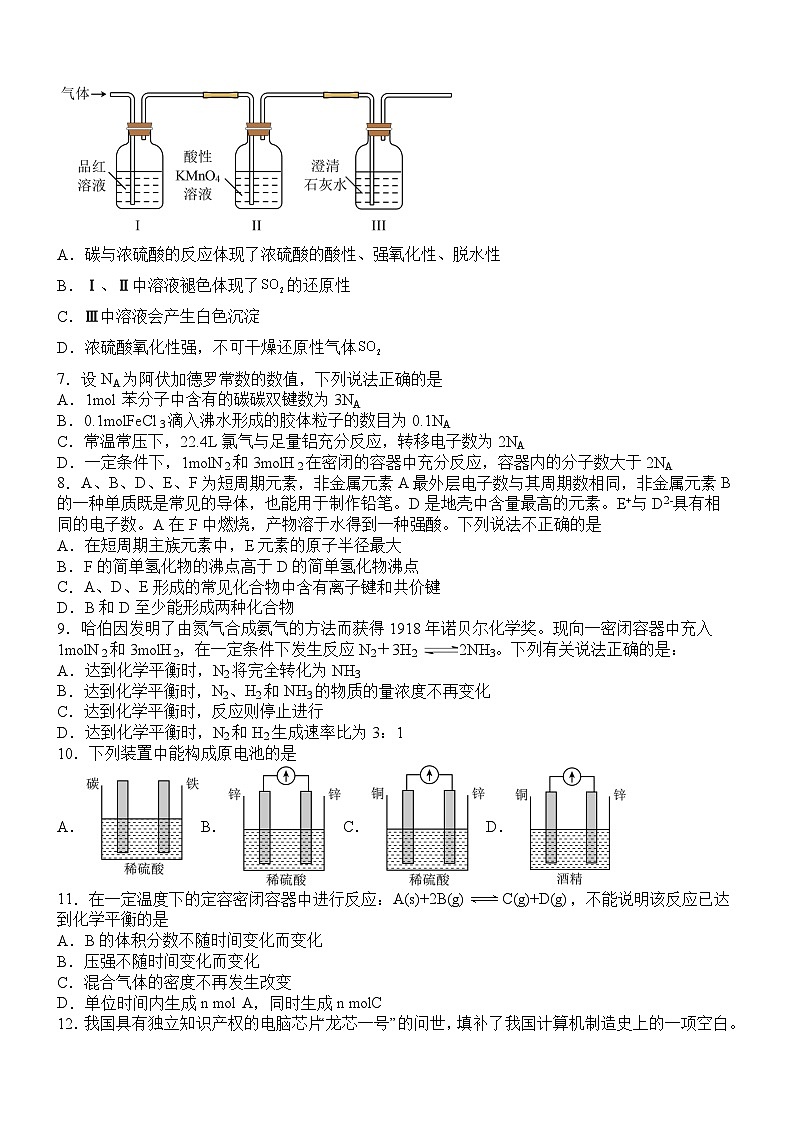
6.下图为碳与浓硫酸反应产物的探究实验,下列分析正确的是
A.碳与浓硫酸的反应体现了浓硫酸的酸性、强氧化性、脱水性
B.Ⅰ、Ⅱ中溶液褪色体现了的还原性
C.Ⅲ中溶液会产生白色沉淀
D.浓硫酸氧化性强,不可干燥还原性气体
7.设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol苯分子中含有的碳碳双键数为3NA
B.0.1molFeCl3滴入沸水形成的胶体粒子的数目为0.1NA
C.常温常压下,22.4L氯气与足量铝充分反应,转移电子数为2NA
D.一定条件下,1molN2和3molH2在密闭的容器中充分反应,容器内的分子数大于2NA
8.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,非金属元素B的一种单质既是常见的导体,也能用于制作铅笔。D是地壳中含量最高的元素。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。下列说法不正确的是
A.在短周期主族元素中,E元素的原子半径最大
B.F的简单氢化物的沸点高于D的简单氢化物沸点
C.A、D、E形成的常见化合物中含有离子键和共价键
D.B和D至少能形成两种化合物
9.哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下发生反应N2+3H22NH3。下列有关说法正确的是:
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
C.达到化学平衡时,反应则停止进行
D.达到化学平衡时,N2和H2生成速率比为3:1
10.下列装置中能构成原电池的是
A.B.C.D.
11.在一定温度下的定容密闭容器中进行反应:A(s)+2B(g)C(g)+D(g),不能说明该反应已达到化学平衡的是
A.B的体积分数不随时间变化而变化
B.压强不随时间变化而变化
C.混合气体的密度不再发生改变
D.单位时间内生成n mol A,同时生成n molC
12.我国具有独立知识产权的电脑芯片“龙芯一号”的问世,填补了我国计算机制造史上的一项空白。下列对硅及其化合物的有关叙述正确的是
A.二氧化硅既能与烧碱溶液反应又能与氢氟酸反应,所以二氧化硅是两性氧化物
B.晶体硅的化学性质不活泼,常温下不与任何物质发生反应
C.晶体硅是一种良好的半导体材料,但是它的提炼工艺复杂,价格极高
D.晶体硅和金刚石的硬度都很大
13.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。下列说法正确的是
A.t1min时该化学反应达到平衡状态
B.在4min时v正>v逆
C.4min内,CO2的转化率约为71.4%
D.4min内,CO的平均反应速率v(CO)=0.25mol•L-1•min-1
14.如图所示是几种常见的化学电源示意图,有关说法不正确的是
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池工作时,向锌筒移动
C.铅蓄电池工作过程中,负极质量增重
D.氢氧燃料电池的正极反应一定是
第II卷(非选择题 58分)
15.(12分)下表为元素周期表的一部分,回答以下问题:
|
|
| C | N |
| F |
|
(1)与的原子半径大小关系是:___________(填“>”或“<”)。
(2)F与的非金属性强弱顺序是:F___________(填“>”或“<”),其简单氢化物的稳定性较强的是___________(填化学式)。
(3)P、S两种元素的最高价氧化物对应水化物的酸性较弱的是___________(填化学式)。
(4)与组成所含的化学键类型为___________(填“离子键”或“共价键”)。
(5)地壳中含量最高的金属元素是___________,能用来做光导纤维的是___________元素的氧化物(填元素符号)。
(6)C位于元素周期表中第___________周期第___________族,易以碳碳键和碳氢键形成甲烷、乙烷、乙烯等烃类化合物。甲烷与乙烷属于___________(填“同系物”或“同分异构体”);乙烷与乙烯可相互转化,如:
生成的反应类型为___________
16.(10分)已知固体X由三种前四周期元素组成,其转化关系、实验流程和结果如下:
已知:①固体A、固体B的焰色试验均呈紫色
②气体C在标准状况下的密度为1.518 g·L-1。
请回答:
(1)气体C分子的电子式___________,白色沉淀D的化学式___________。
(2)固体X的化学式___________。
(3)固体X受热分解的化学方程式___________。
(4)固体X、固体A和碘单质以物质的量1∶1∶1发生反应,生成两种盐,请写出发生反应的化学方程式___________。
(5)设计实验证明固体X样品是否已经被氧化:___________。
17.(12分)根据下列转化关系(部分反应条件及产物已略去),A、B、C、D中均含有同一种元素,回答下列问题:
(1)若B是能使品红溶液褪色的气体,写出D的浓溶液与Cu在加热情况下反应的化学方程式_______________________________。
(2)若A是N2,则
①B转化为C的现象:_______________________________。
②写出过量Fe与D的稀溶液反应(还原产物只有B)的离子方程式_______________________________。
(3)若A是能使湿润的红色石蕊试纸变蓝的气体,则
①它与O2在高温、催化剂的作用下反应生成B,此化学方程式为
_______________________________。
②写出实验室用固体制取A气体的化学方程式_______________________________。
③若要收集B气体,下列收集装置中合适的是(填序号)______________。
④1.92g铜投入一定量D的浓溶液中,铜完全溶解,共收集到672mL气体(标准状况),则反应中消耗D 的物质的量为____________。
18.(12分)某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
(1)由图中所给数据进行分析,该反应的化学方程式为___________。
(2)若上述反应中X、Y、Z分别为、、,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol和2.0mol,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n() | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率___________,250s时,的转化率为___________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为。N≡N的键能为,H−H的键能为,N−H的键能为,则生成1mol过程中放出的能量为___________kJ。
(4)反应达平衡时容器内混合气体的平均相对分子质量比起始时___________(填“增大”“减小”或“不变”,下同),混合气体密度比起始时___________。
(5)为加快反应速率,可以采取的措施是___________(填字母)。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离
19.(12分)碱性锌锰电池是日常生活中常见的化学电源之一,其构造如图1,一种从废旧碱性锌锰电池回收Zn和的工艺如图2。
回答下列问题:
(1)中Mn元素的化合价为_______。
(2)碱性锌锰电池工作时正极反应式为_______。
(3)“净化”是为了除去浸出液中的杂质,方法是加入_______ (填化学式)溶液将氧化为,再调节pH使沉淀完全。废电解液中含有大量的可以返回_______工序中循环使用。
(4)若将“粉料”直接与浓盐酸共热反应后过滤,滤液的主要成分是和,同时生成一种黄绿色气体,“粉料”中的与浓盐酸共热反应的化学方程式为_______。
(5)“浸出”所得溶液经一系列操作后得,通过煅烧可制得生产软磁铁氧体材料的,下图是煅烧时温度与剩余固体质量变化曲线。该曲线中A段所表示物质的化学式为_______,中 _______。
四川省宜宾市叙州区第二中学校2022-2023学年高一下学期期末考试化学试题(Word版含答案): 这是一份四川省宜宾市叙州区第二中学校2022-2023学年高一下学期期末考试化学试题(Word版含答案),文件包含四川省宜宾市叙州区第二中学校2022-2023学年高一下学期期末考试化学试题docx、四川省宜宾市叙州区第二中学校2022-2023学年高一下学期期末考试化学试题答案docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
四川省泸州市部分中学2022-2023学年高一下学期期中考试化学试题(Word版含答案): 这是一份四川省泸州市部分中学2022-2023学年高一下学期期中考试化学试题(Word版含答案),文件包含四川省泸州市部分中学2022-2023学年高一下学期期中考试化学试题docx、四川省泸州市部分中学2022-2023学年高一下学期期中考试化学试题答案docx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
四川省宜宾市珙县中学校2022-2023学年高一下学期4月月考化学试题(Word版含答案): 这是一份四川省宜宾市珙县中学校2022-2023学年高一下学期4月月考化学试题(Word版含答案),文件包含四川省宜宾市珙县中学校2022-2023学年高一下学期4月月考化学试题docx、四川省宜宾市珙县中学校2022-2023学年高一下学期4月月考化学试题答案docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。












