
03 常考题空3 实验条件的多维控制 (附答案解析)-备战2023年高考化学大题逐空突破系列(全国通用)
展开
这是一份03 常考题空3 实验条件的多维控制 (附答案解析)-备战2023年高考化学大题逐空突破系列(全国通用),共7页。
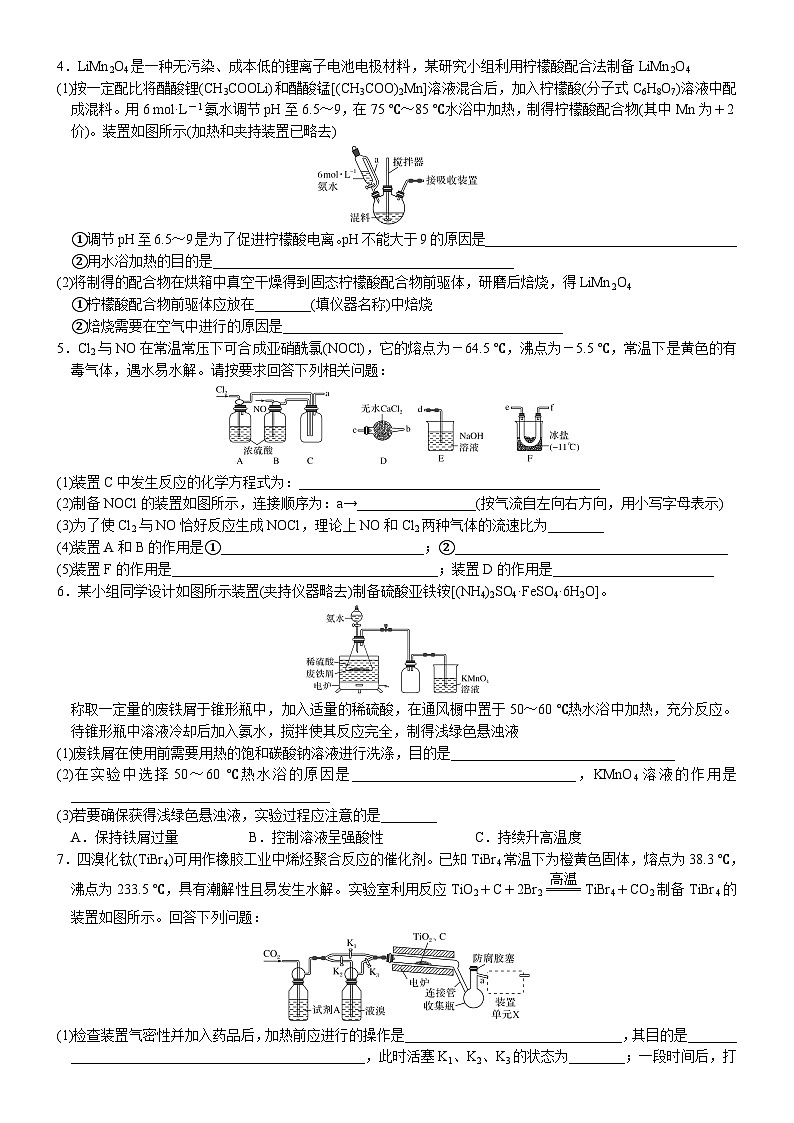
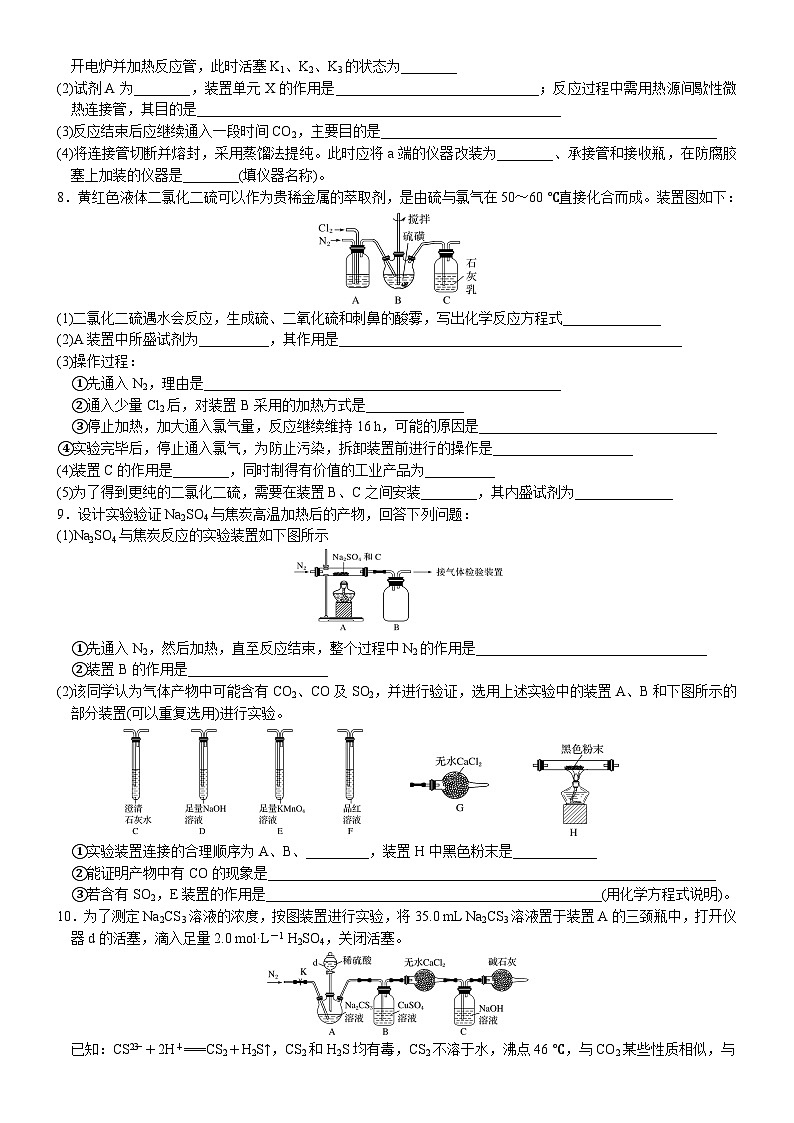
常考题空3 实验条件的多维控制【高考必备知识】1.温度控制(1)加热方式:直接加热、间接加热(隔石棉网加热和水浴加热)(2)控制温度的目的:提高反应速率、提高产率和转化率、减少副反应、提高产品纯度①加热的目的:加快反应速率或促进平衡向某个方向(一般是有利于生成物生成的方向)移动②控制温度在一定范围内进行的目的:a.若温度过低,则反应速率(或溶解速率)较慢b.若温度过高,某些物质会分解或挥发(如H2O2、NH4HCO3、氨水、盐酸、浓硝酸)或××物质挥发(如浓硝酸、浓盐酸)或××物质氧化(如Na2SO3等)或促进××物质水解(如AlCl3等)③冰水冷却的目的a.使某物质液化、降低产物的溶解度b.减少其他副反应,提高产品纯度2.控制气体的流速及用量装置图解题指导①使反应的气体混合均匀②根据液体中气泡的生成速率调节气体的混合比例③干燥气体3.排气方法及作用(1)防氧化、防水解为了防止空气的成分氧气、CO2、水蒸气干扰实验,常用其他稳定的气体(如氮气)排尽装置中的空气;有时也可充分利用反应物气体(如:氨气、氯气、二氧化硫)等排尽装置中的空气(2)定量测定气体实验中为了充分吸收某种需分析或测定的气体,常用其他稳定的气体(如氮气)作载气;有时也可充分利用反应物气体(如氧气)作载气,将生成的气体压入指定的吸收装置中【题组训练】1.ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。已知:无水草酸100 ℃可以升华。在制备ClO2时实验需在60~100 ℃进行的原因是_________________________________________________________________,控制所需温度的方法是_________2.某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。(1)通入氮气的目的是________________________________________(2)为防止倒吸,停止实验时应进行的操作是_________________________________________________________3.硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2(该反应ΔH>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O的装置如下:(1)装置B的作用是检验装置A中SO2的吸收效率,B中试剂是________,表明SO2吸收效率低的实验现象是B中溶液________(2)为了使SO2尽可能被吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是____________________________________________(任写一条)4.LiMn2O4是一种无污染、成本低的锂离子电池电极材料,某研究小组利用柠檬酸配合法制备LiMn2O4(1)按一定配比将醋酸锂(CH3COOLi)和醋酸锰[(CH3COO)2Mn]溶液混合后,加入柠檬酸(分子式C6H8O7)溶液中配成混料。用6 mol·L-1氨水调节pH至6.5~9,在75 ℃~85 ℃水浴中加热,制得柠檬酸配合物(其中Mn为+2价)。装置如图所示(加热和夹持装置已略去)①调节pH至6.5~9是为了促进柠檬酸电离。pH不能大于9的原因是____________________________________②用水浴加热的目的是___________________________________________(2)将制得的配合物在烘箱中真空干燥得到固态柠檬酸配合物前驱体,研磨后焙烧,得LiMn2O4①柠檬酸配合物前驱体应放在________(填仪器名称)中焙烧②焙烧需要在空气中进行的原因是________________________________________5.Cl2与NO在常温常压下可合成亚硝酰氯(NOCl),它的熔点为-64.5 ℃,沸点为-5.5 ℃,常温下是黄色的有毒气体,遇水易水解。请按要求回答下列相关问题:(1)装置C中发生反应的化学方程式为:___________________________________________(2)制备NOCl的装置如图所示,连接顺序为:a→_________________(按气流自左向右方向,用小写字母表示)(3)为了使Cl2与NO恰好反应生成NOCl,理论上NO和Cl2两种气体的流速比为________(4)装置A和B的作用是①_____________________________;②_______________________________________(5)装置F的作用是______________________________________;装置D的作用是_______________________6.某小组同学设计如图所示装置(夹持仪器略去)制备硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]。称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60 ℃热水浴中加热,充分反应。待锥形瓶中溶液冷却后加入氨水,搅拌使其反应完全,制得浅绿色悬浊液(1)废铁屑在使用前需要用热的饱和碳酸钠溶液进行洗涤,目的是________________________________(2)在实验中选择50~60 ℃热水浴的原因是________________________________,KMnO4溶液的作用是_____________________________________(3)若要确保获得浅绿色悬浊液,实验过程应注意的是________A.保持铁屑过量 B.控制溶液呈强酸性 C.持续升高温度7.四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3 ℃,沸点为233.5 ℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:(1)检查装置气密性并加入药品后,加热前应进行的操作是_______________________________,其目的是_________________________________________________,此时活塞K1、K2、K3的状态为________;一段时间后,打开电炉并加热反应管,此时活塞K1、K2、K3的状态为________(2)试剂A为________,装置单元X的作用是_____________________________;反应过程中需用热源间歇性微热连接管,其目的是____________________________________________________(3)反应结束后应继续通入一段时间CO2,主要目的是________________________________________________(4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为________、承接管和接收瓶,在防腐胶塞上加装的仪器是________(填仪器名称)。8.黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,是由硫与氯气在50~60 ℃直接化合而成。装置图如下:(1)二氯化二硫遇水会反应,生成硫、二氧化硫和刺鼻的酸雾,写出化学反应方程式______________(2)A装置中所盛试剂为__________,其作用是_________________________________________________(3)操作过程:①先通入N2,理由是___________________________________________________②通入少量Cl2后,对装置B采用的加热方式是______________③停止加热,加大通入氯气量,反应继续维持16 h,可能的原因是__________________________________④实验完毕后,停止通入氯气,为防止污染,拆卸装置前进行的操作是____________________(4)装置C的作用是________,同时制得有价值的工业产品为__________(5)为了得到更纯的二氯化二硫,需要在装置B、C之间安装________,其内盛试剂为______________9.设计实验验证Na2SO4与焦炭高温加热后的产物,回答下列问题:(1)Na2SO4与焦炭反应的实验装置如下图所示①先通入N2,然后加热,直至反应结束,整个过程中N2的作用是_________________________________②装置B的作用是____________________(2)该同学认为气体产物中可能含有CO2、CO及SO2,并进行验证,选用上述实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。 ①实验装置连接的合理顺序为A、B、_________,装置H中黑色粉末是____________②能证明产物中有CO的现象是________________________________________________________________③若含有SO2,E装置的作用是________________________________________________(用化学方程式说明)。10.为了测定Na2CS3溶液的浓度,按图装置进行实验,将35.0 mL Na2CS3溶液置于装置A的三颈瓶中,打开仪器d的活塞,滴入足量2.0 mol·L-1 H2SO4,关闭活塞。已知:CS+2H+===CS2+H2S↑,CS2和H2S均有毒,CS2不溶于水,沸点46 ℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O(1)反应开始时需要先通入一段时间N2,其作用为____________________________(2)B中发生反应的离子方程式是_____________________________________________(3)反应结束后打开止水夹K,再缓慢通入热N2一段时间,其目的是___________________________________(4)为了计算三硫代碳酸钠溶液的浓度,可测定B中生成沉淀的质量。称量B中沉淀质量之前需要进行的实验操作名称是______________,若B中生成沉淀的质量为8.4 g,则35.0 mL三硫代碳酸钠溶液的物质的量浓度是_____________(5)若反应结束后将通热N2改为通热空气,通过测定C中溶液质量的增加值来计算三硫代碳酸钠溶液的浓度时,计算值__________(填“偏高”“偏低”或“无影响”),原因是__________________________________________ 【常考题空3 实验条件的多维控制】答案1.高于60 ℃是为了加快反应速率,低于100 ℃是为了防止草酸升华 水浴加热2.(1)反应前,通过N2隔绝空气、反应后通N2使反应产生的气体全部进入后续装置(2)先熄灭装置A、E的酒精灯,冷却后停止通入氮气3.(1)品红(或溴水、酸性KMnO4溶液) 颜色很快褪去(或其他合理答案)(2)减慢SO2的通入速率(或适当升高装置A的温度或其他合理答案)4.(1)①碱性太强锂和锰离子会转化成沉淀 ②受热均匀,便于控制温度(2)①坩埚 ②产品中的锰化合价比柠檬酸配合物高需氧气氧化5.(1)2NO+Cl2===2NOCl (2)e,f→c,b→d(3)2∶1(4)干燥NO和Cl2 观察气泡控制气体流速(5)冷凝亚硝酰氯,便于收集 防止装置E中的水蒸气进入装置F6.(1)除去废铁屑上的油污(2)使受热均匀,加快反应速率,防止温度过高,氨水挥发过多,原料利用率低 吸收氨气、二氧化硫等杂质气体,防止污染空气(3)AB7.(1)打开K1,关闭K2、K3、通入CO2 排除装置内的空气,防止C粉被氧化 K1打开,K2、K3关闭 K2、K3打开,K1关闭(2)浓H2SO4 吸收挥发出的溴蒸气,且防止空气中的水蒸气进入 防止TiBr4在连接管处冷凝,堵塞导管(3)排出残留在装置中的TiBr4和溴蒸气,将溴蒸气全部赶入X装置,防止污染环境(4)冷凝管 温度计8.(1)2S2Cl2+2H2O===3S↓+SO2+4HCl(2)浓硫酸 干燥N2和Cl2,观察气泡控制气体的流速(3)①排尽装置中的空气,防止O2、水蒸气干扰实验 ②水浴加热 ③该反应是放热反应 ④继续通入N2至装置内呈无色(4)吸收尾气 漂白粉(5)干燥管 无水CaCl29.(1)①排出装置中的空气并将生成的气体吹出 ②安全瓶 (2)①F、E、F、C、D、C、G、H、C CuO ②H中黑色粉末变为红色,G前的C中澄清石灰水不变浑浊,H后的C中澄清石灰水变浑浊 ③5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO410.(1)排除装置中的空气,防止A中生成的H2S被氧化 (2)Cu2++H2S===CuS↓+2H+ (3)将装置中的H2S全部排入B中被充分吸收;将装置中的CS2全部排入C中被充分吸收 (4)过滤、洗涤、干燥 2.5 mol·L-1 (5)偏高 空气中含有CO2能被C中NaOH溶液吸收,导致C中的质量偏大,从而求得的Na2CS3偏多,因此计算值偏高解析:(1)A中生成的H2S易被空气中的氧气氧化,应排除装置中的空气。(2)CuSO4和H2S反应生成CuS沉淀和H2SO4。(3)装置中残留一部分H2S和CS2,通入热N2一段时间可以将残留的H2S和CS2全部排入B或C中被充分吸收。(4)由方程式可得关系式:CuS~Na2CS3,则c(Na2CS3)= mol·L-1=2.5 mol·L-1。
相关试卷
这是一份03 常考题空3 分压平衡常数(Kp)计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共19页。
这是一份03 常考题空3 等电子体、成键方式、晶体类型的判断 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共7页。
这是一份03 常考题空3 工艺流程中的分离与提纯 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共9页。









