





还剩16页未读,
继续阅读
第三单元物质构成的奥秘复习课件
展开
这是一份第三单元物质构成的奥秘复习课件,共24页。
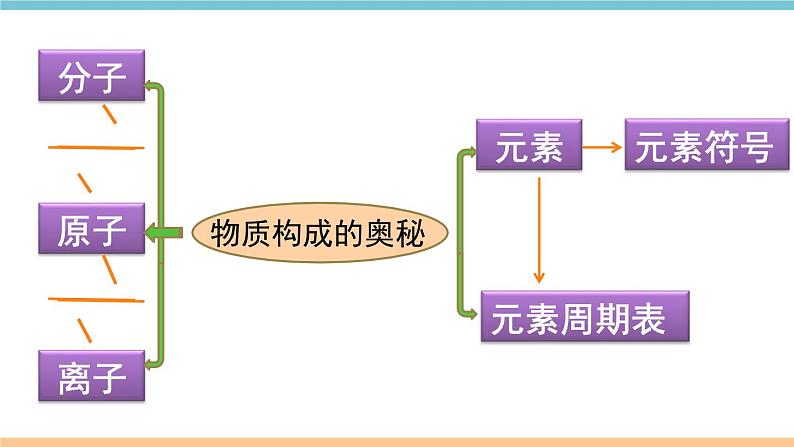
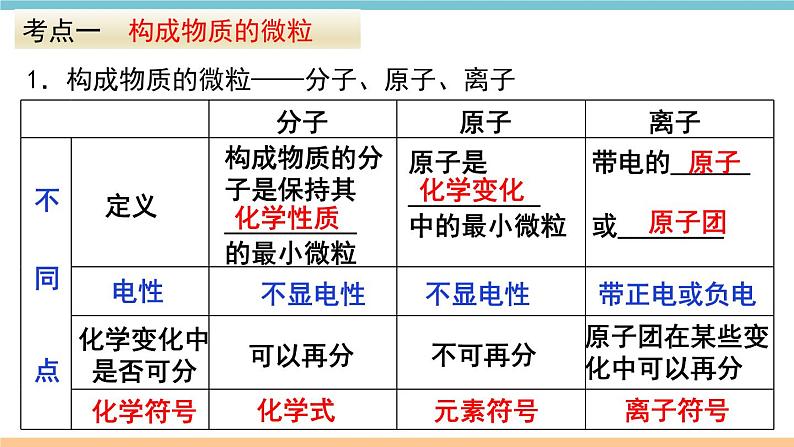
第三单元 物质构成的奥秘小结与复习物质构成的奥秘1.构成物质的微粒——分子、原子、离子考点一 构成物质的微粒不 同 点不可再分不显电性电性定义 离子带正电或负电不显电性化学变化中是否可分 原子 分子离子符号元素符号 化学式化学符号化学变化带电的______或________原子是__________中的最小微粒原子团在某些变化中可以再分构成物质的分子是保持其__________的最小微粒可以再分化学性质 原子 原子团 (续表) 2.用分子、原子的观点解释现象(1)物理变化:构成物质的________________ 变化;化学变化:____________________发生了变化,分裂成原子,原子重新组合成________,如水的电解、蜡烛的燃烧等。物理变化和化学变化的本质区别:分子是否发生改变(或是否生成新分子)。(2)由分子构成的物质中,________含有不同种分子,________含有同种分子。分子本身没有发生 构成物质的分子 新分子混合物 纯净物 【例1】(2018甘肃兰州中考)下到关于分子和原子的说法错误的是( )A. 分子和原子都能直接构成物质 B. 相同的原子可以构成不同的分子 C. 气体可以压缩是由于分子之间存在间隙 D. 分子可分,原子不可分解题思路:A、构成物质的微粒有分子、原子和离子,正确;B、相同的原子可以构成不同的分子,例如氧原子可以构成氧分子(O2)和臭氧分子(O3),正确;C、任何分子间都有间隔,正确;D、在化学变化中,分子可以再分,而原子不可以再分;选项没有限定是化学变化,所以原子也可以再分为质子、中子和核外电子,错误。故选D。D【练习1】【练习2】AB1.原子结构原子原子核核外电子质子中子(每个质子带一个单位正电荷)(不带电)(每个电子带一个单位的负电荷)(带正电)(带负电)原子里:核电荷数=质子数=核外电子数(不显电性)考点二 原子及其构成 相对原子质量 ≈ 质子数+中子数(原子的质量主要集中在原子核上)2.原子结构示意图金属原子非金属原子稀有气体原子原子核外电子排布有哪些共同特点不同种类原子的核外电子排布各有什么特点?【例2】(2018广东广州中考)右图为某粒子的结构示意图,下列说法正确的是( ) A.该粒子有12个质子 B.该粒子有2个电子层 C.该粒子属于非金属元素 D.该粒子已达到相对稳定结构解题思路:本题基于原子结构示意图考察原子可再分和原子核外电子排布,通过观察最外层电子数,判断是金属元素的原子还是非金属元素的原子,以及是否达到相对稳定结构。A1.离子的形成原子:离子:考点三 离子原子中:质子数=电子数(原子不带电)阳离子中:质子数>电子数(带正电) 阴离子中:质子数<电子数(带负电)2.原子和离子的区别和联系8、 已知R2+核外电子数为n,仍不能确定的是原子的( ) A.质子数 B. 中子数 C.核电荷数 D. 电子数B【练习3】3. 下列结构示意图中,表示金属离子的是( )D【练习4】考点四 元素1.元素元素是____________(即质子数)相同的一类原子的总称。(1)元素种类:100余种(由此组成了3000多万种物质)可分为________元素、________元素(包括稀有气体元素)。(2)地壳中含量前五位的元素(质量分数):__________________。(3)生物细胞中含量在前五位的元素:______________________。金属非金属氧、硅、铝、铁、钙氧、碳、氢、氮、钙 核电荷数2.元素符号一大二小意义写法表示一种元素;表示这种元素的一个原子 离子符号的书写你掌握了吗用化学符号表示:氮元素_______ 2个氮原子_____ 2个铁离子 n个硫离子_____氯离子________ 钠离子________ 【练习6】2NNNa+Cl-nS2-2Fe3+【练习5】(2018桂林中考)下列元素符号书写正确的 是( ) A.金aU B.锰Mn C.氦he D.银AGB 3.元素与原子的比较【例3】(2018湖北恩施州中考)甲、乙、丙、丁表示四种粒子的结构示意图,下列说法不正确的是( )A.甲、乙属于同种元素 B.甲、乙、丙具有相似化学性质 C.丁中x = 8 D.乙表示阴离子B解题策略:甲、乙的核电荷数相同,它们属于同种元素的粒子;元素的化学性质与原子的最外层电子数关系密切,甲、丙原子的最外层电子数相同,具有相似的化学性质。 A. B. C. D.A,B,CB,CA,B 右图粒子中1.属于非金属元素的是_____2.具有相似化学性质的是___ 3.属于同种元素的是_______【练习7】解题思路:对于原子结构示意图,最外层电子数相同的,其化学性质相似;根据最外层电子数判断是金属元素还是非金属元素。对于原子和离子结构示意图,核内质子数相同的属于同种元素。考点五 元素周期表元素周期表的结构(1)每一格提供了哪些信息? (2)每一横行(即______):周期表每一横行叫作一个周期。共有____个横行,有____个周期。(3)每一纵行(即______):周期表的18个纵行中,除第8、9、10三个纵行共同组成一个族外,其余15个纵行,每一个纵行叫作一个族,共有16个族。周期77族【例4】(2018新疆中考)核电荷数为1~18的元素的原子结构示意图等信息如图。请回答下列问题。(2)同周期元素,从左到右,各元素原子核外电子层数随原子序数的增加依次_____。(3)从Na、Mg原子结构示意图推知,金属Na、Mg化学性质不同的原因是________________________。最外层电子数不同递增你还能发现哪些周期性规律?【练习8】C【练习9】D具有相同核电荷数的一类原子元素原子分子离子稀有气体、金属等氧气、水、氯化氢等氯化钠等聚集构成构成得到或失去电子构成分解总结:物质与其构成粒子之间的关系物质相对原子质量元素周期表元素符号 易错点归纳1.元素、原子、分子、离子的概念易混淆。2.原子、离子结构及示意图识别的错误。3.化学符号和其中数字的意义分辨不清。4.离子符号和化合价的标注方法混淆。
第三单元 物质构成的奥秘小结与复习物质构成的奥秘1.构成物质的微粒——分子、原子、离子考点一 构成物质的微粒不 同 点不可再分不显电性电性定义 离子带正电或负电不显电性化学变化中是否可分 原子 分子离子符号元素符号 化学式化学符号化学变化带电的______或________原子是__________中的最小微粒原子团在某些变化中可以再分构成物质的分子是保持其__________的最小微粒可以再分化学性质 原子 原子团 (续表) 2.用分子、原子的观点解释现象(1)物理变化:构成物质的________________ 变化;化学变化:____________________发生了变化,分裂成原子,原子重新组合成________,如水的电解、蜡烛的燃烧等。物理变化和化学变化的本质区别:分子是否发生改变(或是否生成新分子)。(2)由分子构成的物质中,________含有不同种分子,________含有同种分子。分子本身没有发生 构成物质的分子 新分子混合物 纯净物 【例1】(2018甘肃兰州中考)下到关于分子和原子的说法错误的是( )A. 分子和原子都能直接构成物质 B. 相同的原子可以构成不同的分子 C. 气体可以压缩是由于分子之间存在间隙 D. 分子可分,原子不可分解题思路:A、构成物质的微粒有分子、原子和离子,正确;B、相同的原子可以构成不同的分子,例如氧原子可以构成氧分子(O2)和臭氧分子(O3),正确;C、任何分子间都有间隔,正确;D、在化学变化中,分子可以再分,而原子不可以再分;选项没有限定是化学变化,所以原子也可以再分为质子、中子和核外电子,错误。故选D。D【练习1】【练习2】AB1.原子结构原子原子核核外电子质子中子(每个质子带一个单位正电荷)(不带电)(每个电子带一个单位的负电荷)(带正电)(带负电)原子里:核电荷数=质子数=核外电子数(不显电性)考点二 原子及其构成 相对原子质量 ≈ 质子数+中子数(原子的质量主要集中在原子核上)2.原子结构示意图金属原子非金属原子稀有气体原子原子核外电子排布有哪些共同特点不同种类原子的核外电子排布各有什么特点?【例2】(2018广东广州中考)右图为某粒子的结构示意图,下列说法正确的是( ) A.该粒子有12个质子 B.该粒子有2个电子层 C.该粒子属于非金属元素 D.该粒子已达到相对稳定结构解题思路:本题基于原子结构示意图考察原子可再分和原子核外电子排布,通过观察最外层电子数,判断是金属元素的原子还是非金属元素的原子,以及是否达到相对稳定结构。A1.离子的形成原子:离子:考点三 离子原子中:质子数=电子数(原子不带电)阳离子中:质子数>电子数(带正电) 阴离子中:质子数<电子数(带负电)2.原子和离子的区别和联系8、 已知R2+核外电子数为n,仍不能确定的是原子的( ) A.质子数 B. 中子数 C.核电荷数 D. 电子数B【练习3】3. 下列结构示意图中,表示金属离子的是( )D【练习4】考点四 元素1.元素元素是____________(即质子数)相同的一类原子的总称。(1)元素种类:100余种(由此组成了3000多万种物质)可分为________元素、________元素(包括稀有气体元素)。(2)地壳中含量前五位的元素(质量分数):__________________。(3)生物细胞中含量在前五位的元素:______________________。金属非金属氧、硅、铝、铁、钙氧、碳、氢、氮、钙 核电荷数2.元素符号一大二小意义写法表示一种元素;表示这种元素的一个原子 离子符号的书写你掌握了吗用化学符号表示:氮元素_______ 2个氮原子_____ 2个铁离子 n个硫离子_____氯离子________ 钠离子________ 【练习6】2NNNa+Cl-nS2-2Fe3+【练习5】(2018桂林中考)下列元素符号书写正确的 是( ) A.金aU B.锰Mn C.氦he D.银AGB 3.元素与原子的比较【例3】(2018湖北恩施州中考)甲、乙、丙、丁表示四种粒子的结构示意图,下列说法不正确的是( )A.甲、乙属于同种元素 B.甲、乙、丙具有相似化学性质 C.丁中x = 8 D.乙表示阴离子B解题策略:甲、乙的核电荷数相同,它们属于同种元素的粒子;元素的化学性质与原子的最外层电子数关系密切,甲、丙原子的最外层电子数相同,具有相似的化学性质。 A. B. C. D.A,B,CB,CA,B 右图粒子中1.属于非金属元素的是_____2.具有相似化学性质的是___ 3.属于同种元素的是_______【练习7】解题思路:对于原子结构示意图,最外层电子数相同的,其化学性质相似;根据最外层电子数判断是金属元素还是非金属元素。对于原子和离子结构示意图,核内质子数相同的属于同种元素。考点五 元素周期表元素周期表的结构(1)每一格提供了哪些信息? (2)每一横行(即______):周期表每一横行叫作一个周期。共有____个横行,有____个周期。(3)每一纵行(即______):周期表的18个纵行中,除第8、9、10三个纵行共同组成一个族外,其余15个纵行,每一个纵行叫作一个族,共有16个族。周期77族【例4】(2018新疆中考)核电荷数为1~18的元素的原子结构示意图等信息如图。请回答下列问题。(2)同周期元素,从左到右,各元素原子核外电子层数随原子序数的增加依次_____。(3)从Na、Mg原子结构示意图推知,金属Na、Mg化学性质不同的原因是________________________。最外层电子数不同递增你还能发现哪些周期性规律?【练习8】C【练习9】D具有相同核电荷数的一类原子元素原子分子离子稀有气体、金属等氧气、水、氯化氢等氯化钠等聚集构成构成得到或失去电子构成分解总结:物质与其构成粒子之间的关系物质相对原子质量元素周期表元素符号 易错点归纳1.元素、原子、分子、离子的概念易混淆。2.原子、离子结构及示意图识别的错误。3.化学符号和其中数字的意义分辨不清。4.离子符号和化合价的标注方法混淆。
相关资料
更多









