

所属成套资源:2023新教材高考化学二轮专题复习(15份)
2023新教材高考化学二轮专题复习专题13化学反应原理综合考查
展开
这是一份2023新教材高考化学二轮专题复习专题13化学反应原理综合考查,共30页。
专题十三 化学反应原理综合考查
真题研练·析考情
【真 题 研 练】
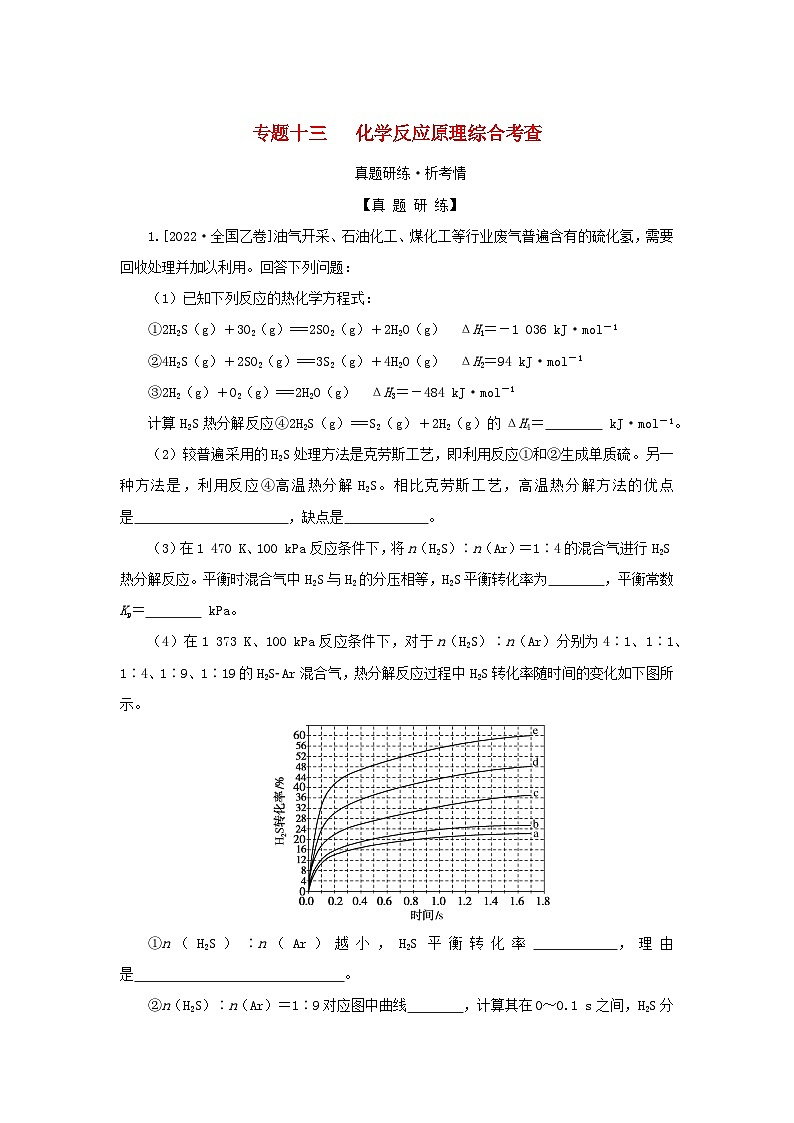
1.[2022·全国乙卷]油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)===2SO2(g)+2H2O(g) ΔH1=-1 036 kJ·mol-1
②4H2S(g)+2SO2(g)===3S2(g)+4H2O(g) ΔH2=94 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-484 kJ·mol-1
计算H2S热分解反应④2H2S(g)===S2(g)+2H2(g)的ΔH4= kJ·mol-1。
(2)较普遍采用的H2S处理方法是克劳斯工艺,即利用反应①和②生成单质硫。另一种方法是,利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是 ,缺点是 。
(3)在1 470 K、100 kPa反应条件下,将n(H2S)∶n(Ar)=1∶4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为 ,平衡常数Kp= kPa。
(4)在1 373 K、100 kPa反应条件下,对于n(H2S)∶n(Ar)分别为4∶1、1∶1、1∶4、1∶9、1∶19的H2SAr混合气,热分解反应过程中H2S转化率随时间的变化如下图所示。
①n(H2S)∶n(Ar)越小,H2S平衡转化率 ,理由是 。
②n(H2S)∶n(Ar)=1∶9对应图中曲线 ,计算其在0~0.1 s之间,H2S分压的平均变化率为 kPa·s-1。
2.[2022·湖北卷]自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al-H2O”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(ΔT)随时间(t)的变化曲线,如图所示。
实验编号
a
b
c
d
e
反应物组成
0.2 g CaO粉末,5.0 mL H2O
0.15 g Al粉,5.0 mL H2O
0.15 g Al粉,5.0 mL饱和石灰水
0.15 g Al粉,5.0 mL石灰乳
0.15 g Al粉,0.2 g CaO粉末,5.0 mL H2O
回答下列问题:
(1)已知:
①CaO(s)+H2O(l)===Ca(OH)2(s) ΔH1=-65.17 kJ·mol-1
②Ca(OH)2(s)===Ca2+(aq)+2OH-(aq) ΔH2=-16.73 kJ·mol-1
③Al(s)+OH-(aq)+3H2O(l)===[Al(OH)4]-(aq)+32H2(g) ΔH3=-415.0 kJ·mol-1
则CaO(s)+2Al(s)+7H2O(l)===Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g)的ΔH4= kJ·mol-1。
(2)温度为T时,Ksp[Ca(OH)2)]=x,则Ca(OH)2 饱和溶液中c(OH-)= (用含x的代数式表示)。
(3)实验a中,4 min后ΔT基本不变,原因是 。
(4)实验b中,ΔT的变化说明Al粉与H2O在该条件下 (填“反应”或“不反应”)。实验c中,前3 min的ΔT有变化,其原因是 ;3 min后ΔT基本不变,其原因是 微粒的量有限。
(5)下列说法不能解释实验d在10 min内温度持续升高的是 (填标号)。
A.反应②的发生促使反应①平衡右移
B.反应③的发生促使反应②平衡右移
C.气体的逸出促使反应③向右进行
D.温度升高导致反应速率加快
(6)归纳以上实验结果,根据实验e的特征,用文字简述其发热原理________________________________________________________________________。
3.[2022·山东卷]利用γ-丁内酯(BL)制备1,4-丁二醇(BD),反应过程中伴有生成四氢呋喃(THF)和1-丁醇(BuOH)的副反应,涉及反应如下:
已知:①反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ、Ⅲ的影响;②因反应Ⅰ在高压H2氛围下进行,故H2压强近似等于总压。回答下列问题:
(1)以5.0×10-3 mol BL或BD为初始原料,在493 K、3.0×103 kPa的高压H2氛围下,分别在恒压容器中进行反应。达平衡时,以BL为原料,体系向环境放热X kJ;以BD为原料,体系从环境吸热Y kJ。忽略副反应热效应,反应Ⅰ焓变ΔH(493 K,3.0×103 kPa)=________kJ·mol-1。
(2)初始条件同上。xi表示某物种i的物质的量与除H2外其它各物种总物质的量之比,xBL和xBD随时间t变化关系如图甲所示。实验测X”“<”或“=”)。
考向2平衡常数的计算与应用
例4[2021·全国乙卷节选]一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(2)氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2,376.8 ℃时平衡常数K′p=1.0×104Pa2。在一硬质玻璃烧瓶中加入过量BaPtCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在376.8 ℃,碘蒸气初始压强为20.0 kPa。376.8 ℃平衡时,测得烧瓶中压强为32.5 kPa,则pICl= kPa,反应2ICl(g)===Cl2(g)+I2(g)的平衡常数K=________________________________________________________________________
(列出计算式即可)。
(3)McMorris测定和计算了在136~180 ℃范围内下列反应的平衡常数Kp :
2NO(g)+2ICl(g)⇌2NOCl(g)+I2(g) Kp1
2NOCl(g)⇌2NO(g)+Cl2(g) Kp2
得到lg Kp1~1T和lg Kp2~1T均为线性关系,如下图所示:
①由图可知,NOCl分解为NO和Cl2反应的ΔH 0(填“大于”或“小于”)。
②反应2ICl(g)===Cl2(g)+I2(g)的K= (用Kp1、Kp2表示);该反应的ΔH_____________0(填“大于”或“小于”),写出推理过程________________________________________________________________________
________________________________________________________________________。
[题型分析] 关于平衡常数的有关计算是高考的必考点,就呈现形式而言,在经典题型的基础上又出现了多反应平衡体系和数形结合的图像题,在浓度常数的基础上又延伸出了压强常数和物质的量分数常数,常用“三段式”法和守恒法进行计算。
2023年高考可能这样考
4.[2022·重庆市模拟](1)一定条件下,向容积恒定为2 L的密闭容器中加入0.10 mol CO2和0.40 mol NH3,发生反应2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g),60 min开始达到平衡。反应中CO2的物质的量随时间变化如下表所示:
时间/min
0
20
60
80
n(CO2)/mol
0.10
0.06
0.04
0.04
①60 min时,上述反应的平均反应速率v(CO2)= 。
②NH3的平衡转化率为 。
(2)一定条件下,恒容容器中,若原料气中的NH3和CO2的物质的量之比nNH3nCO2=x,发生反应2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g),x与CO2的平衡转化率(α)的关系如图所示:
①α随着x增大而增大的原因是________________________________________________________________________
________________________________________________________________________。
②A点平衡时容器内总压强为p0 kPa,则上述反应的平衡常数Kp= 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
模考精练·抓落实
1.[2022·天津市津南区一模]我国研发了一种新型催化剂,可以通过反应2NO(g)+2H2(g)⇌N2(g)+2H2O(g) ΔH达到消除NO污染的效果。
已知:Ⅰ.4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) ΔH1=-1 808 kJ·mol-1;
Ⅱ.N2(g)+3H2(g)⇌2NH3(g) ΔH2=-92.4 kJ·mol-1。
回答下列问题:
(1)若在密闭容器中同时发生反应Ⅰ和反应Ⅱ,反应Ⅱ对反应Ⅰ中NO的平衡转化率的影响为 (填“增大”“减小”或“无影响”)。
(2)2NO(g)+2H2(g)⇌N2(g)+2H2O(g)的ΔH= (保留四位有效数字)。
(3)T1℃时,向填充催化剂的10 L恒容密闭容器甲中充入2 mol NO和2 mol H2,发生反应2NO(g)+2H2(g)⇌N2(g)+2H2O(g)。10 min末反应达到平衡时测得N2的物质的量为0.8 mol。
①0~10 min内,用NO的浓度变化表示的平均反应速率v(NO)= 。
②反应的平衡常数Kc= L·mol-1。
③若起始向填充催化剂的10 L恒容密闭容器乙中充入1 mol NO(g)、1 mol H2(g)、2 mol N2(g)、2 mol H2O(g)。甲、乙容器中平衡时气体压强之比 815(填“>”“”“lg [Kp2(T)·Kp1(T)],K(T′)>K(T)
4.解析:(1)①根据表中数据可知,60 min时,上述反应的平均反应速率v(CO2)=0.10-0.04mol2 L60 min=5.00×10-4 mol·L-1·min-1;②平衡时CO2的物质的量减少0.10 mol-0.04 mol=0.06 mol,根据反应2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)可知NH3应该减少0.12 mol,故NH3的平衡转化率为0.12 mol0.40 mol×100%=30%;
(2)①如果c(CO2)不变,原料气中的NH3和CO2的物质的量之比x越大即nNH3nCO2越大,则c(NH3)越大,平衡正向移动CO2平衡转化率α增大;②A点平衡时容器内总压强为p0 kPa,nNH3nCO2=x=3.0,α=0.50,设NH3和CO2的物质的量分别为3.0 mol和1.0 mol,根据三段式有:
2NH3g+CO2g⇌H2Og+ CONH22l
初始量(mol) 3 1 0
转化量(mol) 1 0.5 0.5
平衡量(mol) 2 0.5 0.5
则上述反应的平衡常数Kp=0.53×p0kPa0.53×p0 kPa×23×p0 kPa2=94p02(kPa)-2。
答案:(1) ① 5.00×10-4mol·L-1·min-1 ②30%
(2)①如果c(CO2)不变,x越大,则c(NH3)越大,平衡正向移动CO2平衡转化率增大 ②94p02(kPa)-2
模考精练·抓落实
1.解析:(1)反应Ⅱ可以减小N2(g)浓度,同时增大NH3(g)浓度,使反应Ⅰ平衡正向移动,增大NO的平衡转化率。
(2)根据盖斯定律,(Ⅰ+Ⅱ×2)÷3得,2NO(g)+2H2(g)⇌N2(g)+2H2O(g)的ΔH≈-664.3 kJ·mol-1。
(3)由题意可得三段式:
2NOg+ 2H2g⇌N2g+2H2Og
起始(mol) 2 2 0 0
变化(mol) 1.6 1.6 0.8 1.6
终止(mol) 0.4 0.4 0.8 1.6
①0~10 min内,用NO的浓度变化表示的平均反应速率v(NO)=1.6 mol10 L10 min=0.016 mol·L-1·min-1。
②反应的平衡常数Kc=1.6 mol10 L2×0.8 mol10 L0.4 mol10 L2×0.4 mol10 L2=800 L·mol-1。
③甲中平衡时气体总物质的量为3.2 mol,乙中起始气体总物质的量为6 mol,物质的量之比等于压强之比,则甲中平衡时气体压强与乙中起始气体压强之比为815。乙中浓度商Qc=2 mol10 L2×2 mol10 L1 mol10 L2×1 mol10 L2=80 L·mol-1 甲中平衡气体压强与乙中起始气体压强之比为815,乙中浓度商Qc
相关试卷
这是一份新教材2024高考化学二轮专题复习专题13化学反应原理综合考查真题研练,共10页。试卷主要包含了9kJ·ml-1,1kJ·ml-1,88的曲线代表平衡转化率,2kJ·ml-1,17kJ·ml-1,76等内容,欢迎下载使用。
这是一份新教材2024高考化学二轮专题复习专题13化学反应原理综合考查模考精练,共7页。试卷主要包含了4kJ·ml-1,8ml,0×10-6,0×107Pa,HI的分压为3等内容,欢迎下载使用。
这是一份新教材2024高考化学二轮专题复习专题13化学反应原理综合考查课时作业,共10页。试卷主要包含了75、xN2=0等内容,欢迎下载使用。









