

所属成套资源:2023新教材高考化学二轮专题复习(15份)
2023新教材高考化学二轮专题复习专题14物质结构与性质
展开
这是一份2023新教材高考化学二轮专题复习专题14物质结构与性质,共39页。
专题十四物质结构与性质
真题研练·析考情
【真 题 研 练】
1.[2022·全国甲卷]2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2===CH2)与四氟乙烯(CF2===CF2)的共聚物(ETFE)制成。回答下列问题:
(1)基态F原子的价电子排布图(轨道表示式)为________。
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是________(填标号),判断的根据是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
第三电离能的变化图是________(填标号)。
(3)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构________。
(4)CF2===CF2和ETFE分子中C的杂化轨道类型分别为________和________;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因________。
(5)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是________;若该立方晶胞参数为a pm,正负离子的核间距最小为________ pm。
2.[2022·山东卷]研究笼形包合物结构和性质具有重要意义。化学式为Ni(CN)x·Zn(NH3)y·zC6H6的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为a=b≠c,α=β=γ=90°。回答下列问题:
(1)基态Ni原子的价电子排布式为________,在元素周期表中位置为__________________。
(2)晶胞中N原子均参与形成配位键,Ni2+与Zn2+的配位数之比为________;x∶y∶z=________。
(3)吡啶()替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的∏66大π键、则吡啶中N原子的价层孤电子对占据________(填标号)。
A.2s轨道 B.2p轨道
C.sp杂化轨道 D.sp2杂化轨道
(4)在水中的溶解度,吡啶远大于苯,主要原因是①________________,②________________。
(5)的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是________。
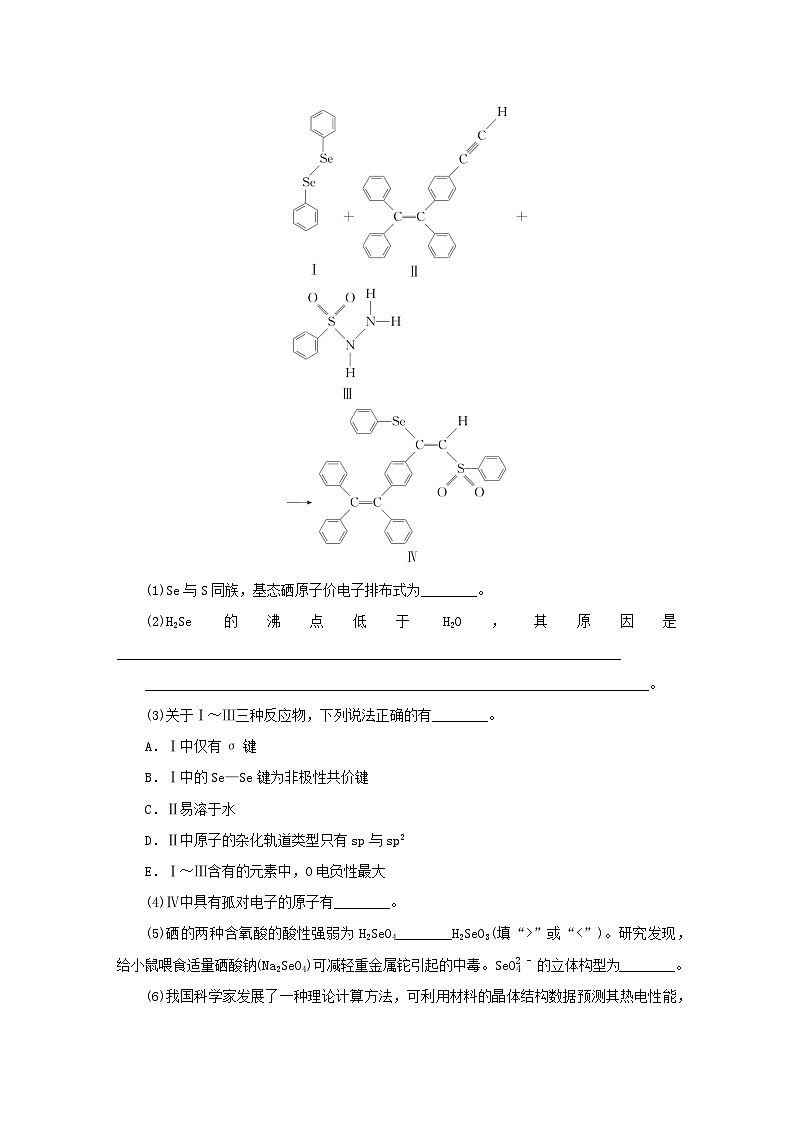
3.[2022·广东卷]硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
(1)Se与S同族,基态硒原子价电子排布式为________。
(2)H2Se的沸点低于H2O,其原因是________________________________________________________________________
________________________________________________________________________。
(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有________。
A.Ⅰ中仅有σ键
B.Ⅰ中的Se—Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与sp2
E.Ⅰ~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有________。
(5)硒的两种含氧酸的酸性强弱为H2SeO4________H2SeO3(填“>”或“m时,未成对电子数为2m-n。
②根据电子排布图判断
电子排布图能够直观地表示未成对电子数,即单独占据一个方框的箭头的个数。
2.第一电离能、电负性
(1)规律:在元素周期表中,元素的第一电离能从左到右总体呈增大的趋势,从上向下逐渐减小,电负性从左到右逐渐增大,从上向下逐渐减小。如C、N、O、F元素。第一电离能由大到小顺序为F>N>O>C,电负性由大到小顺序为:F>O>N>C。
(2)特例:同周期主族元素,第ⅡA族(ns2)全充满、ⅤA族(np3)半充满,比较稳定,所以其第一电离能大于同周期相邻的ⅢA和ⅥA族元素。
(3)判断:常应用化合价及物质类别判断电负性的大小,如O与Cl的电负性比较:
①HClO中Cl为+1价、O为-2价,可知O的电负性大于Cl;
②Al2O3是离子化合物,AlCl3是共价化合物,可知O的电负性大于Cl。
典 题 精 研
考向核外电子排布的表示方法及应用
例1 (1)[2022·海南卷节选]基态O原子的电子排布式________,其中未成对电子有________个。
(2)[2021·湖南选择考节选]基态硅原子最外层的电子排布图为________。
(3)[2021·河北选择考节选]原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+12表示,与之相反的用-12表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为________________________________________________________。
(4)[2020·全国卷Ⅰ节选]基态Fe2+与Fe3+离子中未成对的电子数之比为________。
[题型分析] 高考题常以给定元素化合物为载体,全面考查原子核外电子排布概念、电子排布式书写及元素性质比较。命题角度主要有原子核外电子的运动状态、能量状态、空间运动状态等,原子核外电子排布式、价电子排布式、电子排布图的书写。
2023年高考可能这样考
1.按要求填空
(1)[2022·云南省一模]基态Pb原子的价电子排布式为________,N能层电子数有________个。
(2)[2022·四川省南充市二诊]基态氮原子的价电子轨道表达式为________,
(3)[2022·云南省昆明市一模]Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中处于________区,未成对电子数是________。
(4)[2022·山东省济宁市一模]基态钛原子的px原子轨道上的电子数为________个。
(5)[2022·山东省青岛市一模] 铬在元素周期表中的位置为____________,其基态原子核外电子占据的原子轨道数为________。
例2 (1)[2021·湖南卷节选]H、C、N的电负性由大到小的顺序为____________________。
(2)[2020·全国Ⅰ卷节选]Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是________________________。I1(Be)>I1(B)>I1(Li),原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
[题型分析] 高考题常以给定元素化合物为载体,考查元素的电负性、电离能比较及原因解释。
2023年高考可能这样考
2.(1)与钛同周期的第ⅡB族和ⅢA族两种元素中第一电离能较大的是____________(写元素符号)。
(2)钛铬合金是一种高温结构材料,第二电离能I2(Ti)________(填“>”或“双键—单键>单键—单键。
(3)杂化类型相同,中心原子孤电子对数越多,键角越小,如键角:CH4>NH3>H2O;NH4+>NH3;H3O+>H2O。
(4)杂化类型和孤电子对数均相同,中心原子的电负性越大,键角越大,如键角:NH3>PH3>AsH3。
(5)杂化类型和孤电子对数相同,配位原子电负性越大,键角越小,如键角:NF3”“氢键>范德华力
影响因素
组成和结构相似的物质,相对分子质量越大,范德华力越大
形成氢键元素的电负性
原子半径
对性质
的影响
影响物质的熔点、沸点、溶解度等物理性质
分子间氢键使熔、沸点升高,溶解度增大
键能越大,
稳定性越强
3.晶体熔、沸点高低的比较
(1)一般情况下,不同类型晶体的熔、沸点高低规律:共价晶体>离子晶体>分子晶体,如:金刚石>NaCl>Cl2;(金属晶体熔、沸点有的很高,如钨、铂等;有的则很低,如汞等)。
(2)形成共价晶体的原子半径越小、键长越短,则键能越大,其熔、沸点越高,如:金刚石>石英>碳化硅>晶体硅。
(3)形成离子晶体的阴、阳离子的电荷数越多,离子半径越小,则离子键越强,熔、沸点就越高,如:MgO>MgCl2;NaCl>CsCl。
(4)金属晶体中金属离子半径越小,离子所带电荷数越多,其形成的金属键越强,金属单质的熔、沸点就越高,如Al>Mg>Na。
(5)分子晶体的熔、沸点比较规律
①组成和结构相似的分子晶体,相对分子质量越大,其熔、沸点就越高,如:HI>HBr>HCl;
②组成和结构不相似的分子,分子极性越大,其熔、沸点就越高,如:CO>N2;
③同分异构体分子中,支链越少,其熔、沸点就越高,如:正戊烷>异戊烷>新戊烷;
④同分异构体中的芳香烃及其衍生物的沸点,邻位取代物>间位取代物>对位取代物,如:邻二甲苯>间二甲苯>对二甲苯。
【典 题 精 研】
考向物质性质的比较与解释
例4 (1)[2021·全国乙卷节选][Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。
NH3的沸点比PH3的________,原因是________________________________________________________________________
________________________________________________________________________。
(2)[2020·浙江卷节选]①气态氢化物热稳定性HF大于HCl的主要原因是________________________________________________________________________
________________________________________________________________________。
②常温下,在水中的溶解度乙醇大于氯乙烷,原因是________________________________________________________________________
________________________________________________________________________。
(3)[2020·全国卷Ⅱ节选]钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是________________________________________________________________________
________________________________________________________________________。
化合物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-24.12
38.3
155
[题型分析] 高考常以分子、离子以及晶体为载体考察,分子的极性判断,分子的熔沸点、溶解性分析、比较,晶体类型的判断及熔沸点的比较,要关注边沿知识的考查。
2023年高考可能这样考
4.(1)氨硼烷(NH3BH3)在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,但熔点比金刚石低,原因是______________________________________________________
________________________________________________________________________。
(2)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:①r(Fe2+)为61 pm,r(Co2+)为65 pm。②隔绝空气加热:FeCO3高温===FeO+CO2↑;CoCO3高温===CoO+CO2↑。分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是________________________________________________________________________
________________________________________________________________________。
(3)①GaCl3的熔点为77.9 ℃,沸点为201.3 ℃;而GaN的熔点为1 700 ℃,其原因是________________________________________________________________________
________________________________________________________________________。
②H2O、H2S、H2Te的沸点由高到低的顺序为________。
③Cu和K属于同一周期元素,且原子核外最外层电子排布相同,但金属Cu的熔点比金属K的高,原因是______________________________________________________________
________________________________________________________________________。
(4)已知苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“”或“ 正四面体形
(6)①K2SeBr6 ②12×34MrNAρ×107
4.解析:(1)基态F原子共有9个核外电子,则每个电子都有对应的轨道和自旋状态,所以核外电子的运动状态有9种;(2)电负性一定程度上相当于得电子能力,半径越小,得电子能力越强,电负性越大,半径由小到大的顺序为F、O、Cl,所以电负性大小顺序为F>O>Cl;根据VSEPR理论,价层电子对数有2+6-1×22=4,去掉2对孤对电子,知OF2分子的空间构型是V形;OF2和Cl2O都是分子晶体,结构相似,Cl2O的相对分子质量大,Cl2O的熔、沸点高;(3)XeF2易升华,所以是分子晶体,其中心原子的价层电子对数为2+8-1×22=5,其中心原子的杂化方式应为 sp3d;(4)图中大球的个数为8×18+1=2,小球的个数为8×14+2=4,根据XeF2的原子个数比知大球是Xe原子,小球是F原子,该晶胞中有2个XeF2分子;由A点坐标知该原子位于晶胞的中心,且每个坐标系的单位长度都记为1,B点在棱的rc处,其坐标为0,0,rc;图中y是底面对角线的一半,y=22a,x=c2-r,所以d=x2+y2= 12a2+c2-r2 pm。
答案:(1)9 (2)F>O>Cl V形 低于 OF2和Cl2O都是分子晶体,结构相似,Cl2O的相对分子质量大,Cl2O的熔、沸点高 (3)5 D (4)2 0,0,rc 12a2+c2-r2
核心突破·提能力
[例1] 解析:(1)O为8号元素,其基态O原子核外有8个电子,因此基态O原子的电子排布式为1s22s22p4或[He]2s22p4,其2p轨道有2个未成对电子,即O原子有2个未成对电子。
(2)硅元素的原子序数为14,价电子排布式为3s23p2,则最外层电子排布图为
(3)基态磷原子的价电子排布式为3s23p3,其中3s轨道中自旋磁量子数的代数和为0,3p轨道中3个电子自旋方向相同,所以代数和为+32或-32。
(4)根据构造原理可知基态Fe2+和Fe3+的价层电子排布式分别为3d6和3d5,其未成对电子数分别为4和5,即未成对电子数之比为4∶5。
答案:(1)1s22s22p4或[He]2s22p4 2
(2) (3)+32或-32 (4)4∶5
1.答案:(1)6s26p2 32
(2)
(3)d 2
(4)4
(5)第四周期ⅥB族 15
[例2] 解析:(1)元素的非金属性越强,其电负性越大,元素的非金属性强弱顺序为N>C>H,则元素电负性的大小顺序为N>C>H。(2)同主族元素,从上至下,原子半径逐渐增大,第一电离能逐渐减小,所以I1(Li)>I1(Na);同周期元素,从左至右,第一电离能呈现增大的趋势,但由于第ⅡA族元素基态原子s能级轨道处于全充满的状态,能量更低更稳定,所以其第一电离能大于同一周期的第ⅢA族元素,因此I1(Be)>I1(B)>I1(Li)。
答案:(1)N>C>H
(2)Na与Li同主族,Na电子层数多,原子半径大,易失电子,故第一电离能更小 Li、Be、B同周期,核电荷数依次增加,Be为1s22s2全满稳定结构,第一电离能最大。与Li相比,B核电荷数大,原子半径小,较难失去电子,第一电离能较大
2.答案:(1)Zn
(2)S>C
[例3] 解析:(1)①SeO3中Se的价层电子对数为3,孤电子对数为0,SeO32-中Se的价层电子对数为4,孤电子对数为6+2-3×22=1,故SeO3和SeO32-中Se原子分别为sp2和sp3杂化,则SeO3分子中键角大于SeO32-中键角。②富马酸亚铁中含C、H、O、Fe四种元素,由电负性递变规律可知,电负性由大到小的顺序为O>C>H >Fe。③产物中N原子形成4个共价键,则其采取sp3杂化。(2)①形成配位键的原子价层必须存在孤电子对,故三种配体NH3、H2O、Cl-中提供孤电子对形成配位键的原子是N、O、Cl,[Cr(NH3)3(H2O)2Cl]2+中中心离子的配位数为3+2+1=6。②PH3中P原子的成键电子对数为3,孤电子对数为1,故价层电子对数是4,采用sp3杂化;由于NH3中N原子含有1个孤电子对,而H2O中O原子含有2个孤电子对,孤电子对越多对成键电子对的斥力越大,因此H2O中的键角小于NH3中的键角。3PO43-的中心原子P的价层电子对数为4,孤电子对数为0,中心原子P为sp3杂化,故PO43-的空间构型为正四面体。
答案:(1)①> 前者中Se为sp2杂化、后者中Se为sp3杂化 ② O>C>H >Fe ③sp3
(2)①N、O、Cl 6 ②sp3 NH3含有1对孤电子对,而H2O含有2对孤电子对,H2O中的孤电子对成键电子对的排斥作用较大
(3)正四面体 4 sp3
3.解析:(1)BH4-中中心原子B原子核外的价层电子对数为:4+12(3+1-4×1)=4,故其立体构型为正四面体;由图可知,B原子的杂化方式为sp3、sp2。
(2)由Ti(CO)6、TiH2O62+、TiF62-可知,它们的配体分别为CO、H2O、F-,含有的原子有H、C、O、F,而C、O、F的氢化物中它们均表现负化合价,说明电负性均大于氢元素,C、O、F属于同周期元素,从左至右,非金属性逐渐增强,非金属性越强,电负性越大,所以H、C、O、F的电负性由大到小的顺序是F>O>C>H;由TiH2O62+可知,H2O中O原子的孤电子对进入Ti2+的空轨道,形成配位键,则孤电子对数减小,斥力减小,TiH2O62+中∠H—O—H变大,所以TiH2O62+中∠H—O—H大于单个水分子中∠H—O—H;由球棍结构可知,每个配体NO3-中有两个O原子,与Ti4+形成环状结构,NO3-作为双齿配体,Ti的配位数是2×4=8;NO3-中中心原子N原子的价层电子对数=3+5+1-2×32=3+0=3,无孤电子对,N原子采取sp2杂化。
(3)不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,由其结构简式可知,形成大π键的原子个数是5个,有6个电子参与成键,因此可表示为∏56,其中Se的杂化方式为sp2。
(4)SOCl2中心S原子的价电子对数为3+12(6-2-2×1)=4,VSEPR模型为正四面体。氟硼酸铵NH4BF4中铵根离子中有1个配位键、BF4-中有1个配位键,1 mol氟硼酸铵NH4BF4含有2 mol配位键。
(5)6个NH3与Co2+之间形成6个配位键,属于σ键,每个氨气分子中的氮氢键也为σ键,共6+3×6=24,所以1 mol [Co(NH3)6]Cl2含有的σ键个数为24NA。氨气分子为极性分子。
答案:(1)正四面体 sp3 、sp2
(2)F>O>C>H 大于 8 sp2
(3)∏56 sp2
(4)正四面体 2
(5)24NA 极性
[例4] 解析:(1)NH3的沸点比PH3高,是因为NH3分子间存在氢键,PH3分子间只有范德华力。(2)①可以根据共价键的稳定性比较气态氢化物的热稳定性,键长越短,键能越大,则气态氢化物的热稳定性越强,原子半径:FCl,故HF的热稳定性大于HCl的热稳定性。②影响物质在水中溶解度的因素有:物质的极性、是否含有氢键、能否与水发生化学反应等。乙醇、氯乙烷、水均为极性分子,但乙醇与水分子能形成氢键,因此在水中的溶解度乙醇大于氯乙烷。(3)氟元素非金属性强,TiF4为离子化合物,熔点最高,TiCl4、TiBr4、TiI4为共价化合物,熔点较低,且TiCl4、TiBr4、TiI4结构相似,相对分子质量越大,分子间作用力越强,熔点越高。
答案:(1)高 NH3分子间存在氢键
(2)①原子半径FCl—H ②乙醇与水之间形成氢键而氯乙烷没有
(3)TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
4.解析:(1)B—N的键长大于C—C,键长越大,键能越小,B—N的键能小于C—C,破坏C—C需要更多的能量,所以立方氮化硼晶体的熔点比金刚石低。(2)不溶性碳酸盐分解过程的实质是金属阳离子与碳酸根离子中的氧离子结合的过程,产物FeO和CoO都是离子晶体,金属阳离子半径越小,形成氧化物的离子键越强、物质越稳定,由于r(Fe2+)H2S ③Cu的原子半径较小且价电子数较多,金属键较强
(4)H2S>H2Se,所以符合题意的X为S、Y为Se;
(5)据图可知与K紧邻的O位于K所在平面的面心,K位于顶点,被12个面共用,所以与K紧邻的O的个数为12;据图可知晶胞中含有一个O原子,结合化学式可知一个晶胞中含有一个KIO3单元,则晶胞的质量为39+127+16×3NA g,晶胞边长为a nm=a×10-7cm,则晶胞体积为(a×10-7)3cm3,所以密度为39+127+16×3NA·a×10-73 g·cm-3。
答案:(1)1s22s22p63s23p4或[Ne]3s23p4 5
(2)氮原子的2p轨道处于较稳定的半充满状态
(3)有 正四面体
(4)sp2 非极性 Se
(5)12 39+127+16×3NA·a×10-73
3.解析:(2)H2O中O的价电子对数为2+6-1×22=4,故杂化轨道类型为sp3杂化,若该构型为八面体,则C2H3O2和H2O均为配体,中心Ni原子的配位数为6。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,均为离子晶体,已知熔点NiO>FeO,则晶格能:NiO>FeO,因此离子半径r(Ni2+)<r(Fe2+),设两种价态的镍离子数目分别为x、y,则x+y=0.96,2x+3y=2,解得x=0.88,y=0.08,即两种价态的镍离子数目之比为0.88∶0.08=11∶1。
(4)四羰基镍[Ni(CO)4]在室温下是一种具有挥发性的液体,可知Ni(CO)4是分子晶体,融化或气化时破坏的是范德华力,因此熔沸点较低;CO的结构式为C≡O,含有1个σ键与2个π键,因此σ键与π键个数之比为1∶2。
(5)根据晶胞示意图可知,La位于晶胞的顶点,Ni位于晶胞的面上和体心,则一个晶胞中La原子的个数为8×18=1,Ni原子的个数为8×12+1=5,则晶胞的质量为59×5+139NA=434NA g,又晶胞的边长为a pm,则晶胞的体积为(a3×10-30) cm3,因此晶胞的密度为434a3NA×1030g·cm-3。
答案:(1) (2)sp3杂化 6
(3)< 11∶1
(4)Ni(CO)4是分子晶体,融化或气化时破坏的是范德华力,因此熔、沸点较低 1∶2
(5)434a3NA×1030
4.解析:(2)镉和锌同族,其基态原子的核外电子排布式为[Kr] 4d105s2,第二电离能银失去是全充满的4d10电子,镉失去是5s1电子,故I2(Cd)H2Se>H2S。
(5)Cd(OH)2不能和碱反应,但可溶于氨水生成配位数为4的配合物,该反应的化学方程式为:Cd(OH)2+4NH3===[Cd(NH3)4](OH)2;NH3与NF3具有相同的空间构型,都是三角锥型,而N-H键较短,成键电子对间的斥力较大,故NH3分子中的键角大于NF3分子中的键角。
(6)①由立方晶系CdTe的晶胞结构图可知,Cd位于立方晶胞的顶点和面心位置,Te位于顶点Cd及该顶点所在三个面的面心Cd所构成的正四面体体心,根据题意,在该晶胞中建立如图2所示的坐标系,则距离Cd(0,0,0)原子最近的Te原子投影在面对角线的14处,故其分数坐标为14,14,14;
②该晶胞沿其体对角线方向上的投影如图3所示,根据立方晶系CdTe的晶胞结构图示,则⑬位置是体对角线两端点Cd原子,①②③④⑤⑥分别是立方晶胞的另外六个顶点,⑦⑧⑨⑩⑪⑫是六个面心上的Cd原子,四个Te原子中的一个在该体对角线上与⑬重合,另外三个分别间隔一位与⑧⑨⑩⑪⑫是六个面心上的Cd原子重合,故和Cd原子重合的位置为[⑧⑩⑫⑬]或[⑦⑨⑪⑬];③根据上小题②的分析,d是两面对角线顶点在体对角线的切面上的投影距离,晶胞参数为a pm,面对角线长度为2a,体对角线长度为3a,则d的长度为体对角线的一半,则为32a。
答案:(1)4d105s25p4
(2)银失去是全充满的4d10电子,镉失去是5s1电子
(3)6
(4)H2O>H2Se>H2S
(5)Cd(OH)2+4NH3===[Cd(NH3)4](OH)2 大于
(6)①(14,14,14) ② [⑧⑩⑫⑬]或[⑦⑨⑪⑬] ③32a
相关试卷
这是一份新教材2024高考化学二轮专题复习专题14物质结构与性质模考精练,共6页。试卷主要包含了[选修3等内容,欢迎下载使用。
这是一份新教材2024高考化学二轮专题复习专题14物质结构与性质真题研练,共8页。试卷主要包含了[2023·全国乙卷][选修3等内容,欢迎下载使用。
这是一份新教材2024高考化学二轮专题复习专题14物质结构与性质课时作业,共7页。试卷主要包含了铜及其化合物有广泛的用途等内容,欢迎下载使用。








