
广东省四校2022-2023学年高三下学期“收心考”联考化学试题(含解析)
展开
这是一份广东省四校2022-2023学年高三下学期“收心考”联考化学试题(含解析),共24页。试卷主要包含了单选题,实验题,工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。
广东省四校2022-2023学年高三下学期“收心考”联考化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.中华文明源远流长,下列文物或物品属于无机非金属材料的是
A.战汉时期老青铜错金马 B.春秋战国青铜鎏金活链圆壶
C.两周时期曾国编钟 D.潮汕陶瓷工夫茶具
2.下列说法不正确的是
A.油脂属于高分子化合物,可用于制造肥皂和油漆
B.福尔马林能使蛋白质变性,可用于浸制动物标本
C.天然气的主要成分是甲烷,是常用的燃料
D.中国科学家在世界上首次人工合成具有生物活性的蛋白质——结晶牛胰岛素
3.下列图示或化学用语错误的是
A.羟基的电子式:
B.H2O的VSEPR模型:
C.Mn2+的价电子的轨道表示式:
D.中子数为5的铍原子:
4.下列有关物质性质与用途对应关系错误的是
物质性质
物质用途
A
Na2O2吸收CO2产生O2
Na2O2用作呼吸面具供氧剂
B
Al2O3熔融状态可电离
电解熔融Al2O3制取单质Al
C
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
D
HF与SiO2反应
HF在玻璃器皿上刻蚀标记
A.A B.B C.C D.D
5.对乙酰氨基酚是感冒冲剂的有效成分,其结构简式如图所示。下列有关说法正确的是
A.难溶于热水,能发生消去反应 B.在人体内能发生水解反应
C.分子中所有原子可能共平面 D.不能与FeCl3溶液发生显色反应
6.抗疫居家期间,同学们在参与家务劳动的过程中体会到化学知识无处不在。下列劳动与所涉及的化学知识不相符的是
选项
家务劳动
化学知识
A
用白醋除去水壶中的水垢
白醋可溶解沉淀
B
用小苏打粉作膨松剂焙制糕点
加热容易分解放出
C
用含NaClO的84消毒液拖地
NaClO有还原性
D
用洁厕灵洗马桶
洁厕灵中含有盐酸,可以与尿垢反应
A.A B.B C.C D.D
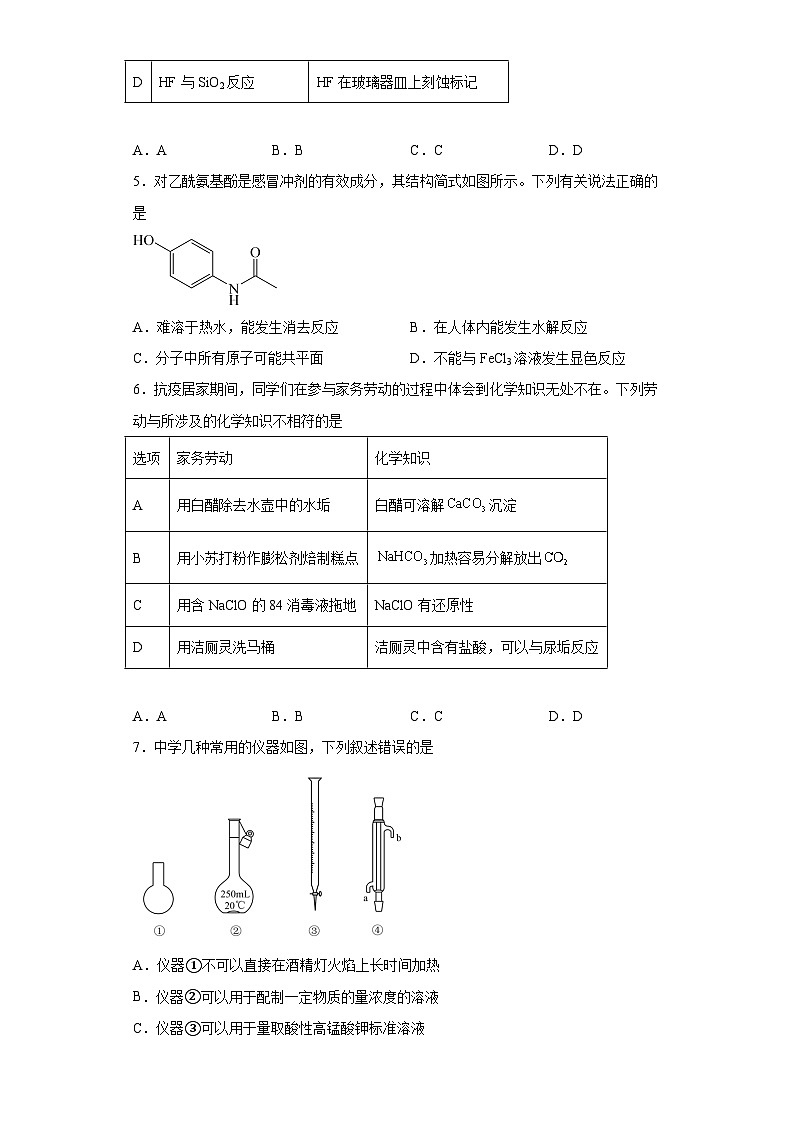
7.中学几种常用的仪器如图,下列叙述错误的是
A.仪器①不可以直接在酒精灯火焰上长时间加热
B.仪器②可以用于配制一定物质的量浓度的溶液
C.仪器③可以用于量取酸性高锰酸钾标准溶液
D.仪器④在使用时必须从b口进水
8.下列叙述I和II均正确并且有因果关系的是
叙述I
叙述II
A
NH3能使酚酞溶液变红
NH3可用于设计喷泉实验
B
1-己醇的沸点比己烷的沸点高
1-己醇和己烷可通过蒸馏初步分离
C
Al2O3熔点高,硬度大
实验室可用氧化铝坩埚熔化NaOH固体
D
Na在Cl2中燃烧生成离子晶体
NaCl固体可导电
A.A B.B C.C D.D
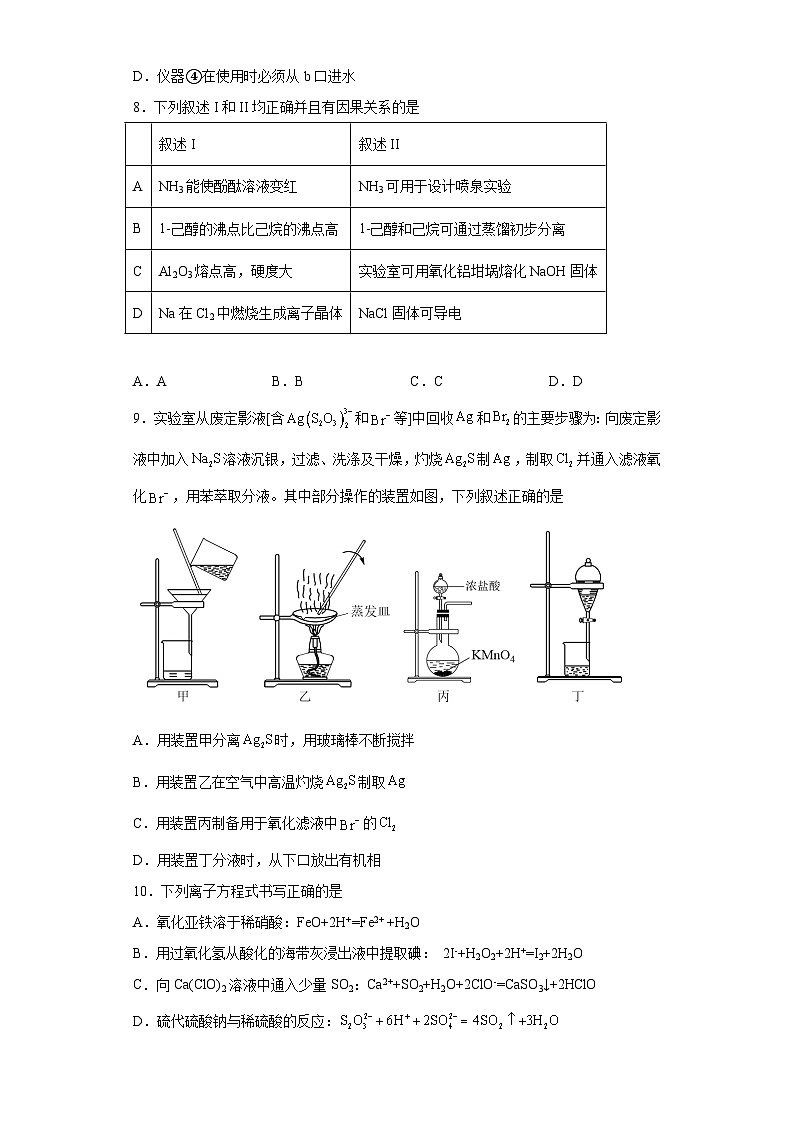
9.实验室从废定影液[含和等]中回收和的主要步骤为:向废定影液中加入溶液沉银,过滤、洗涤及干燥,灼烧制,制取并通入滤液氧化,用苯萃取分液。其中部分操作的装置如图,下列叙述正确的是
A.用装置甲分离时,用玻璃棒不断搅拌
B.用装置乙在空气中高温灼烧制取
C.用装置丙制备用于氧化滤液中的
D.用装置丁分液时,从下口放出有机相
10.下列离子方程式书写正确的是
A.氧化亚铁溶于稀硝酸:FeO+2H+=Fe2+ +H2O
B.用过氧化氢从酸化的海带灰浸出液中提取碘: 2I-+H2O2+2H+=I2+2H2O
C.向Ca(ClO)2溶液中通入少量SO2:Ca2++SO2+H2O+2ClO-=CaSO3↓+2HClO
D.硫代硫酸钠与稀硫酸的反应:
11.NA是阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4L乙烯所含的σ键数为6NA
B.1.2gMg在空气中燃烧生成MgO和Mg3N2,转移电子个数为0.1NA
C.2.7gAl与足量NaOH溶液反应,生成H2的个数为0.1NA
D.常温常压下,12g金刚石中含有C—C键数为4NA
12.我国科学家用如图所示大阴离子的盐作水系锌离子电池的电解质溶液,显示了优良的循环性能。X、Y、Z、W均为短周期元素且原子序数依次增大,其中X、Y、Z位于同一周期,Y、W核外最外层电子数相等。下列叙述正确的是
A.简单离子半径大小顺序为W>Y>Z
B.离子的空间结构为平面三角形
C.Y的简单氢化物的沸点低于W的简单氢化物的沸点
D.XZ4分子是极性分子
13.在相同条件下研究催化剂I、II对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,则下列说法不正确的是
A.催化剂I、II相比,I使反应活化能更低
B.使用催化剂I,反应时间为时,X的转化率为
C.a曲线表示使用催化剂II时X的浓度随t的变化
D.使用催化剂II时,内,
14.2022年诺贝尔化学奖授予在“点击化学和生物正交化学”领域做出贡献的三位科学家。点击化学经典反应之一是:一价铜催化的叠氮化物-端炔烃环加成反应,反应机理示意如下。
下列说法正确的是
A.第一电离能:
B.反应③过程中,涉及到极性键和非极性键的断裂和形成
C.总反应为:
D.一价铜催化剂能有效降低总反应的焓变
15.锌铁液流电池由于安全、稳定、电解液成本低等优点成为电化学储能热点技术之一、如图为以和作为电极氧化还原电对的碱性锌铁液流电池放电时工作原理示意图。已知:聚苯并咪唑()膜允许离子通过。
下列说法错误的是
A.含有配位键,电池放电总反应为
B.放电过程中,左侧池中溶液逐渐减小
C.充电过程中,阴极的电极反应为
D.充电过程中,当通过膜时,导线中通过
16.某温度下,向溶液中缓慢加入固体,溶液、温度随被滴定分数的变化如图所示(忽略溶液体积变化)。下列说法错误的是
A.M点的小于点的
B.N点,
C.P点对应的溶液一定显中性
D.M、N、P、Q四点中,水的电离程度最大的是Q点
二、实验题
17.科学探究要实事求是、严谨细致。某化学兴趣小组设计实验进行有关氯化物的探究实验,回答下列问题:
I.制备FeCl2。装置如图所示(夹持装置省略),已知FeCl3极易水解。
(1)仪器a的名称是______________。
(2)装置II中制备FeCl2的化学方程式为__________________________________________。
(3)该装置存在的缺陷是:①__________________________________;②缺少氢气的尾气处理装置。
II.利用惰性电极电解0.1 mol•L-1FeCl2溶液,探究外界条件对电极反应(离子放电顺序)的影响。
(4)实验数据如表所示:
实验编号
电压/V
pH
阳极现象
阴极现象
1
1.5
5.52
无气泡,滴加KSCN显红色
无气泡,银白色金属析出
2
3.0
5.52
少量气泡,滴加KSCN显红色
无气泡,银白色金属析出
3
4.5
5.52
大量气泡,滴加KSCN显红色
较多气泡,极少量金属析出
4
1.5
1.00
无气泡,滴加KSCN显红色
较多气泡,极少量金属析出
①由实验1、2现象可以得出结论:增大电压,________优先于________放电;
②若由实验1、4现象可以得出结论:_________________________________________________。
II.为了探究外界条件对氯化铵水解平衡的影响,兴趣小组设计了如下实验方案:
实验编号
c(NH4Cl)/mol·L-1
温度/℃
待测物理量
实验目的
5
0.5
30
a
——
6
1.5
i
b
探究浓度对氯化铵水解平衡的影响
7
0.5
35
c
ii
8
2.0
40
d
探究温度、浓度同时对氯化铵水解平衡的影响
(5)该实验限选药品和仪器:恒温水浴、pH传感器、烧杯、0.1mol.L-1硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液。
①实验中,“待测物理量”是________________;
②实验目的ii是_________________;
③上述表格中,b____ d(填“>”、“”、“”、“ O2->F-,故A正确;
B.离子中S原子价电子对数为4,有1个孤电子对,空间结构为三角锥形,故B错误;
C.H2O、H2S,均为分子晶体,且结构相似,H2O分子间存在氢键,沸点H2O>H2S,故C错误;
D.CF4为正四面体形分子,结构对称,是非极性分子,故D错误;
选A。
13.C
【分析】结合化学方程式,由图可知,0~2min 内,a曲线的变化量为Ⅰ变化量的一半,则a为X浓度、Ⅰ为Y的浓度变化;
【详解】A.由图可知,催化剂I比催化剂II催化效果好,说明催化剂I使反应活化能更低,反应更快,故A正确;
B.使用催化剂I时,在0~2min 内,X的浓度变化了4.0mol/L-2.0mol/L=2.0mol/L,X的转化率为,故B正确;
C.由分析可知,a曲线表示使用催化剂Ⅰ时X的浓度随t的变化,故C错误;
D.使用催化剂I时,在0~2min 内,Y的浓度变化了2.0mol/L,则,由速率之比等于系数比,v(X) =v(Y) =×,故D正确;
故选C。
14.C
【详解】A.同一主族随原子序数变大,原子半径变大,第一电离能变小;同一周期随着原子序数变大,第一电离能变大,但是N的最外层电子排布是2s22p3,p轨道半充满较稳定,因此第一电离能比氧大,故第一电离能:,A错误;
B.反应③过程中,涉及到NN、CC非极性键的断裂,不存在非极性键的形成,存在C-N极性键的形成,不存在极性键的断裂,B错误;
C.根据反应过程,总反应为: ,C正确;
D.催化剂降低反应的活化能,加快反应速率,不能改变反应的焓变,D错误;
故选C。
15.D
【分析】由图可知,Zn失去电子生成,则Zn极为负极,电极方程式为:,惰性电极为正极, 得到电子生成,电极方程式为:+e-=,据此解题。
【详解】A.含有配位键, Zn是活泼电极,放电过程中Zn是负极,Zn失去电子生成,电极方程式为:Zn-2e-+4OH-=;惰性电极为正极,得到电子生成,电极方程式为:+e-=;则放电过程中,总反应为,故A正确;
B.放电过程中,左侧惰性电极为正极,右侧Zn是负极。负极电极方程式为:Zn-2e-+4OH-=,该过程需要的OH-由左侧池经过聚苯并咪唑()膜进入右侧池,左侧池中溶液逐渐减小,故B正确;
C.充电过程中,Zn是阴极,电极方程式为:+2e-= Zn+4OH-,故C正确;
D.充电过程中,Zn是阴极,电极方程式为:+2e-= Zn+4OH-,该过程生成的OH-一半进入左侧池,当通过膜时,导线中通过,故D错误;
故选D。
16.C
【分析】已知酸碱中和反应是一个放热反应,由图可知随着NaOH的滴加溶液温度升高,当NaOH过量后溶液温度又开始下降,故曲线I为温度随H2X被滴定分数的变化,随着NaOH的滴加,溶液pH始终保持增大趋势,故曲线II为pH随H2X被滴定分数的变化,据此分析解题。
【详解】A.M点温度低于Q点,M点的小于点的,A正确;
B.由图示信息可知,N点对应,则反应后溶质为NaHX,根据电荷守恒有:,根据物料守恒有:,则有,B正确;
C.P点对应的溶液温度高于25℃,此时pH=7的溶液呈弱碱性,C错误;
D.M、N、P、Q四点中,Q点处被滴定分数为2,溶质为Na2X,Na2X水解程度较大,所以水的电离程度最大的是Q点,D正确;
故选C。
17.(1)长颈漏斗
(2)
(3)装置I与装置II间缺少干燥装置
(4) Cl- Fe2+ 增加H+浓度,H+优先于Fe2+放电
(5) 溶液的pH 探究温度对氯化铵水解平衡的影响 >
【分析】在装置I中Zn与稀硫酸发生置换反应产生H2,在加热条件下H2还原FeCl3得到FeCl2,装置III中碱石灰的作用有两个:一是吸收反应产生的HCl,防止大气污染,二是吸收空气中的水分,防止FeCl3水解。在使用惰性电极电解时,阳极上失去电子发生氧化反应,阴极上发生得到电子的还原反应,根据电压大小及溶液pH发生改变时,电极产物的变化及现象的不同,分析判断离子放电能力大小及物质的氧化性、还原性强弱顺序。
【详解】(1)根据图示可知仪器a的名称是长颈漏斗;
(2)在装置II中在加热条件下H2与FeCl3发生反应产生FeCl2、HCl,反应的化学方程式为:,答案为:;
(3)在装置I中Zn与稀H2SO4发生置换反应产生的H2未经干燥就通入装置II中,会导致FeCl3发生水解反应,故该装置存在的缺陷是装置I与装置II间缺少干燥装置,答案为:装置I与装置II间缺少干燥装置。
(4)在实验1中在电压为1.5时阳极上无气泡,滴加KSCN显红色,说明是Fe2+失去电子变为Fe3+,电极反应式是;实验2中在电压为3.0时阳极上现象是产生少量气泡,滴加KSCN显红色,说明附近溶液中产生Fe3+,同时有Cl2生成;在实验3中电压增大至4.5,阳极上现象是大量气泡,滴加KSCN显红色,说明电压增大,阳极上Cl-失去电子能力增强,发生反应:;电解FeCl2溶液,根据实验1、2可知:在溶液pH相同时,电压越大,阳极产生的气泡就越多,即增大电压,产生氯气的速率更快或增大电压,Cl-优先于Fe2+放电;电解FeCl2溶液,根据实验1、4可知:在电压相同时,溶液pH越小,阴极产生的气泡就越多,产生的金属单质就越少,说明离子放电能力大小与溶液中离子浓度大小有关,增大H+的浓度,H+氧化性强于Fe2+,H+优先于Fe2+放电,答案为:Cl-,Fe2+,增加H+浓度,H+优先于Fe2+放电;
(5)①由提供的药品和仪器可知,pH计是准确测定溶液的pH的,所以待测物理量是溶液的pH。②探究浓度对氯化铵水解平衡的影响,则温度必须相同,所以实验6的温度与实验5相同,即为30度。实验5和实验7浓度相同,温度不同,所以是探究温度对氯化铵水解平衡的影响。③水解反应属于吸热反应,温度越高水解程度越大,氢离子浓度增大,浓度越高,水解生成的氢离子浓度越大,则溶液的酸性越强,已知实验Ⅳ的浓度大,温度高,所以溶液的pH小,即b>d,答案为:溶液的pH,探究温度对氯化铵水解平衡的影响,>。
18.(1) 适当加热(或将固体原料粉碎或适当增大酸的浓度等) 3d54s1
(2)+3H2C2O4+8H+=2Cr3++6CO2↑+7H2O
(3)Cr(OH)3
(4)防止pH过高会使Cr(OH)3溶解,导致铬的去除率降低
(5)
(6)
【分析】工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、Pb2+等 )加硝酸进行“酸溶”,碳酸锶和硝酸反应生成硝酸锶、水和二氧化碳,气体A为CO2,得到含Sr2+、Ba2+、Ca2+、Mg2+、 Pb2+的溶液,向溶液中加入过量的(NH4)2CrO4进行“沉钡、铅”,过滤得到含Sr2+、Ca2+、Mg2+、、的溶液,对溶液进行酸化、加草酸进行还原,被还原为Cr3+,得到含Sr2+、Ca2+、Mg2+、、Cr3+的溶液,向溶液中加氨水调pH到7 ~ 8,将Cr3+转化为沉淀除去,滤渣1为Cr (OH)3,再加NaOH调pH≈13使Ca2+、Mg2+沉淀,过滤后碳化,Sr2+转化为SrCO3,再经过“系列操作”得到高纯SrCO3。
【详解】(1)适当加热、将固体原料粉碎、适当增大酸的浓度等措施能提高酸溶时反应速率;铬元素的原子序数为24 ,基态原子的价电子排布式为3d54s1,故答案为:适当加热(或将固体原料粉碎或适当增大酸的浓度等);3d54s1;
(2)由题意可知,还原时发生的反应为酸性条件下,重铬酸根离子与草酸反应生成铬离子、二氧化碳和水,反应的离子方程式为+3H2C2O4+8H+=2Cr3++6CO2↑+7H2O,故答案为:+3H2C2O4+8H+=2Cr3++6CO2↑+7H2O;
(3)由分析可知,滤渣1的主要成分是Cr (OH)3,故答案为:Cr (OH)3;
(4)由题给信息可知,Cr (OH)3是两性氢氧化物,若使用NaOH溶液调整溶液pH时,若pH过大会导致Cr (OH)3会溶解,所以为防止溶液pH过高会使Cr(OH)3溶解,导致铬的去除率降低,除去溶液中钙离子、镁离子时用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13,故答案为:防止pH过高会使Cr(OH)3溶解,导致铬的去除率降低;
(5)由方程式可知,反应的化学平衡常数K=,故答案为:;
(6)由晶胞结构可知,晶胞中位于顶点的锶原子个数为8×=1,位于面心的氧原子数为6×=3,位于体心的钛原子个数为1,则晶胞的化学式为SrTiO3,设晶体的密度为dg/cm3,由晶胞的质量公式可得:=10—7a3d,解得d=,故答案为:。
19.(1)(a-2b-2c)
(2) > < AD
(3)d
(4)CH3OH-4e-+H2O=HCOOH+4H+
【详解】(1)①
②
③
根据盖斯定律①-②×2-③×2得的 (a-2b-2c)。
(2)①由图可知,温度升高CH4的平衡转化率增大,升温平衡向正反应方向移动,该反应的>0;而由催化重整反应可知,相同温度下,增大压强平衡逆向移动,CH4的平衡转化率减小,则
相关试卷
这是一份广东省四校2022-2023学年高三下学期“收心考”联考化学试题(解析版),共22页。
这是一份广东省四校2022-2023学年高三下学期“收心考”联考化学试题,文件包含广东省四校2022-2023学年高三下学期“收心考”联考化学试题解析版docx、广东省四校2022-2023学年高三下学期“收心考”联考化学试题原卷版docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
这是一份广东省2022-2023学年度高三第二学期“收心考”四校联考化学科试卷(Word版含答案),文件包含广东省2022-2023学年度高三第二学期“收心考”四校联考化学科试卷docx、2022-2023学年度高三第二学期“收心考”四校联考化学评分细则pdf等2份试卷配套教学资源,其中试卷共15页, 欢迎下载使用。









