
备考2023年中考化学知识点模拟新题专项练习(福建专用)-39元素周期(填空题)
展开
这是一份备考2023年中考化学知识点模拟新题专项练习(福建专用)-39元素周期(填空题),共23页。试卷主要包含了填空题等内容,欢迎下载使用。
备考2023年中考化学知识点模拟新题专项练习(福建专用)-39元素周期(填空题)
一、填空题
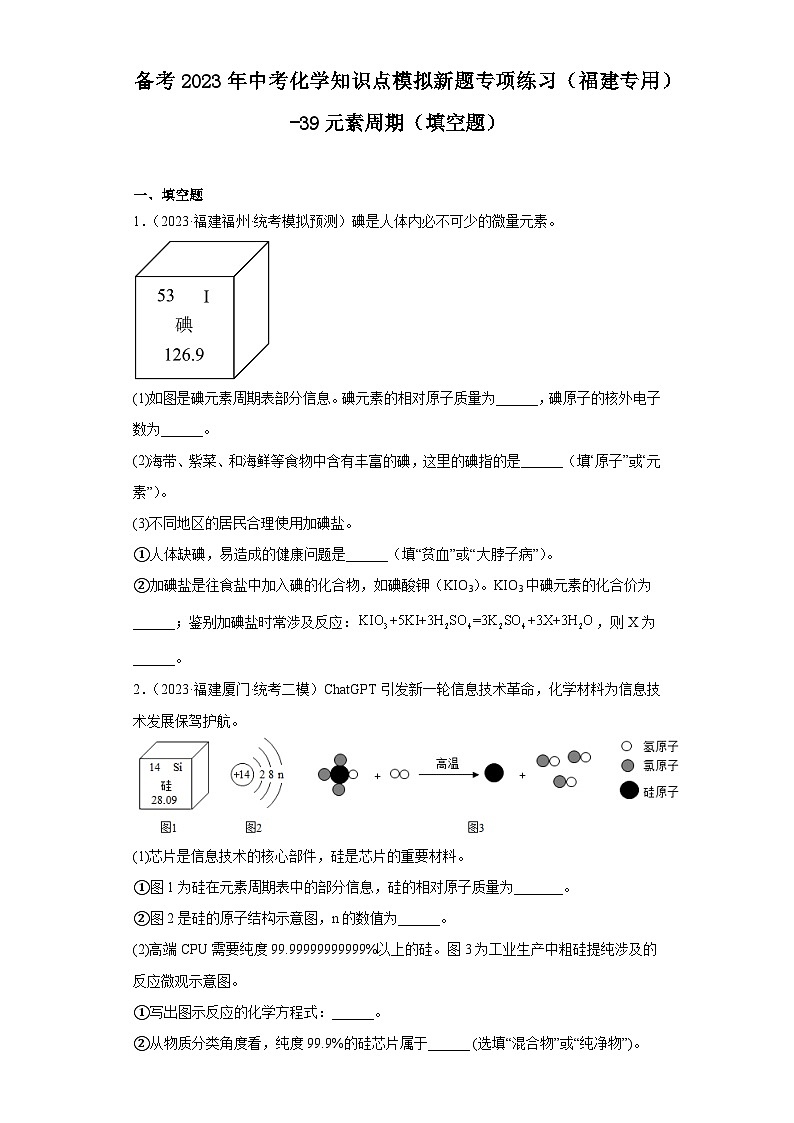
1.(2023·福建福州·统考模拟预测)碘是人体内必不可少的微量元素。
(1)如图是碘元素周期表部分信息。碘元素的相对原子质量为______,碘原子的核外电子数为______。
(2)海带、紫菜、和海鲜等食物中含有丰富的碘,这里的碘指的是______(填“原子”或“元素”)。
(3)不同地区的居民合理使用加碘盐。
①人体缺碘,易造成的健康问题是______(填“贫血”或“大脖子病”)。
②加碘盐是往食盐中加入碘的化合物,如碘酸钾(KIO3)。KIO3中碘元素的化合价为______;鉴别加碘盐时常涉及反应:,则X为______。
2.(2023·福建厦门·统考二模)ChatGPT引发新一轮信息技术革命,化学材料为信息技术发展保驾护航。
(1)芯片是信息技术的核心部件,硅是芯片的重要材料。
①图1为硅在元素周期表中的部分信息,硅的相对原子质量为_______。
②图2是硅的原子结构示意图,n的数值为______。
(2)高端CPU需要纯度99.99999999999%以上的硅。图3为工业生产中粗硅提纯涉及的反应微观示意图。
①写出图示反应的化学方程式:______。
②从物质分类角度看,纯度99.9%的硅芯片属于______ (选填“混合物”或“纯净物”)。
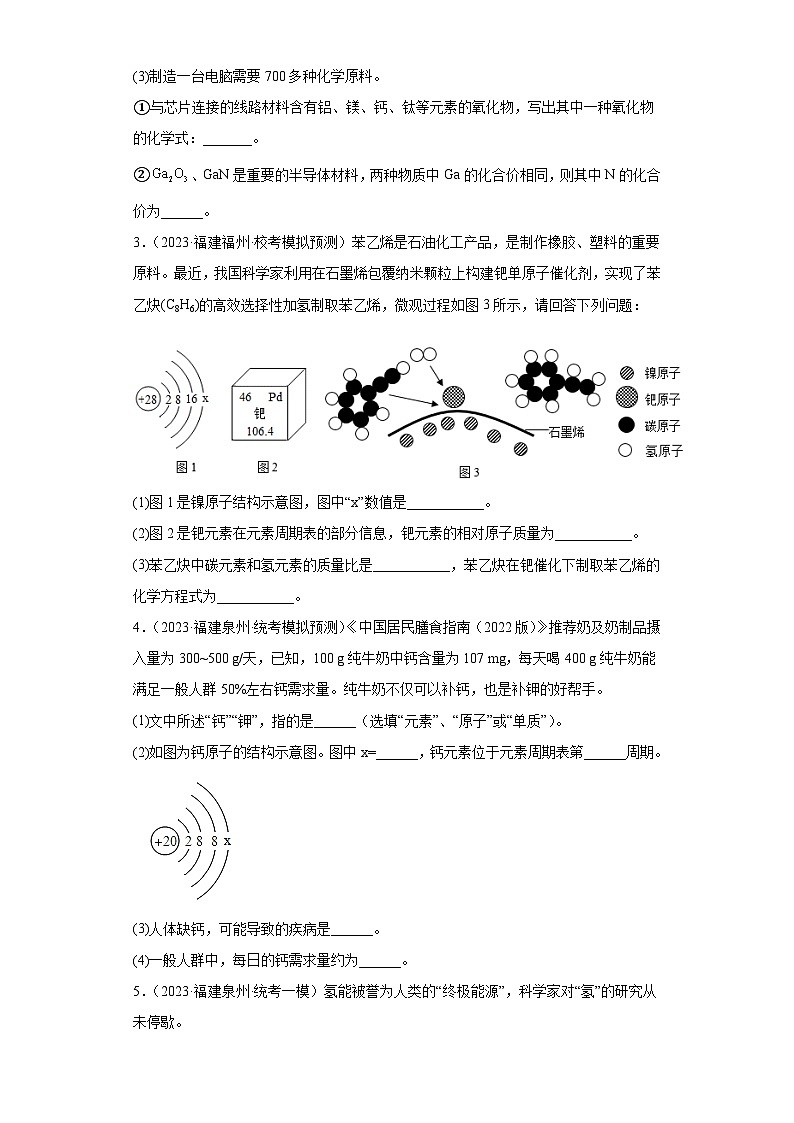
(3)制造一台电脑需要700多种化学原料。
①与芯片连接的线路材料含有铝、镁、钙、钛等元素的氧化物,写出其中一种氧化物的化学式:_______。
②、GaN是重要的半导体材料,两种物质中Ga的化合价相同,则其中N的化合价为______。
3.(2023·福建福州·校考模拟预测)苯乙烯是石油化工产品,是制作橡胶、塑料的重要原料。最近,我国科学家利用在石墨烯包覆纳米颗粒上构建钯单原子催化剂,实现了苯乙炔(C8H6)的高效选择性加氢制取苯乙烯,微观过程如图3所示,请回答下列问题:
(1)图1是镍原子结构示意图,图中“x”数值是___________。
(2)图2是钯元素在元素周期表的部分信息,钯元素的相对原子质量为___________。
(3)苯乙炔中碳元素和氢元素的质量比是___________,苯乙炔在钯催化下制取苯乙烯的化学方程式为___________。
4.(2023·福建泉州·统考模拟预测)《中国居民膳食指南(2022版)》推荐奶及奶制品摄入量为300~500 g/天,已知,100 g纯牛奶中钙含量为107 mg,每天喝400 g纯牛奶能满足一般人群50%左右钙需求量。纯牛奶不仅可以补钙,也是补钾的好帮手。
(1)文中所述“钙”“钾”,指的是______(选填“元素”、“原子”或“单质”)。
(2)如图为钙原子的结构示意图。图中x=______,钙元素位于元素周期表第______周期。
(3)人体缺钙,可能导致的疾病是______。
(4)一般人群中,每日的钙需求量约为______。
5.(2023·福建泉州·统考一模)氢能被誉为人类的“终极能源”,科学家对“氢”的研究从未停歇。
(1)我国科学家以单原子铜锚定二氧化钛()制备出新型催化剂,在光照下催化分解水制氢的效率高达56%。
①中Ti的化合价是______。
②该催化光解水制取氢气的化学方程式是______。
(2)科学研究发现,原子与分子“最简单”的一种反应过程的示意图如下:
其中表示H原子,表示D原子。
①H原子和D原子______(填“属于”或“不属于”)同种元素。
②图中乙分子的符号是______。
(3)某种储氢材料可将H2转化为MgH2暂时“储存”,再通过以下方法进行“释放”。
方法1:
方法2:↑
获得相同质量的,“方法1”和“方法2所消耗MgH2的质量比是______。
6.(2023·福建龙岩·统考一模)化学与生活。
(1)焙制糕点所用的发酵粉主要成分之一是小苏打,它的化学式是_______。
(2)84消毒液的有效成分是NaClO,其中氯元素的化合价是_______。
(3)钻石是打磨过的金刚石。构成金刚石的微粒名称是_______。
(4)首饰上镶嵌的蓝宝石主要成分是Al2O3,因为含有钛、铁显蓝色。这里的钛、铁指的是_______(填“原子”“元素”或“单质”)。
(5)篝火晚会结束后,用沙土将残余火焰熄灭的灭火原理是_______。
7.(2023·福建三明·统考一模)电池的研发和使用推动了我国能源结构的优化。
(1)锂元素在元素周期表中的相关信息如图1所示,锂的相对原子质量是______。
(2)锂原子结构示意图如图2所示,锂原子的最外层电子数是______。钠原子结构示意图如图3所示,x=______。
(3)在化学反应中,锂原子和钠原子都易______(填“得到”或“失去”)电子。
(4)一种锂离子电池的正极材料为钴酸锂(LiCoO2),其中Co元素的化合价是______价。
(5)近年来,锂离子电池原材料价格上涨,钠离子电池部分取代锂离子电池,应用在低速电车、家庭和工业储能等方面。下列叙述正确的有______(填字母)。
A.钠元素在自然界中的储量较为丰富
B.钠和锂化学性质相似
C.废旧电池丢弃后,不会造成环境污染
8.(2023·福建·模拟预测)根据下列信息回答问题。
(1)如图为铝原子结构示意图及铝在元素周期表中的部分信息,其中,X=______;铝的相对原子质量为______。
(2)在空气中铝制品更耐腐蚀,用化学方程式表示其原因是______;
(3)人类冶炼和使用金属铝的时间较晚是因为______(填字母)。
a、地壳中铝元素含量少 b、冶炼铝的技术要求高
(4)已知一氧化碳具有还原性,可用于冶炼金属,请你写出一氧化碳和氧化铁在高温下的化学方程式______
(5)炼钢中充氧的目的是降低生铁中的______,获得性能更好的钢。
9.(2023·福建·模拟预测)小宇和同学们在学习化学之后再次走进科技馆,下面的连环画记录了他们的参观过程。
请据图和叙述回答以下各题。
(1)来到“与门捷列夫对话”展台,看到熟悉的元素周期表,依据图②中显示的信息回答。
①硫原子和硫离子统称为硫元素的原因是______。
②镁原子原子的结构示意图为:,在化学反应中易______(填“得”或“失”)电子。
(2)“身边的元素”展台摆放了一些家居用品,告诉我们身边的物质都是由元素组成的。小宇依据化学式Na2SiO3判断该物质属于氧化物,你认为小宇同学的判断是______(填“正确”或者“错误”)的。请你写出Na2SiO3中硅元素的化合价:______。
(3)“太空探索”展台周围吸引了很多观众。
航天员出舱所穿的宇航服能为其提供氧气,并吸收二氧化碳,用于吸收二氧化碳的物质是氢氧化锂,已知其中锂(Li)的化合价为+1,则氢氧化锂的化学式为______。
10.(2023·福建漳州·统考模拟预测)原子钟是北斗卫星导航定位系统的心脏。我国是第一个氢、铷、铯三种原子钟同时具备上天能力的国家。氢元素、铷元素和铯元素的相关信息如图,请回答下列问题:
H Rb
(1)2H表示______。
(2)图中x=______;铷(Rb)原子易______电子,形成离子的符号是______。
(3)铯属于______(填“金属”或“非金属”)元素,其相对原子质量是_____。
11.(2023·福建·模拟预测)化学提升生活品质,助力未成年人健康成长。骑自行车属于低碳生活新时尚。
(1)下列做法不属于低碳生活方式的是___________。
A.随手关灯
B.旧书本循环利用
C.夏天将空调温度调至最低
(2)①下列做法不利于自行车防锈的是___________。
A.金属部件镀金属铬B.链条涂防锈油C.雨淋后自然晾干
②如图是铬元素在元素周期表中的信息以及原子结构示意图。铬元素的相对原子质量为___________,x的数值是___________。
(3)铁锈成分中含有氧化铁(Fe2O3),写出氧化铁与稀硫酸反应的化学方程式___________。
(4)某学生做了铁的锈蚀实验,装置如图。一段时间后可观察到导管内红墨水的液面___________(填“上升”或“下降”)。
12.(2023·福建泉州·统考一模)“钙”世无双,带你走进钙的世界。
(1)发现钙:电解熔融的氯化钙得到金属钙和氯气,其基本反应类型是______________反应。
(2)认识钙:
①下图是钙元素在周期表中的信息及其原子结构示意图,则钙元素的相对原子质量为____________,在化学反应中易______________(填“得到”或“失去”)电子。
②人体内的钙99%存在于骨骼和牙齿中,钙元素摄入不足,可能导致的疾病是___________________。
(3)应用钙:常用于改良酸性土壤的氢氧化钙,俗名是_____________,其水溶液可用于检验二氧化碳,原理是_____________(用化学方程式表示)。
13.(2023·福建莆田·统考一模)在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。
(1)溴元素的相关信息如图甲所示,请回答下列问题。
①溴元素属于___________(选填“金属”或“非金属”)元素,溴的相对原子质量是___________,溴元素位于元素周期表的第___________周期。
②溴元素的化学性质与图乙中___________(选填“A”或“B”)对应元素的化学性质相似。
③若图乙中C表示原子,则x=___________。
(2)下图为含氮物质的化合价—类别关系图。
①氮元素化合价为0的物质的化学式为___________。
②A点对应的物质为大气污染物之一,写出其化学式___________。
③图中___________(选填“B”、“C”或“D”)点对应的物质可能是NH3.
14.(2023·福建南平·统考一模)学习化学要建立微粒观、元素观和变化观。
(1)构成物质的微粒有分子、原子和离子。如氯化钠是由___________(填离子符号)和Cl-构成。
(2)硅是生产太阳能电池的主要原料。图为硅元素在元素周期表中的部分信息,从中可获取的信息是___________(写一点即可)。
(3)月球探测器取回的月壤中含有丰富的氦-3.一个氦-3原子的原子核内含有2个质子和1个中子,其原子结构示意图是___________(填标号)。
A. B. C. D.
(4)宇航员呼吸产生的CO2转化为甲烷(CH4),其反应的微观示意图如下:
①该反应中有___________种氧化物。
②该反应中CO2和CH4的分子个数比为___________。
15.(2023·福建三明·统考一模)俄国化学家门捷列夫编制出第一张元素周期表。元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,随着科学的发展,元素周期表中未知元素留下的空位先后被填满。周期表中的部分信息和氯原子、氯原子的结构示意图如下图所示:
(1)氧元素位于元素周期表的第______周期,x值为______。
(2)磷的相对原子质量为______,磷在空气中燃烧的化学方程式为______。
(3)周期表中问号处应写的内容为______,氯离子的符号为______。
16.(2023·福建泉州·模拟预测)钙是人体必需元素。
(1)下图为钙元素在元素周期表中的部分信息。钙元素的相对原子质量为_______,钙原子的核外电子数为_______。
(2)牛奶、豆类等食物含钙丰富,这里的“钙”指的是_______(填“单质”“元素”或“原子”)。
(3)人体若缺钙,可服用补钙剂。
①缺钙可能导致的健康问题是_______(填“骨质疏松”或“贫血”)。
②服用主要成分为CaCO3的某钙片,与胃酸(含有HCl)反应后钙才能被吸收。该反应的化学方程式为_______。
17.(2023·福建南平·统考一模)下表列出了我国农村学生营养餐计划食谱中某牛奶的营养成分,表中部分元素的原子结构示意图和信息如下图所示
营养成分表
项目
每100mL
能量
277kJ
蛋白质
3.2g
脂肪
3.8g
碳水化合物
4.8g
钠
53mg
钙
100mg
(1)氮、氧、钠三种元素中,写出其中一种非金属元素的符号____________。
(2)钠元素的原子在化学反应中易____________(填“得到”或“失去”)电子。
(3)钙的相对原子质量是____________。
(4)青少年每日必须摄入足够量的蛋白质,下列食物中含蛋白质最丰富的是 (填选项)。
A.鸡蛋、牛肉 B.玉米、土豆 C.牛油、菜子油
18.(2023·福建·模拟预测)18 世纪以来,科学家开始对元素知识进行总结和归纳。
(1)1789 年,拉瓦锡对元素分类作出了初步尝试,其中将碳、硫等归为“能氧化为酸的简单非金属物质”,以下属于这类物质的是______(填序号)。
① 磷 ② 汞 ③ 石灰
(2)1869 年,门捷列夫编制首张元素周期表,之后预言了一些未知元素。1875 年与铝化学性质相似的元素镓被发现。请预测镓的化学性质______(写一点)。
(3)现代常把原子结构与元素周期表结合起来认识元素,如下图:
① 镁元素的相对原子质量为______。
② 镁原子在化学反应中易______(选填“得到”或“失去”)电子,说明元素的化学性质与原子的______关系密切。
19.(2023·福建·模拟预测)我国长征二号F遥十三运载火箭搭载神舟十三号载人航天飞船成功发射,又一次将我们的航天员送入了太空。
(1)运载系统采用铷原子钟提供精确时间。下图所示是铷元素在元素周期表中的部分信息和铷原子的结构示意图。
①铷的相对原子质量为______。
②x的数值为______。
③铷元素位于元素周期表中的第______周期。
(2)在火箭的制造中使用了钛和钛合金。钛的硬度比钛合金的______(选填“大”或“小”)。
(3)下图是一种火箭推进剂在火箭发射过程中发生反应的微观示意图。
①该反应中,反应物甲和生成物丙的分子数目之比为______。
②在该化学反应前后,没有发生变化的微粒是______(填微粒的名称)。
参考答案:
1.(1) 126.9 53
(2)元素
(3) 大脖子病 +5 I2
【详解】(1)元素周期表最下面数字表示相对原子质量,碘元素的相对原子质量为126.9;
左上角数字表示原子序数等于质子数,原子里质子数等于核外电子数,由图可知碘原子的核外电子数为53;
(2)物质是由元素组成的,因此这里的碘指的是元素;
(3)①人体缺碘会患甲状腺肿大即大脖子病;
②化合物中元素化合价代数和为0,KIO3中碘元素的化合价为
根据质量守恒定律反应前后原子的种类和个数不变,反应前有6K、6I、6H、3S、15O,反应后有6K、6H、3S、15O,因此3I含6个I,则X的化学式是I2
2.(1) 28.09 4
(2) SiHCl3+H2Si+3HCl 混合物
(3) Al2O3 (或MgO、CaO,TiO2等答案任写一种即可) -3价
【详解】(1)①由硅元素周期表中的一格可知,汉字下方的数字表示相对原子质量,故硅的相对原子质量为28.09;
②根据在原子中,质子数=核外电子数,即14=2+8+n,解得n=4;
(2)①由图可知,反应物为SiHCl3和H2,反应条件为高温,生成物为Si和HCl,该反应的方程式为;
②从物质分类角度看,纯度99.9%的硅芯片还含有0.01%的杂质,所以属于混合物;
(3)①氧化物是指由两种元素组成,且其中一种元素是氧元素的化合物,故其中的氧化物有氧化铝、氧化镁、氧化钙、氧化钛等,化学式分别为:Al2O3 、MgO、CaO,TiO2等;
②Ga2O3中氧元素显示-2价,设Ga的化合价为x,根据在化合物中正负化合价代数和为0的原则,则有2x+(-2)×3=0,解得x=+3,Ga2O3 、GaN两种物质中Ga的化合价相同都是+3价,则其中N的化合价为-3价。
3.(1)2
(2)106.4
(3) 16:1 C8H6+H2C8H8(“催化剂”写为“Pd或钯”也可)
【详解】(1)原子的核内质子数=核外电子数,所以x=28−2−8−16=2,故填2。
(2)元素信息图中,最下方的数字是元素原子的相对原子质量,由图可知,钯元素的相对原子质量为106.4,故填106.4。
(3)由苯乙炔化学式为C8H6,可知苯乙炔碳元素和氢元素的质量比为(12×8):(1×6)=16:1。
由图可知,苯乙炔与氢气在钯作催化剂的条件下反应生成苯乙烯,故反应的化学方程式写为:C8H6+H2C8H8(“催化剂”写为“Pd或钯”也可)。
4.(1)元素
(2) 2 4/四
(3)佝偻病或骨质疏松
(4)856mg
【详解】(1)文中所述“钙”“钾”指的是元素,而不是元素的具体存在形式。
(2)在原子中,质子数=核外电子数,则20=2+8+8+x,解得x=2,元素周期表中,元素的周期数=原子的电子层数,在该原子结构示意图中,电子层数为4,则钙元素位于元素周期表第4周期。
(3)青少年缺钙会导致佝偻病或营养不良,老年人缺钙会患骨质疏松症。
(4)由题意可知,一般人群中,每日的钙需求量约为107mg×4÷50%=856mg。
5.(1) +4
(2) 属于 HD
(3)1:2
【详解】(1)①TiO2中O的化合价是-2,化合物整体化合价为0,设Ti化合价为x,;
②水在光照二氧化钛催化下分解生成氢气和氧气,化学方程式为;
(2)①一个H原子和一个D原子的质子数都是1,原子序数相同,故属于相同元素;
②一个乙分子中含有一个H原子和一个D原子,故其化学式为HD;
(3)方法一每生成两份氢气需要一份氢化镁,方法二每生成两份氢气需要两份氢化镁,故“方法1”和“方法2所消耗MgH2的质量比是1:2。
6.(1)NaHCO3
(2)+1
(3)碳原子
(4)元素
(5)隔绝氧气
【详解】(1)小苏打是碳酸氢钠的俗名,它的化学式是NaHCO3;
(2)金属一般显正价,钠元素的化合价为+1价,氧元素的化合价为-2价,根据在化合物中各种元素化合价的代数和为零,设氯元素的化合价为a,+1+a+(-2)= 0,a=+1,所以氯元素为+1价;
(3)钻石是打磨过的金刚石,金刚石是碳单质,构成金刚石的微粒名称是碳原子;
(4)物质的组成常用元素来描述,首饰上镶嵌的蓝宝石主要成分是Al2O3,因为含有钛、铁显蓝色,这里的钛、铁指的是元素;
(5)灭火原理有三种,使温度降到可燃物的着火点以下、隔绝空气、清除或隔离可燃物,这里用沙土将残余火焰熄灭的灭火原理是隔绝空气(或隔绝氧气)。
7.(1)6.941
(2) 1 11
(3)失去
(4)+3
(5)AB
【详解】(1)元素周期表单元格中,最下方的数字表示相对原子质量,则锂的相对原子质量是6.941。
(2)由图可知,锂原子的最外层电子数是1;
原子中,质子数=核外电子数,则x=2+8+1=11。
(3)锂原子和钠原子的最外层电子数均小于4,在化学变化中易失去电子。
(4)LiCoO2中,Li的化合价为+1价,O的化合价为-2价,设Co的化合价为x,根据“化合物中各元素化合价代数和为零”,可知1+x+(-2)×2=0,解得x=+3。
(5)A、钠元素在自然界中的储量较为丰富,该选项叙述正确;
B、钠和锂的最外层电子数均为1,化学性质相似,该选项叙述正确;
C、废旧电池丢弃后,会污染环境,该选项叙述不正确。
故选AB。
8.(1) 8 26.98
(2)
(3)b
(4)
(5)含碳量
【详解】(1)原子中,质子数=核外电子数,则X=13-2-3=8;元素名称下面的数字表示相对原子质量,则铝的相对原子质量为26.98;
(2)在空气中铝制品更耐腐蚀,是因为铝与氧气反应生成一层致密的氧化铝薄膜,阻止铝进一步反应,反应的化学方程式为:;
(3)铝的化学性质活泼,不容易被冶炼,所以冶炼铝的技术要求高,故选b;
(4)一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,反应的化学方程式为:;
(5)生铁和钢都是铁和碳的合金,钢中含碳量低,炼钢中充氧的目的是降低生铁中的含碳量,获得性能更好的钢。
9.(1) 具有相同的核电荷数(或质子数) 失
(2) 错误 +4价
(3)LiOH
【详解】(1)①元素是具有相同核电荷数(即质子数)的一类原子的总称,所以硫原子和硫离子统称为硫元素的原因是具有相同核电荷数(即质子数);
②由镁原子的结构示意图可知,镁原子的最外层电子数为2,小于4,在化学反应中易失电子;
(2)根据氧化物是指由两种元素组成,且其中一种是氧元素的化合物,而Na2SiO3是由钠元素、硅元素和氧元素组成的化合物,故判断该物质属于氧化物是错误的;
Na2SiO3中钠元素显示+1价,氧元素显示-2价,设硅元素的化合价为x,根据在化合物中正负化合价代数和为0的原则,则有,解得x=+4;
(3)氢氧根显-1价,已知其中锂(Li)的化合价为+1,根据化合物的化学式书写:显正价的元素其符号写在左边,显负价的写在右边,化合价的绝对值交叉约减,得化学式右下角的数字,数字为1时不写。所以氢氧化锂的化学式为LiOH。
10.(1)2个氢原子
(2) 8 失去 Rb+
(3) 金属 132.9
【详解】(1)位于元素符号前面的数字:表示几个原子,所以2H表示:2个氢原子;
故答案为:2个氢原子;
(2)由铷(Rb)的原子结构示意图和原子中的数值关系:质子数=核电荷数=核外电子数可知,37=2+8+18+x+1,则x=8;
由铷(Rb)的原子结构示意图可知,铷的最外层电子数是1<4,容易失去最外层的一个电子,形成带一个单位正电荷的阳离子,其离子符号为:Rb+;
故答案为:8;失去;Rb+;
(3)铯带“钅字旁”,属于金属元素;
根据铯在元素周期表中的单元格信息可知,元素名称下面的数字表示其相对原子质量,单位是“1”,省略不写,所以铯的相对原子质量是132.9。
故答案为:金属;132.9。
11.(1)C
(2) C 52.00 13
(3)
(4)上升
【详解】(1)A、随手关灯,可以节约能源,减少二氧化碳的排放,属于低碳生活方式,不符合题意;
B、旧书本循环利用,可以减少森林的砍伐,增加二氧化碳的吸收,属于低碳生活方式,不符合题意;
C、夏天将空调温度调至最低,会造成资源浪费,增加二氧化的排放,不属于低碳生活,符合题意。
故选C。
(2)①A、金属部件镀金属铬,可以隔绝氧气和水,起到防锈的目的,不符合题意;
B、链条涂防锈油,可以隔绝氧气和水,起到防锈的目的,不符合题意;
C、雨淋后自然晾干,使铁与氧气和水接触,会加速铁的锈蚀,符合题意。
故选C。
②根据铬元素在元素周期表中的信息可知,元素名称正下方的数值是该元素的相对原子质量,故铬元素的相对原子质量为52.00;
原子核外的电子总数等于核内质子数,故x=24−2-8-1=13。
(3)氧化铁与稀硫酸反应生成硫酸铁和水,该反应的化学方程式为:。
(4)铁能与空气中的氧气和水反应,从而生锈,且食盐水会加速铁的锈蚀,由于消耗了氧气,装置内压强减小,故一段时间后可观察到导管内红墨水的液面上升。
12.(1)分解
(2) 40.08 失去 佝偻病(答案合理即可)
(3) 熟石灰/消石灰
【详解】(1)电解熔融的氯化钙得到金属钙和氯气,该反应是由一种物质生成两种物质的反应,符合“一变多”反应特征,所以属于分解反应;
故答案为:分解;
(2)由元素周期表中钙元素的单元格可知,元素名称下方的数字是钙元素的相对原子质量,则钙元素的相对原子质量为40.08,单位是“1”,省略不写;
由钙原子的原子结构示意图可知,钙原子的最外层电子数为2<4,在化学反应中易失去2个电子,形成钙离子;
人体内的钙99%存在于骨骼和牙齿中,钙元素摄入不足,可能导致的疾病是佝偻病,骨质疏松症等,答案合理即可;
故答案为:40.08;失去;佝偻病(答案合理即可);
(3)氢氧化钙俗称熟石灰或消石灰;
氢氧化钙溶液可用于检验二氧化碳,原理是二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水,反应的化学方程式为:。
故答案为:熟石灰或消石灰;。
13.(1) 非金属 79.90 四 B 6
(2) N2 NO2 D
【详解】(1)①溴的偏旁是“氵”,是非金属元素。
元素周期表一格左上方数字为原子序数,右上方符号是元素符号,中间汉字是元素名称,最下方数字为相对原子质量。所以溴的相对原子质量是79.90。
元素所在周期数与对应原子的电子层数相同,溴原子核外有4层电子,则溴位于第四周期。
②元素对应原子的最外层电子数相同,则元素的化学性质相似。溴原子最外层电子数为7,A最外层电子数为1,B最外层电子数为7,则溴元素的化学性质与图乙中B对应元素的化学性质相似。
③原子中质子数=核外电子数=核电荷数=原子序数。则16=2+8+x。x=6。
(2)①单质中元素化合价为0,化合物中各元素正负化合价代数和为0。则氮元素化合价为0的物质是氮气,化学式N2。
②A是氧化物,氧化物是由两种元素组成,其中一种是氧元素的化合物。氮元素的化合价为+4价,氧元素为-2价,化合物中各元素正负化合价代数和为0,则A为NO2。
③化合物中各元素正负化合价代数和为,NH3中氢元素为+1价,则N为-3价,图中D对应-3价,则D点对应的物质可能是NH3。
14.(1)Na+
(2)硅元素的原子序数为14(合理即可)
(3)A
(4) 2
1:1
【详解】(1)氯化钠是由钠离子和氯离子构成的,符号为Na+和Cl-。
(2)元素周期表单元格中,左上角的数字表示原子序数,最下方的数字表示相对原子质量,左上方的符号表示元素符号,则由图可知,硅元素的原子序数为14,相对原子质量为28.09,元素符号为Si等。
(3)原子结构示意图中,圆圈内的数字表示质子数,且质子数=核外电子数,则氦-3原子中,质子数=核外电子2,故选A。
(4)①由图可知,该反应的反应物有CO2和H2,生成物有CH4和H2O,氧化物是指含有两种元素,且一种元素为氧元素,则CO2和H2O属于氧元素,共两种。
②结合前面分析可知,该反应的化学方程式为,则该反应中CO2和CH4的分子个数比为1:1。
15.(1) 二 6
(2) 30.97 4P+5O22P2O5
(3) 硫 Cl-
【详解】(1)元素所在的周期数等于原子的电子层数,氧原子有两个电子层,故氧元素位于元素周期表的第二周期,原子中质子数等于核外电子数,故x=8-2=6。
(2)由元素周期表一格可知,最下面的数字为相对原子质量,故磷的相对原子质量为30.97;磷在空气中燃烧生成五氧化二磷,化学方程式为4P+5O22P2O5。
(3)由元素周期表一格可知,周期表中问号处应写的内容为元素的名称“硫”,由氯原子的结构示意图知,最外层电子数为7,大于4,易得一个电子,形成带一个单位的负电荷的氯离子,故氯离子的符号为Cl-。
16.(1) 40.08 20
(2)元素
(3) 骨质疏松
【详解】(1)根据元素周期表标签最下面数字表示相对原子质量,故如图可知钙元素的相对原子质量为40.08,故填:40.08;
根据元素周期表标签左上角数字表示原子序数,原子序数等于质子数等于原子的核外电子数,如图可知钙原子的核外电子数为20,故填:20;
(2)牛奶、豆类等食物含钙丰富,这里的“钙”指的是钙元素,故填:元素;
(3)①人体的骨骼主要含钙元素,故人体缺钙儿童会引起佝偻病,成年人会引起骨质疏松,故填:骨质疏松;
②碳酸钙和胃液中的盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:。
17.(1)N/O
(2)失去
(3)40.08
(4)A
【详解】(1)由“气”字旁可知,氮元素和氧元素属于非金属元素,由“金”字旁可知,钠元素属于金属元素,故填:N、O;
(2)钠原子的最外层电子数为1,小于4,在化学反应中,容易失去电子;
(3)在元素周期表中,元素名称下方的数字表示相对原子质量,故钙的相对原子质量为40.08;
(4)A、鸡蛋、牛肉富含蛋白质,符合题意;
B、玉米、土豆富含糖类,不符合题意;
C、牛油、菜子油富含油脂,不符合题意。
故选A。
18.(1)①
(2)能与氧气反应等其他合理答案
(3) 24.31 失去 最外层电子数(或核外电子排布)
【详解】(1)根据题意,能氧化为酸的简单非金属物质,① 磷属于非金属且对应的酸有磷酸,符合题意② 汞属于金属不符合题意; ③ 石灰不属于非金属单质,不符合题意;故选:① ;
(2)根据题意,镓元素与铝化学性质相似,由铝是活泼金属能与氧气、酸等反应,故填:能与氧气反应等其他合理答案;
(3)①由元素周期表标签可知最下面数字表示相对原子质量,如图镁元素的相对原子质量为24.31,故填:24.31;
②根据镁原子结构示意图最外层电子数为2,由最外层电子数小于4化学反应时易失去电子,故填:失去;由此判断最外层电子数与元素化学性质关系密切,故填;最外层电子数(或核外电子排布)。
19.(1) 85.47 1 五
(2)小
(3) 1:3 氮原子、氧原子、氢原子
【详解】(1)①根据元素周期表的信息可知,元素名称下方的数字表示相对原子质量,铷的相对原子质量为85.47,故填:85.47;
②原子中,质子数=核外电子数,则有37=2+8+18+8+x,得x=1,故填:1;
③周期数=原子核外电子层数,铷原子核外有5个电子层,则铷元素位于元素周期表中的第五周期,故填:五;
(2)合金的硬度比纯金属的硬度大,所以钛的硬度比钛合金的小,故填:小;
(3)①由反应的微观示意图可知,N2O4与N2H4在点燃的条件下生成氮气和水,反应的化学方程式为N2O4+2N2H43N2+4H2O,所以该反应中,反应物甲和生成物丙的分子数目之比为1:3,故填:1:3;
②根据质量守恒定律,化学反应前后原子种类和数目不变,所以该反应中,没有发生变化的微粒是氮原子、氧原子、氢原子,故填:氮原子、氧原子、氢原子。
相关试卷
这是一份备考2023年中考化学知识点模拟新题专项练习(福建专用)-43水(填空题),共21页。试卷主要包含了填空题等内容,欢迎下载使用。
这是一份备考2023年中考化学知识点模拟新题专项练习(福建专用)-42物质鉴别、分离、推断(填空题),共16页。试卷主要包含了填空题等内容,欢迎下载使用。
这是一份备考2023年中考化学知识点模拟新题专项练习(福建专用)-41化学与能源的开发利用(填空题),共30页。试卷主要包含了填空题等内容,欢迎下载使用。









