



- 考点16 化学键与分子间作用力——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试 试卷 1 次下载
- 考点17 化学反应与能量 原电池——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试 试卷 1 次下载
- 考点19 有机物的结构与性质1(甲烷 乙烯 乙炔 苯) ——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试 试卷 1 次下载
- 考点20 有机物的结构与性质2(乙醇 乙酸 酯 营养物质) ——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试 试卷 1 次下载
- 考点21 化学实验综合题 ——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试 试卷 1 次下载
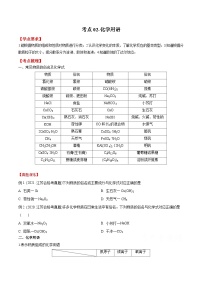
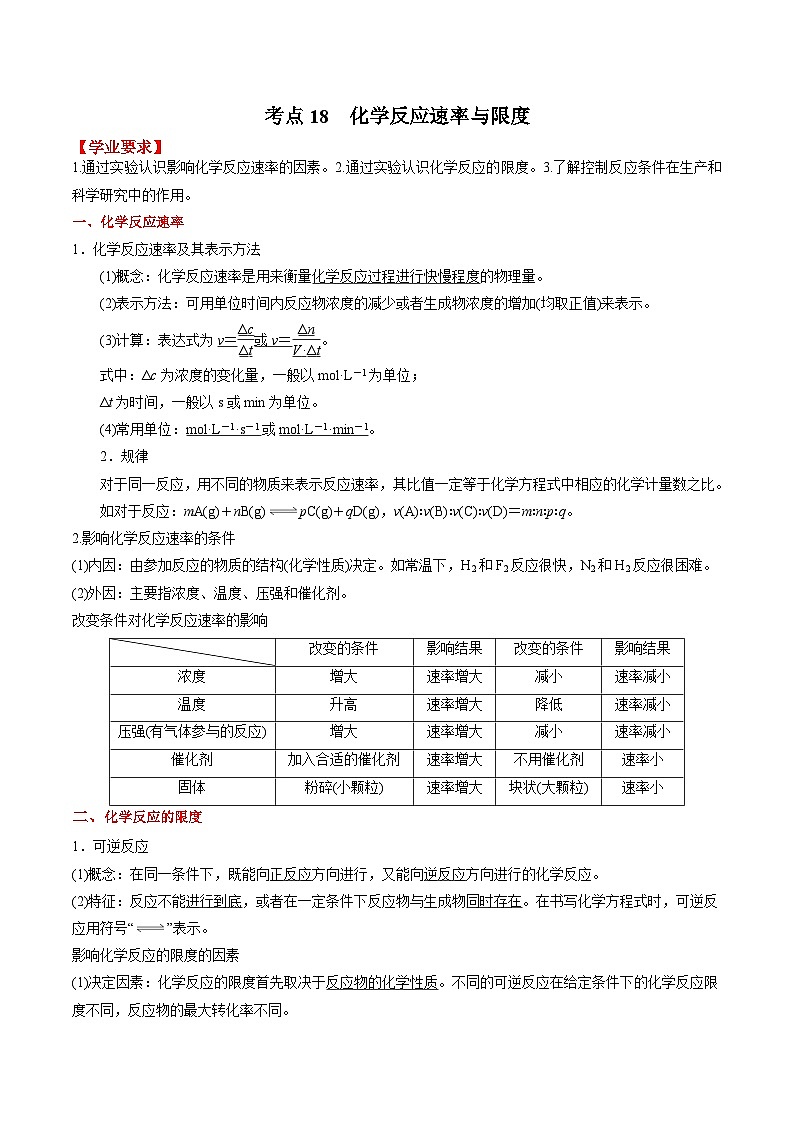
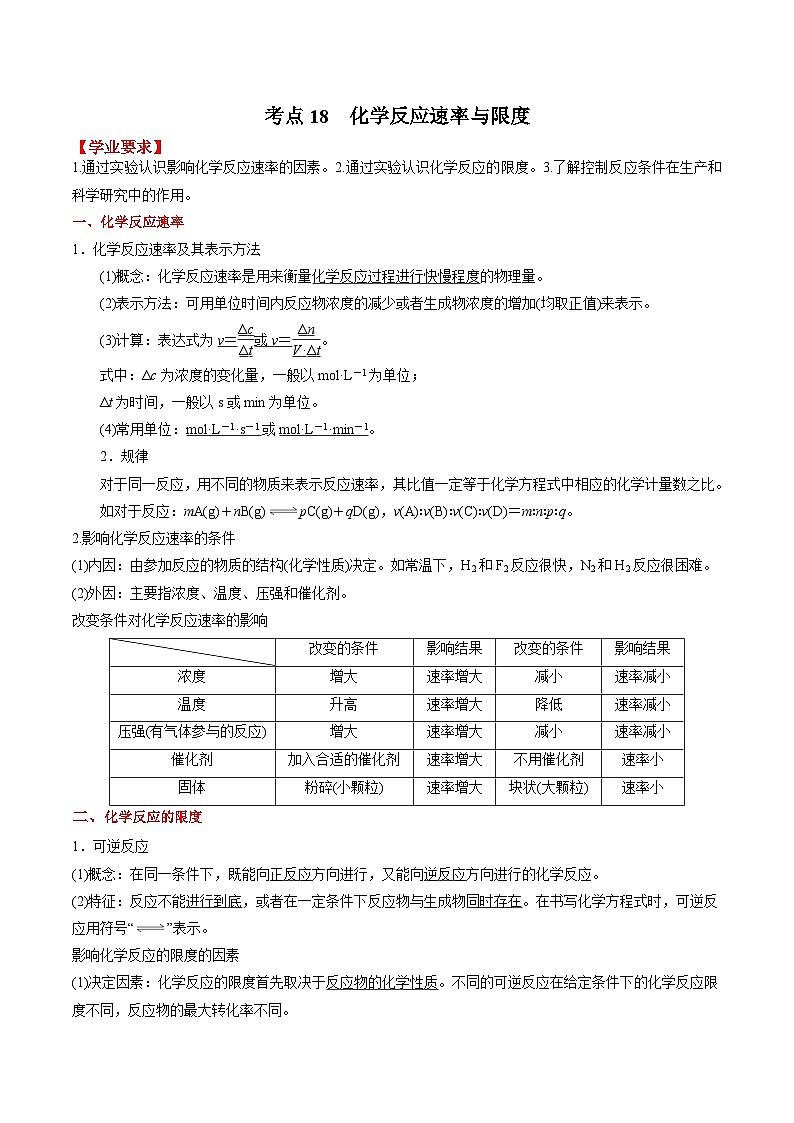
考点18 化学反应速率与限度 ——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试
展开考点18 化学反应速率与限度
【学业要求】
1.通过实验认识影响化学反应速率的因素。2.通过实验认识化学反应的限度。3.了解控制反应条件在生产和科学研究中的作用。
一、化学反应速率
1.化学反应速率及其表示方法
(1)概念:化学反应速率是用来衡量化学反应过程进行快慢程度的物理量。
(2)表示方法:可用单位时间内反应物浓度的减少或者生成物浓度的增加(均取正值)来表示。
(3)计算:表达式为v=或v=。
式中:Δc为浓度的变化量,一般以mol·L-1为单位;
Δt为时间,一般以s或min为单位。
(4)常用单位:mol·L-1·s-1或mol·L-1·min-1。
2.规律
对于同一反应,用不同的物质来表示反应速率,其比值一定等于化学方程式中相应的化学计量数之比。
如对于反应:mA(g)+nB(g)pC(g)+qD(g),v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。
2.影响化学反应速率的条件
(1)内因:由参加反应的物质的结构(化学性质)决定。如常温下,H2和F2反应很快,N2和H2反应很困难。
(2)外因:主要指浓度、温度、压强和催化剂。
改变条件对化学反应速率的影响
| 改变的条件 | 影响结果 | 改变的条件 | 影响结果 |
浓度 | 增大 | 速率增大 | 减小 | 速率减小 |
温度 | 升高 | 速率增大 | 降低 | 速率减小 |
压强(有气体参与的反应) | 增大 | 速率增大 | 减小 | 速率减小 |
催化剂 | 加入合适的催化剂 | 速率增大 | 不用催化剂 | 速率小 |
固体 | 粉碎(小颗粒) | 速率增大 | 块状(大颗粒) | 速率小 |
二、化学反应的限度
1.可逆反应
(1)概念:在同一条件下,既能向正反应方向进行,又能向逆反应方向进行的化学反应。
(2)特征:反应不能进行到底,或者在一定条件下反应物与生成物同时存在。在书写化学方程式时,可逆反应用符号“”表示。
影响化学反应的限度的因素
(1)决定因素:化学反应的限度首先取决于反应物的化学性质。不同的可逆反应在给定条件下的化学反应限度不同,反应物的最大转化率不同。
(2)外界因素:化学反应的限度受温度、浓度、压强等条件的影响。改变其中的一个条件,可以在一定程度上改变一个化学反应的限度。
2.化学平衡的建立
对于可逆反应2Fe3++2I-2Fe2++I2,其化学反应速率与时间的关系如图所示。
①反应开始时,正反应速率最大,原因是反应物浓度最大;逆反应速率为0,原因是生成物浓度为0;
②反应进行中,正反应速率的变化是逐渐减小,原因是反应物浓度逐渐减小;逆反应速率的变化是逐渐增大,原因是生成物浓度逐渐增大;
③反应一段时间(t1)后,正反应速率和逆反应速率的关系是大小相等,反应物的浓度不再改变,生成物的浓度不再改变。
【真题演练】
例1.(2021·江苏合格考)水—碳催化制氢的反应为:C+H2OH2+CO可应用于汽车尾气的净化,下列关于该反应的说法正确的是
A. 增大压强能减慢化学反应速率
B. 合适的催化剂能加快反应速率
C. 增大水蒸气的浓度能减慢化学反应速率
D. 达到化学平衡时,H2O能全部转化为H2
例2.(2020·江苏合格考)反应2NO+2CON2+2CO2可应用于汽车尾气的净化,下列关于该反应的说法正确的是( )
A. 升高温度能减慢反应速率 B. 减小CO浓度能加快反应速率
C. 使用恰当的催化剂能加快反应速率 D. 达到化学平衡时,NO能100%转化为产物
例3.(2018·江苏合格考)4NH3+5O24NO+6H2O是硝酸工业中的一个反应。下列关于该反应的说法正确的是( )
A. 增大反应物浓度能减慢反应速率 B. 降低温度能加快反应速率
C. 使用催化剂能加快反应速率 D. NH3与O2能100%转化为产物
例4.(2016·江苏合格考)实验室用大理石和盐酸制备CO2。下列措施可使反应速率加快的是( )
A.降低反应温度 B.延长反应时间 C.粉碎大理石 D.加水稀释盐酸
【核心归纳】
1.化学平衡状态的特征
2.化学反应的限度
(1)化学平衡状态是可逆反应达到的一种特殊状态,是在给定条件下化学反应所能达到的或完成的最大程度,任何可逆反应在给定条件下的进程都有一定的限度。
(2)不同条件下,同一可逆反应的化学反应限度不同;相同条件下,不同反应的化学反应限度也不同。
(3)化学反应的限度决定了反应物在该条件下转化为生成物的最大转化率。
3.化学平衡状态的判断依据
(1)直接判断依据:v正=v逆≠0
①同种物质:同一物质的生成速率等于消耗速率。
②不同物质:必须标明是“异向”的反应速率关系。如aA+bB⇌cC+dD,=时,反应达到平衡状态。
(2)间接判断依据:各种“量”不变
①各物质的质量、物质的量或浓度不变。②各物质的百分含量(物质的量分数、质量分数等)不变。
③温度、压强(化学反应方程式两边气体体积不相等)或颜色(某组分有颜色)不变。
总之,若物理量由变量变成了不变量,则表明该可逆反应达到平衡状态;若物理量为“不变量”,则不能作为平衡标志。
【过关检测】
1.(2022·南师大附中合格考模拟)反应3H2+N22NH3在密闭容器中进行。下列关于该反应的说法不正确的是( )
A.增大H2的浓度能加快反应速率
B.使用恰当的催化剂能加快反应速率
C.增大压强能加快反应速率
D.达到反应限度时各组分含量之比一定等于3∶1∶2
2.(2022·江苏合格考模拟)当其他条件不变时,下列说法正确的是( )
A.使用催化剂不会影响化学反应速率
B.用锌粉代替锌粒与稀硫酸反应能加快反应速率
C.当反应物与生成物浓度相等时,可逆反应已经达到平衡状态
D.在合成氨反应中,增大N2浓度可以使H2的转化率达到100%
3.(2022·泰州中学合格考模拟)CO和H2在一定条件下可合成甲醇CO(g)+2H2(g)CH3OH(g),下列叙述正确的是( )
A.CO和H2可全部转化为甲醇
B.当反应物和生成物浓度相等时,反应达到平衡
C.增大CO浓度能加快反应速率
D.单位时间消耗0.1 mol CO同时生成0.1 mol甲醇时,反应达到平衡
4.(2022·泰州中学合格考模拟)反应2SO2+O22SO3在密闭容器中进行。下列关于该反应的说法正确的是( )
A.增大压强能减慢反应速率
B.v(SO2)∶v(O2)=2∶1证明该反应已达化学平衡状态
C.当反应物和生成物浓度不变时,反应已达平衡
D.增大O2的浓度可使SO2完全转化
5.(2022·泰州中学合格考模拟)氢气与一氧化碳按比例反应:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)。下列有关该反应的说法正确的是( )
A.升高温度,该反应速率降低
B.增大压强,该反应速率加快
C.达化学平衡状态时,CO与H2不再发生反应
D.若反应中加入足量的H2,可使CO 100%转化为CH3OCH3
6.(2022·泰州中学合格考模拟)一定条件下,在体积一定的密闭容器中加入1 mol N2和3 mol H2发生反应N2+3H22NH3(正反应是放热反应)。下列有关说法正确的是( )
A.达到化学反应限度时,生成2 mol NH3
B.1 mol N2和3 mol H2的总能量低于2 mol NH3的总能量
C.升高温度能加快反应速率
D.平衡时N2、H2和NH3的物质的量之比一定等于1∶3∶2
7.(2022·江苏合格考模拟)CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)。下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A.CO全部转化为乙醇
B.正反应和逆反应的化学反应速率均为零
C.CO和H2以1∶2的物质的量之比反应生成乙醇
D.反应体系中乙醇的物质的量浓度不再变化
8.(2022·盐城合格考模拟)反应2SO2+O22SO3在密闭容器中进行。下列关于该反应的说法正确的是( )
A.增大压强能减慢反应速率
B.升高温度能减慢反应速率
C.使用恰当的催化剂能加快反应速率
D.0.2 mol SO2与0.1 mol O2充分反应生成0.2 mol SO3
9.(2022·江苏合格考模拟)工业上合成氨的反应原理为N2+3H22NH3。下列有关该反应说法错误的是( )
A.增加N2的浓度能加快反应速率
B.升高体系的温度能加快反应速率
C.使用合适的催化剂能加快反应速率
D.若反应在密闭容器中进行,N2和H2能100%转化为NH3
10.(2022·江苏合格考模拟)N2+3H22NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是( )
A.达到平衡时,反应速率:v正=v逆=0
B.增加N2的浓度能加快反应速率
C.降低体系温度能加快反应速率
D.若在反应的密闭容器加入1 mol N2和过量的H2,最后能生成2 mol NH3
11.(2022·江苏合格考模拟)N2+3H22NH3是工业上制造氮肥的重要反应。下列有关说法正确的是( )
A.降低N2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.达到平衡时各组分含量之比一定等于1∶3∶2
D.达到平衡时N2的浓度不再变化
12.(2022·扬州合格考模拟)反应2CO2+6H2CH2===CH2+4H2O可用于合成烯烃。下列有关说法错误的是( )
A.增大压强可加快该反应速率
B.升高温度能加快该反应速率
C.增大H2的浓度能加快该反应速率
D.密闭容器中,通入略过量的CO2可以实现H2的100%转化
13.(2022·启东合格考模拟)一定温度下,某不饱和H2SO3溶液中存在如下反应:SO2+H2O H2SO3,下列关于该反应的说法错误的是( )
A.该反应是可逆反应
B.微热可使反应速率加快
C.继续通入SO2可加快反应速率
D.加入大量的水可使SO2完全转化为H2SO3
14.(2022·盐城合格考模拟)目前国际空间站处理CO2废气涉及的反应为CO2+4H2CH4+2H2O。下列关于该反应的下列说法正确的是( )
A.钌催化剂能加快该反应的速率
B.升高温度能减慢该反应的速率
C.达到平衡时,CO2能100%转化为CH4
D.达到平衡时,反应速率:v正=v逆=0
15.(2022·连云港合格考模拟)CO和H2在一定条件下可合成甲醇:CO(g)+2H2(g)CH3OH(g),下列叙述正确的是( )
A.CO和H2可全部转化为甲醇
B.降低体系温度能加快反应速率
C.增大CO浓度能加快反应速率
D.使用催化剂不影响反应速率
16.(2022·徐州合格考模拟)一定条件下将0.1 mol N2和0.3 mol H2置于密闭容器中发生反应:N2+3H22NH3。下列关于该反应的说法正确的是( )
A.最终可生成0.2 mol NH3
B.增大压强能使反应速率减小
C.降低反应体系的温度能加快反应速率
D.向容器中再加入N2,能加快反应速率
17.(2022·南通合格考模拟)工业制备硫酸过程中存在如下反应:2SO2+O22SO3,下列关于该反应的说法正确的是( )
A.增大O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂不影响反应速率
D.一定条件下SO2能100%转化为SO3
18.(2022·泰州合格考模拟)下列有关化学反应速率与化学反应限度的叙述中,不正确的是( )
A.化学反应速率是表示化学反应快慢的物理量
B.一般情况下,升高温度能加快化学反应速率
C.可逆反应达到化学反应限度时,反应就静止不动了
D.可逆反应达到化学反应限度时,正反应速率等于逆反应速率
19.(2022·宿迁合格考模拟)对于硫酸工业中SO2的催化氧化反应2SO2+O22SO3,下列说法错误的是( )
A.使用合适的催化剂能加快化学反应速率
B.增大O2浓度可以使SO2转化率达到100%
C.降低反应温度,化学反应速率减慢
D.增大O2浓度,化学反应速率增大
20.(2022·连云港合格考模拟)对于反应2SO2+O22SO3,下列说法正确的是( )
A.工业上常使用过量的空气,目的是为了使SO2的转化率达到100%
B.工业上选用V2O5作该反应的催化剂,目的是为了加快化学反应速率
C.工业上常选用常压,原因是增大压强不能改变该反应的化学反应速率
D.升高温度可以加快反应速率,所以在工业生产中该反应温度越高越好
考点22 化工流程综合题 ——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试: 这是一份考点22 化工流程综合题 ——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试,文件包含考点22化工流程综合题2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试解析版docx、考点22化工流程综合题2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试原卷版docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。
考点15 硅及其化合物——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试: 这是一份考点15 硅及其化合物——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试,文件包含考点15硅及其化合物2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试解析版docx、考点15硅及其化合物2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试原卷版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。
考点09 钠及其化合物——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试: 这是一份考点09 钠及其化合物——2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试,文件包含考点09钠及其化合物2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试解析版docx、考点09钠及其化合物2023年江苏省普通高中化学学业水平合格性考试专项精讲+测试原卷版docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。