




所属成套资源:2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2)
- 考点06 氯及其化合物(测试)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2) 试卷 0 次下载
- 考点06 氯及其化合物(考点归纳)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2) 试卷 0 次下载
- 考点07 铁及其化合物(考点归纳)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2) 试卷 0 次下载
- 考点08 金属材料 铝及其化合物(测试)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2) 试卷 0 次下载
- 考点08 金属材料 铝及其化合物(考点归纳)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2) 试卷 0 次下载
考点07 铁及其化合物(测试)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2)
展开
这是一份考点07 铁及其化合物(测试)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2),文件包含考点07铁及其化合物解析版docx、考点07铁及其化合物原卷版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
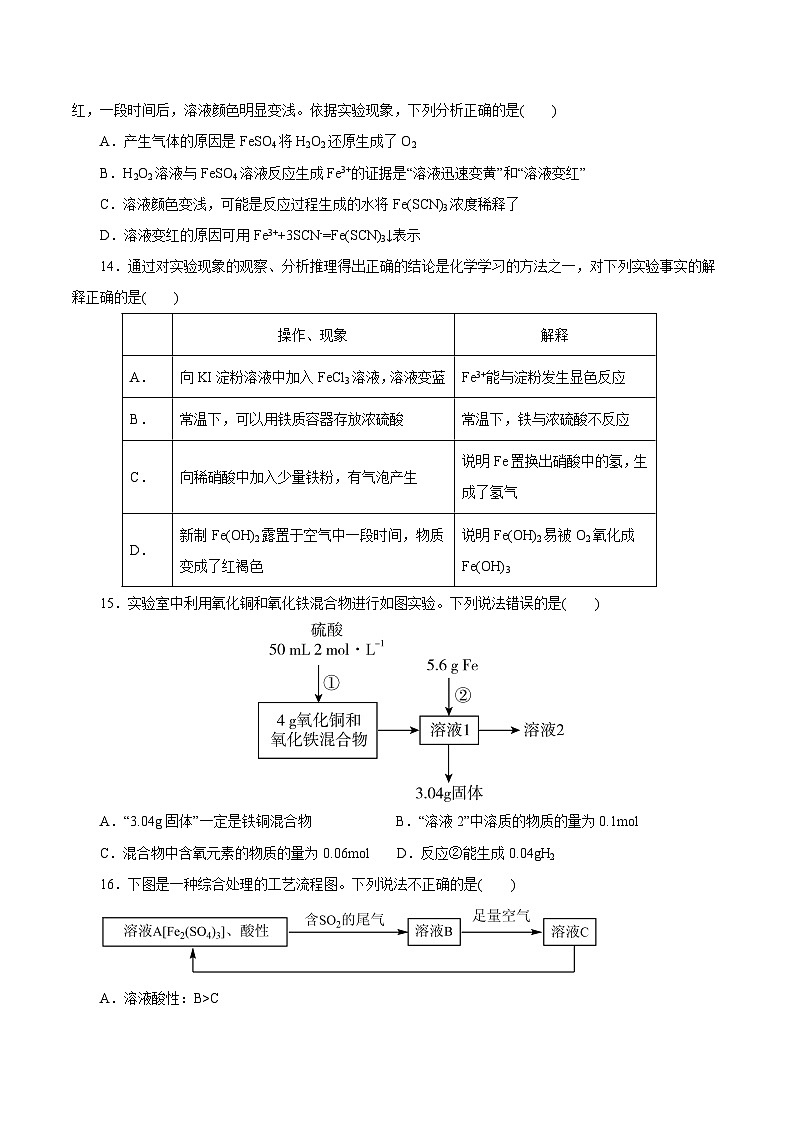
测试07 铁及其化合物一、选择题1.下列关于铁及其化合物的说法中,不正确的是( ) A.金属铁可被磁铁吸引 B.铁元素有可变化合价C.铁丝在氯气中燃烧生成FeCl2 D.常温下铁片遇浓硫酸会发生钝化2.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O43.向某溶液中加入含Fe2+的溶液后,无明显变化,当再滴加几滴新制的氯水后,混合液变成红色,则下列结论中错误的是( )A.该溶液中一定含有SCN- B.氧化性:Fe3+>Cl2C.Fe2+与SCN-不能形成红色物质 D.Fe2+被氯水氧化成Fe3+4.明代宋应星所著《天工开物》中有记载:“黄矾,乃即炼皂矾(FeSO4·7H2O)炉侧土墙……刮取下来,名日黄矾,染家用之。金色浅者涂炙,立成紫赤色也。”下列有关黄矾说法错误的是( )A.黄矾的主要成分中含有Fe3+ B.黄矾在医药上可以作补铁剂C.黄矾可以应用于印染工业 D.黄矾经火烤,立刻生成Fe2O35.关于铁及其化合物的叙述不正确的是( )A.铁的三种常见氧化物都不溶于水,也不与水反应B.红热的铁与水蒸气反应生成氢氧化铁和氢气C.可以用丁达尔效应区别Fe(OH)3胶体与FeCl3溶液D.生铁是铁的一种合金6.下列关于铁的氧化物的说法不正确的是( )A.铁的氧化物通常状况下都是有色固体B.四氧化三铁是一种复杂铁的氧化物,它与盐酸反应后溶液中同时存在Fe2+和Fe3+C.将Fe(OH)2露置在空气中加热灼烧所得的产物为Fe3O4D.工业上常使用铁的氧化物作原料冶炼铁7.下列有关铁元素的叙述中正确的是( )A.Fe(OH)2易被氧化成 Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3 B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为 FeX3 C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O D.将FeCl3 饱和溶液滴入 NaOH 溶液中可制备Fe(OH)3胶体8.能正确表示下列反应的离子方程式的是( )A.将铜屑加入FeCl3溶液中:Fe3++Cu=Fe2++Cu2+B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2OC.将氯化亚铁溶液与稀硝酸混合:3Fe2++4H++NO3-=3Fe3++NO↑+2H2OD.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O9.铁是人类应用较早,当前应用量最大的金属元素。下列有关铁及其化合物的有关说法中正确的是( )A.赤铁矿的主要成分是Fe3O4B.铁与水蒸气在高温下的反应产物为Fe2O3和H2C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤D.Fe3+与KSCN产生血红色沉淀10.向FeCl3溶液中同时加入铁粉和铜粉,充分反应后不会出现的结果是( )A.铁、铜都有 B.铁、铜均无 C.有铜无铁 D.有铁无铜11.贫血是一种常见的疾病,其中缺铁性贫血是贫血中最常见的类型,通常补铁剂会与维生素C同服。下列有关叙述中错误的是( )A.补铁剂中的铁以Fe3+形式存在 B.铁是人体必需的微量元素C.补铁剂搭配的维生素C具有还原性 D.Fe2+具有还原性,能被氧化成Fe3+12.实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验点滴板上描述的实验现象或推论正确的是( )A.新制氯水滴加到试纸以及淀粉溶液孔穴中,都体现新制氯水的漂白性B.生锈铁屑加入过量稀硫酸反应后,若加入KMnO4褪色,说明该溶液中有存在C.Na2O2固体中滴加FeCl2溶液后最终为白色沉淀D.生锈铁屑加入足量稀硫酸后,若加入溶液,溶液一定变血红色13.向H2O2溶液中滴加少量FeSO4溶液,溶液迅速变黄,稍后产生气体;再加入KSCN溶液,溶液变红,一段时间后,溶液颜色明显变浅。依据实验现象,下列分析正确的是( )A.产生气体的原因是FeSO4将H2O2还原生成了O2B.H2O2溶液与FeSO4溶液反应生成Fe3+的证据是“溶液迅速变黄”和“溶液变红”C.溶液颜色变浅,可能是反应过程生成的水将Fe(SCN)3浓度稀释了D.溶液变红的原因可用Fe3++3SCN-=Fe(SCN)3↓表示14.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验事实的解释正确的是( ) 操作、现象解释A.向KI淀粉溶液中加入FeCl3溶液,溶液变蓝Fe3+能与淀粉发生显色反应B.常温下,可以用铁质容器存放浓硫酸常温下,铁与浓硫酸不反应C.向稀硝酸中加入少量铁粉,有气泡产生说明Fe置换出硝酸中的氢,生成了氢气D.新制Fe(OH)2露置于空气中一段时间,物质变成了红褐色说明Fe(OH)2易被O2氧化成Fe(OH)315.实验室中利用氧化铜和氧化铁混合物进行如图实验。下列说法错误的是( )A.“3.04g固体”一定是铁铜混合物 B.“溶液2”中溶质的物质的量为0.1molC.混合物中含氧元素的物质的量为0.06mol D.反应②能生成0.04gH216.下图是一种综合处理的工艺流程图。下列说法不正确的是( )A.溶液酸性:B>CB.向溶液B中滴加KSCN溶液,溶液一定变为红色C.溶液C的主要成分为H2SO4和Fe2(SO4)3D.溶液A转化为溶液B的离子方程式:2Fe3++SO2+2H2O=2Fe2++4H++SO42-17.对印刷电路板制作过程中产生废液X进行回收处理,流程如图所示。下列说法错误的是( )A.若废液X中含,则X中存在B.操作①的名称为过滤,需要用到的玻璃仪器有烧杯、漏斗和玻璃棒C.可以用酸性KMnO4溶液检验溶液A中是否含Fe2+D.若向溶液B中加入少量铁粉,发生的反应为2Fe+6H+=2Fe3++3H2↑18.从黑铜矿(主要含有Cu2S、FeS和少量SiO2杂质),利用黑铜矿湿法炼铜并制取硫酸亚铁溶液的工艺流程如图:下列说法错误的是( )A.黑铜矿在“高温煅烧”前需要经过粉碎处理B.“高温煅烧”时,每生成1molSO2,转移6mol电子C.酸浸时,应加入稍过量的稀硫酸,提高浸出率D.固体X可以为铁粉,试剂Y可以为CuSO4溶液19.FeSO4在工业上用途广泛,通过下列实验探究FeSO4溶液性质实验l:向FeSO4溶液中滴入少许Na2CO3溶液,出现白色沉淀。实验2:向FeSO4溶液中加入NaOH溶液,出现白色絮状沉淀,渐变成灰绿色,最后成红褐色沉淀。实验3:向FeSO4溶液中滴入KSCN溶液,出现红色。实验4:向FeSO4溶液中滴入酸性KMnO4溶液,KMnO4溶液褪色。下列说法不正确的是( )A.实验1中发生的离子反应为:Fe2++CO32-=FeCO3↓B.实验2现象说明Fe(OH)2具有还原性C.实验3现象说明FeSO4氧化变质D.实验4现象说明FeSO4具有漂白性20.现有16.8gFe粉,加入VL1mol·L-1HNO3溶液使其恰好完全溶解后,向所得溶液中继续滴加稀硫酸,至不再产生气泡。下列说法正确的是( )A.反应过程中产生气体的总体积为6.72LB.V=0.8C.该实验可以证明Fe2+与NO3-不能大量共存D.滴加稀硫酸时,产生的气体为SO221.1.12g铁粉加入25mL2mol/L的三氯化铁溶液中,充分反应后,其结果不可能的是( )A.铁有剩余 B.往溶液中滴入无色KSCN溶液,溶液显红色C.氧化产物和还原产物的物质的量之比为2∶1 D.Fe2+和Fe3+的物质的量之比为6∶122.FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示,下列说法不正确的是( )A.产品FeCO3在空气中高温分解不能得到纯净的FeOB.沉淀过程中没有CO2气体放出C.过滤操作常用的玻璃仪器有烧杯、漏斗和玻璃棒D.可利用KSCN溶液检验FeSO4溶液是否变质23.在人类文明中,金属铁的重要性独一无二:人类用铁的历史至少已有3000年,现在每年生产和使用的铁超过10亿吨。铁元素具有多种可变价态,有0、+2、+3、+6等,不同价态的铁在一定条件下可以相互转化,如2FeCl3+Fe=3FeCl2,2FeCl3+Cu=2FeCl2+CuCl2,Fe+CuCl2=FeCl2+Cu。某化学实验室产生的废液中含有FeCl3、CuCl2、BaCl2三种物质,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。下列说法不正确的是( )A.沉淀1中的单质为铁和铜B.试剂X应为NaOHC.“过滤3”到“氧化”是为了充分回收铁元素D.氧化方程式为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O24.部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )A.固体g溶于氢碘酸的离子方程式为Fe2O3+6H+=2Fe3++3H2OB.a能与水蒸气发生置换反应C.通过化合反应或复分解反应均能直接得到eD.可存在c→d→e→f→c的循环转化关系25.化学是一门以实验为基础的学科,某同学为探究FeCl3溶液的性质进行如下实验,操作如图所示,根据实验现象下列分析不正确的是( )A.①~④的变化中,仅有1处涉及氧化还原反应B.③中反应的离子方程式:2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑C.若将FeCl3溶液滴加到Na2S溶液中,产生的现象与图中①、②现象相同D.若用Na2SO3代替Na2S进行实验溶液也能变成淡绿色二、非选择题26.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。 请回答该实验中的问题。(1)圆底烧瓶中盛装水,烧瓶里应事先放置碎瓷片,其作用是______________。(2)若该反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2,求16.8克铁粉完全反应转移的电子为___________mol。(3)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是_________,若溶液未变红色则说明硬质试管中固体物质的成分____________。27.某废料铁泥主要成分为Fe2O3、FeO和Fe,其他杂质不与硫酸反应。现取wg废料铁泥提取Fe2O3,设计实验流程如下:(1)写出步骤(I)中铁单质参与的有关反应的离子方程式_______,分离溶液A和沉淀C的操作名称是_______。(2)检验溶液A中含有Fe2+应选用的试剂是A.铁粉 B.FeCl3溶液 C.酸性KMnO4溶液 D.KSCN溶液(3)步骤(II)中加入H2O2溶液,H2O2在反应中作_______(填“氧化剂”或“还原剂”)。(4)步骤(IV)中生成的Fe2O3固体的颜色是_______。(5)若最终获得ngFe2O3,则铁泥中铁元素的质量分数为_______。28.铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。Ⅱ.KSCN中的硫元素为-2价。Ⅲ.Fe(OH)3受热分解生成Fe2O3。实验Ⅰ.检验该补铁剂中铁元素的价态。(1)将补铁剂碾碎的目的是_______。(2)试剂1是_______,试剂2是_______。(3)加入试剂2后溶液变为浅红色,说明溶液①中含有_______。(4)能证明溶液①中含有的实验现象是_______。(5)补全在上述条件下与H2O2发生反应的离子方程式: ___________________________ H2O2=_______+______(6)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的与H2O2发生了化学反应。甲同学猜测的理论依据是_______。实验Ⅱ.测定该补铁剂中铁元素的含量。(7)易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是_______。(8)计算每片该补铁剂含铁元素的质量为_______g.29.铁红(Fe2O3)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为Fe2O3、Fe3O4,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:回答下列问题:(1)工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是_______。(2)“酸浸”时加入的硫酸不宜过量太多的原因是_______。(3)“过滤1”所得滤液中含有的阳离子有_______。(4)“过滤2”所得滤渣的主要成分为FeOOH和FeCO3,所得滤液中的主要溶质是_______(填化学式)。(5)写出FeCO3在空气中焙烧生成铁红的化学方程式:_______。30.化合物X由4种元素组成,按如下流程进行探究:已知混合气体E与G的成分及成分之间比例相同,且G的质量是E的1.5倍。请回答:(1)组成X的四种元素_______(填元素符号),X的化学式_______。(2)写出固体B使酸性高锰酸钾溶液褪色的离子方程式_______。(3)X分解成A、B、C的化学方程式_______。(4)探究固体D时把H2O2溶液改为氯水,逐滴加入氯水至过量的过程中,溶液先变血红色后褪色,褪色的原因可能是_______。请设计实验证明_______。
相关试卷
这是一份考点22 化学实验基础(测试)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2),文件包含考点22化学实验基础解析版docx、考点22化学实验基础原卷版docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。
这是一份考点19 乙醇与乙酸(考点归纳)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2),文件包含考点19乙醇与乙酸教师版docx、考点19乙醇与乙酸学生版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
这是一份考点11 化学键(测试)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2),文件包含考点11化学键解析版docx、考点11化学键原卷版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。









