




所属成套资源:2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2)
- 考点20 基本营养物质(测试)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2) 试卷 1 次下载
- 考点20 基本营养物质(考点归纳)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2) 试卷 1 次下载
- 考点21 化学与可持续发展(测试)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2) 试卷 0 次下载
- 考点22 化学实验基础(测试)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2) 试卷 0 次下载
- 考点22 化学实验基础(考点归纳)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2) 试卷 1 次下载
考点21 化学与可持续发展(考点归纳)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2)
展开
这是一份考点21 化学与可持续发展(考点归纳)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2),文件包含考点21化学与可持续发展教师版docx、考点21化学与可持续发展学生版docx等2份试卷配套教学资源,其中试卷共43页, 欢迎下载使用。
考点21 化学与可持续发展
1.知道金属冶炼的常见方法,了解金属资源合理开发和利用的主要途径。
2.了解海水水资源和化学资源开发利用的主要途径和方法。
3.煤、石油和天然气综合利用的主要途径。
4.了解常见的化学品,认识化学品对农业生产、生命健康的意义。
5.了解合理使用化学品的方法和原则,知道不合理使用化学品造成的危害。
6.能列举常见的环境污染的成因、危害及其防治措施的化学原理。
7.了解绿色化学思想,并能运用其分析和讨论化工生产的相关问题。
考点一 自然资源与可持续发展
1.自然资源:是人类社会发展不可或缺的自然物质基础,包括土地与土壤资源、矿产资源、生物资源、水资源、能源资源、环境资源等,根据其能否再生可以分为可再生_资源和不可再生资源。
2.可持续发展的目标:是在满足人类需要的同时,强调人类的行为要受到自然界的制约,强调人类代际之间、人类与其他生物种群之间、不同国家和不同地区之间的公平。它包括经济可持续发展、社会可持续发展、资源可持续发展、环境可持续发展等方面。
考点二 金属矿物的开发利用
1.(1)金属冶炼的原理和实质
①金属冶炼的原理:利用氧化还原反应的原理,在一定条件下,用还原剂或者加热、电解的方法把金属化合物还原为金属单质。
②金属冶炼的实质:金属离子金属单质,即Mn++ne-===M。
2.冶炼步骤
—
↓
—
↓
—
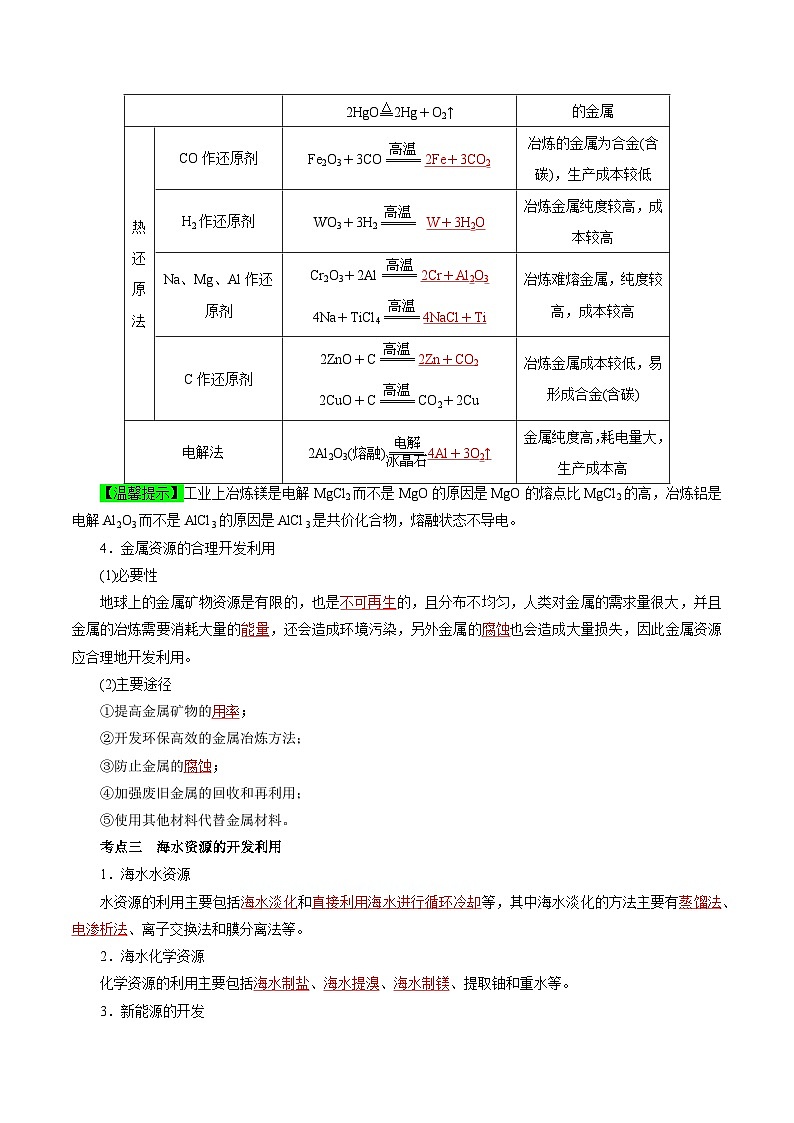
3.几种常用金属冶炼方法
方法名称
举例
主要特点
热分解法
2Ag2O4Ag+O2↑
2HgO2Hg+O2↑
适合冶炼活动性较差的金属
热还原法
CO作还原剂
Fe2O3+3CO2Fe+3CO2
冶炼的金属为合金(含碳),生产成本较低
H2作还原剂
WO3+3H2 W+3H2O
冶炼金属纯度较高,成本较高
Na、Mg、Al作还原剂
Cr2O3+2Al2Cr+Al2O3
4Na+TiCl44NaCl+Ti
冶炼难熔金属,纯度较高,成本较高
C作还原剂
2ZnO+C2Zn+CO2
2CuO+CCO2+2Cu
冶炼金属成本较低,易形成合金(含碳)
电解法
2Al2O3(熔融)4Al+3O2↑
金属纯度高,耗电量大,生产成本高
【温馨提示】工业上冶炼镁是电解MgCl2而不是MgO的原因是MgO的熔点比MgCl2的高,冶炼铝是电解Al2O3而不是AlCl3的原因是AlCl3是共价化合物,熔融状态不导电。
4.金属资源的合理开发利用
(1)必要性
地球上的金属矿物资源是有限的,也是不可再生的,且分布不均匀,人类对金属的需求量很大,并且金属的冶炼需要消耗大量的能量,还会造成环境污染,另外金属的腐蚀也会造成大量损失,因此金属资源应合理地开发利用。
(2)主要途径
①提高金属矿物的用率;
②开发环保高效的金属冶炼方法;
③防止金属的腐蚀;
④加强废旧金属的回收和再利用;
⑤使用其他材料代替金属材料。
考点三 海水资源的开发利用
1.海水水资源
水资源的利用主要包括海水淡化和直接利用海水进行循环冷却等,其中海水淡化的方法主要有蒸馏法、电渗析法、离子交换法和膜分离法等。
2.海水化学资源
化学资源的利用主要包括海水制盐、海水提溴、海水制镁、提取铀和重水等。
3.新能源的开发
(1)从海水中提取铀和重水,铀和重水是核能开发的重要原料。
(2)潮汐能、波浪能是待开发的新型能源。
考点四 几种海水化学资源的开发途径
1.海水制盐
海水粗盐精盐。
2.海带提碘
(1)流程:海带→灼烧→浸泡→过滤氧化→提纯→碘单质。
(2)原理:2I-+Cl2==I2+2Cl-。
3.海水提溴
4.海水提镁
(1)过程:浓缩沉淀―→过滤溶解―→结晶(MgCl2·6H2O)MgCl2晶体金属镁。
(2)原理:①沉淀:Mg2++2OH-==Mg(OH)2↓
②溶解:Mg(OH)2+2HCl==MgCl2+2H2O
③脱水:MgCl2·6H2OMgCl2+6H2O
④电解:MgCl2(熔融)Mg+Cl2↑
考点五 煤、石油和天然气的综合利用
1.煤的组成和加工
(1)组成:
(2)煤的综合利用
煤的综合利用主要是通过煤的气化、液化和干馏,获得洁净的燃料和多种化工原料。
①煤的气化
含义:把煤转化为可燃性气体的过程。
原理:制水煤气的反应为C+H2O(g)CO+H2。
应用:制备燃料或化工原料气。
②煤的液化
含义:煤的液化是把煤转化为液体燃料的过程。
原理:a.把煤和氢气作用,得到液体燃料;b.煤气化生成的水煤气(CO和H2)合成液态碳氢化合物和含氧有机化合物。
(3)煤的干馏
煤干馏是将煤隔绝空气加强热,得到焦炭、煤焦油、焦炉气、粗氨水、粗苯等,煤焦油经分离可得到苯、甲苯、二甲苯等有机化合物。
2.天然气的组成和利用
3.石油的组成和加工
(1)石油的成分:多种碳氢化合物组成的混合物,所含元素以C、H为主。
(2)石油加工
【温馨提示】煤的干馏、气化、液化和石油的裂化、裂解均是化学变化,而石油的分馏是物理变化。
考点六 化肥农药的合理使用
1.化学品的分类
化学品可分为大宗化学品和精细化学品,如乙烯、硫酸、纯碱和化肥等属于大宗化学品,医药、农药、日用化学品和食品添加剂等属于精细化学品。
2.化肥的合理施用
(1)农业生产中常见的化肥:
氮肥
铵态氮肥:NH4HCO3、NH4Cl、(NH4)2SO4、NH4NO3等,尿素CO(NH2)2
磷肥
过磷酸钙:Ca(H2PO4)2和CaSO4的混合物,重过磷酸钙Ca(H2PO4)2·H2O
钾肥
草木灰:主要成分是K2CO3,硫酸钾(K2SO4),氯化钾(KCl)
复合肥
KNO3、KH2PO4
(2)合理施用化肥应考虑的因素:土壤酸碱性、作物营养状况、化肥本身的性质
(3)实例:①硝酸铵是一种高效氮肥,但受热或经撞击易发生爆炸,因此必须作改性处理后才能施用。
②草木灰和铵态氮肥混合施用时会产生氨气,从而导致铵态氮肥的肥效降低
(4)不合理施用化肥的危害:
①水体污染:由于很多化肥易溶于水,过量施用不仅浪费,而且部分化肥会随着雨水流入河流和湖泊,造成水体富营养化、产生水华等污染现象
②危害土壤:影响土壤的酸碱性和土壤结构
3.农药的合理施用
(1)农药的种类:
①天然植物农药:除虫菊、烟草
②无机农药:波尔多液、石灰硫黄合剂
③有机合成农药:有机氯农药、有机磷农药、氨基甲酸酯和拟除虫菊酯类农药
(2)农药的发展方向:高效、低毒、低残留
(3)农药对生态系统和自然环境的影响
①可能会破坏害虫与天敌之间的生态平衡,一些害虫还会产生抗药性
②蜜蜂等传粉昆虫对农药很敏感,大田用药如不注意就会引起这些昆虫的大量死亡
③农药施用方法、用量和时机不当,会造成土壤和作物的农药残留超标,以及大气、地表水和地下水的污染
考点七 合理用药
1.药物的分类:
(1)按照来源:天然药物和合成药物,现有的药物中大部分属于合成药物
(2)按照作用分:抗酸药、解热镇痛药、抗生素、合成抗菌药、安眠药、镇静药、止泻药等等
2.药物在人体内的作用方式:
(1)通过改变机体细胞周围的物理、化学环境而发挥药效。如:抗酸药
(2)通过药物分子与机体生物大分子的功能基团结合而发挥药效,其分子结构与生物活性密切相关。如磺胺类药物等
3.解热镇痛药——阿司匹林
(1)化学名称:乙酰水杨酸
(2)制备:以水杨酸为原料:
(3)主要功效:解热镇痛
(4)不良反应:阿司匹林在人体内产生的水杨酸会刺激胃黏膜,长期大量服用可能会导致胃痛、头痛、眩晕、恶心等不适症状
4.常见的抗酸药:
胃舒平——Al(OH)3;三硅酸镁——Mg2Si3O8·nH2O;胃得乐——MgCO3
5.合理用药
(1)处方药和非处方药:
①R表示处方药,是指需凭医生处方才能从药房或药店得到,并要在医生的指导下使用的药物
②OTC表示非处方药,是指那些消费者不需要持有医生处方就可以直接从药房或药店购买的药物
(2)合理用药原则:必须在医生、药师指导下,遵循安全、有效、经济、适当等原则,主要考虑药物和机体两个方面
①药物方面:考虑剂量、剂型、给药途径和时间等因素。例如,有的药用片剂、有的用注射剂
②机体方面:考虑患者年龄、性别、症状、心理、遗传等因素。例如:用药时考虑儿童和成人的不同剂量
(3)滥用药物的危害:例如:没有医生处方长期服用安眠药或镇静剂;滥用抗生素;运动员服用兴奋剂;
(4)拒绝吸毒、珍爱生命
考点八 安全使用食品添加剂
1.食品添加剂:是指为改善食品品质和色、香、味,以及防腐、保鲜和加工工艺的需要而加入食品中的人工合成或天然物质。
2.常见的几类食品添加剂
类型
种类
功能
着色剂
天然色素:红曲素、β-胡萝卜素、姜黄、叶绿素铜钠盐、焦糖色等
合成色素:苋菜红、柠檬黄、靛蓝等
改善食品色泽
增味剂
味精(谷氨酸钠)[来源:Zxxk.Com]
改善食品味道
膨松剂
碳酸氢铵、碳酸氢钠、复合膨松剂[来源:学§科§网]
使食品松软或酥脆,易于消化
凝固剂
如做豆腐的盐卤(氯化镁、硫酸钙)、葡萄糖δ内酯等
改善食品形态
防腐剂
苯甲酸及其钠盐、山梨酸及其钾盐、亚硝酸钠
杀灭食品中微生物或控制其滋生,防止食品腐败变质
抗氧
化剂
抗坏血酸(即维生素C)
防止食品因氧化而变质
营养强化剂
如食盐中添加的碘酸钾,奶粉中添加的维生素、碳酸钙、硫酸亚铁、硫酸锌等
补充必要的营养成分
3.安全使用食品添加剂
在规定范围内合理使用食品添加剂,对人体健康不会产生不良影响。
考点九 化学与环境保护
1.生态系统:包括人类和其他生物生存的生物圈与大气圈、水圈和岩石圈。
2.环境问题:一是指由于人类不合理地开发和利用自然资源而造成的生态环境破坏,二是指工农业生产和人类生活所造成的环境污染。
3.“三废”污染——废气、废液和废渣
(1)大气污染:
①大气污染物主要来自化石燃料的燃烧和工业生产过程产生的废气及其携带的颗粒物。
②次生污染物及其次生污染的产生
(2)水体污染
①污染原因:工农业生产和生活中产生污水的任意排放。
②处理方法:
水体污染物
处理方法
难溶性细小悬浮物
物理法——利用混凝剂通经沉淀、过滤除去
可溶性污染物
化学法——根据化学性质采用中和法、氧化还原法等方法经沉淀除去
复杂有机污染物
生物法——通过微生物代谢作用转化为简单的、无害的物质除去
(3)固体废物污染
工业废渣和生活垃圾等固体废物的处理应遵循无害化、减量化和资源化的原则,达到减少环境污染和资源回收利用两个重要目的。
4.常见环境污染问题
考点十 绿色化学源:学。科。网Z。X。X。K]
1.绿色化学思想:也称环境友好化学,其核心思想就是改变“先污染后治理”的观念和做法,利用化学原理和技术手段,减少或消除产品在生产和应用中涉及的有害化学物质,实现从源头减少或消除环境污染。
2.原子经济性反应:就是反应物的原子全部转变为期望的最终产物,原子利用率达到100%,也就是说在化学反应过程中不产生任何废物,其中,原子利用率=×100%。
3.绿色化学对化学反应的要求
4.开发和利用自然资源的原则:遵循减量化、再利用和再循环的原则,践行绿色发展理念,保护生态环境。
1.“绿色化学”的含义
(1)核心:利用化学原理从源头上减少和消除工业生产对环境造成的污染。又称为“环境无害化学”、“环境友好化学”、“清洁化学”。
绿色化学的理想在于不再使用有毒、有害的物质,不再产生废物,不再处理废物,这是一门从源头上减少或消除污染的化学。
(2)绿色化学的研究主要围绕化学反应、原料、催化剂、溶剂和产品的绿色化开展的,因此化学反应及其产物具有以下特征:
①采用无毒、无害的原料;
②在无毒、无害的条件(包括催化剂、溶剂)下进行;
③产品应该是环境友好的;
④具有“原子经济性”,即反应具有高选择性、极少副产物,甚至实现“零排放”。此外,它还应当满足“物美价廉”的传统标准。
2.原子经济性
原子经济性可用原子利用率来衡量,其定义式可表示为:原子利用率=×100%。
经济性的反应有两个显著优点:一是最大限度地利用了原料,二是最大限度地减少了废物的排放。
考向一 金属矿物的开发利用
【例1】下表中金属的冶炼原理或方法不正确的是( )
选项
冶炼原理
方法
A
2HgO2Hg+O2↑
热分解法
B
2Al2O3(熔融)4Al+3O2↑
电解法
C
Cu2S+O22Cu+SO2
热分解法
D
Fe2O3+2Al2Fe+Al2O3
热还原法
【答案】C
【解析】活泼金属K、Ca、Na、Mg、Al等可用电解法冶炼,中等活泼金属Zn、Fe、Sn、Pb、Cu等可用热还原法冶炼,不活泼金属Hg、Ag等可利用热分解法冶炼,故A、B、D三项均正确;C项为火法炼铜,错误。
【例2】不同的金属在冶炼方法上也有所不同,下列说法正确的是( )
A.钒、铬、锰、铁等难熔金属通常采用铝热法炼制
B.炼钢和炼铁都是采用还原剂将铁从其化合物中还原出来的方法,区别在于炼钢时选用的还原剂的还原性更强
C.由于钠、镁、铝等金属化学性质太活泼,人们通常采用电解熔融状态下的氯化物的方式来获取其金属单质
D.炼铁时加入的焦炭除了提供热量外,还用来制造还原剂一氧化碳
【答案】 D
【解析】 铁用CO还原法炼制,用铝热反应成本太高,A项错误;炼钢和炼铁的不同点是前者使用氧化剂,后者使用还原剂,B项错误;AlCl3是共价化合物,其熔融态不导电,工业上用电解熔融Al2O3的方法制取铝,C项错误。
考向二 海水资源的开发利用
【例3】下列关于海水淡化的叙述中不正确的是( )
A.蒸馏法淡化海水原理简单,但消耗大量能源,产生大量锅垢,很难大量生产淡水
B.利用太阳能蒸发海水是一种环境友好、节约能源的好方法,也是一种古老的方法
C.利用海水淡化产生的高浓度的卤水来提取有用物质,是海水利用的基本思路
D.研制高性能的渗透膜来提高海水淡化效率,最终实现海水自动转化为淡水
【答案】 D
【解析】 反渗透法淡化海水必须给海水加压才能实现,不论半透膜效率有多高,都不可能让海水自动转化为淡水,因为这一过程是不能自发进行的。
【例4】海水是巨大的资源宝库,下列关于海水综合利用的说法错误的是( )
A.海水制淡水主要有蒸馏法、电渗析法、离子交换法等
B.海水制盐、发展氯碱工业都是发生物理变化
C.海水提溴过程中先通入Cl2将溴离子氧化为溴单质
D.工业上用电解熔融MgCl2的方法制取金属镁
【答案】B
【解析】氯碱工业中电解饱和食盐水产生了新物质,有Cl2、H2、NaOH生成,发生了化学变化,B项错误。
考向三 化石燃料的综合利用
【例5】下列有关石油和煤的叙述不正确的是( )
A.煤的干馏是将煤隔绝空气在高温条件下使之分解,得到焦炭、煤焦油等物质的过程
B.煤的液化是将煤转化为甲醇、乙醇等液态物质的过程
C.煤的气化就是将煤在高温条件下由固态转化为气态的物理变化过程
D.石油通过裂化,可以获得碳原子数较少的轻质油
【答案】C
【解析】煤的气化是将煤转化为气体燃料的化学变化过程。
【例6】石油被称为工业的血液,煤被称为工业的粮食。它们的加工以及综合利用具有非常重要的意义。下列说法正确的是( )
A.煤的干馏产物主要是各类有机物
B.石油的分馏、裂化、裂解以及煤的干馏都属于化学变化
C.煤焦油经过分馏可以得到苯、甲苯等产物,说明煤中含有苯和甲苯
D.石油的裂化、裂解说明烃在加热条件下是可以分解的,且碳链越长越易分解
【答案】D
【解析】煤的干馏产物有粗氨水、煤焦油、焦炉气和焦炭等物质,其中焦炭居多,故A项错误;石油的分馏属于物理变化,石油的裂化、裂解以及煤的干馏都属于化学变化,故B项错误;煤是由有机物和少量无机物组成的复杂的混合物,通过干馏才能得到苯、甲苯、二甲苯等有机物,故C项错误;石油的裂化、裂解是在一定条件下将长链烃断裂为相对分子质量较小的短链烃的过程,说明烃在加热条件下是可以分解的,且碳链越长越易分解,故D项正确。
考向四 化肥农药的合理使用
【例7】下列物质的施用正确的是( )
A.铵态氮肥和草木灰(含K2CO3)混合施用
B.化肥和农家肥(如绿肥)混合施用
C.重钙(磷酸二氢钙)施入碱性土壤中
D.复合肥(如磷酸氢二铵)和生石灰一起施用
【答案】B
【解析】草木灰中的碳酸钾溶于水呈碱性,铵态氮肥中的NH4+会与OH-发生反应,二者混合施用会降低肥效;化肥和农家肥相互之间无影响,所以化肥和农家肥可以混合施用;重钙在碱性条件下会转化为难溶性的磷酸钙,磷酸钙不能被植物吸收利用,所以重钙施入碱性土壤中会降低肥效;生石灰与土壤中的水反应生成熟石灰,磷酸氢二铵与熟石灰反应生成氨气。
【例8】下列说法不正确的是( )
A.应当研制、推广和使用低毒、无公害的化学农药
B.开发新农药时,要全面正确地掌握药物的性质及其对人体、环境的影响
C.农药能杀灭病虫害,但也能影响人类的健康,因此应杜绝农药的使用
D.有害农药的滥用会导致了粮食、果品、蔬菜等的污染
【答案】C
【解析】A项,农药本身有毒,在杀灭病虫害的同时,也带来了对环境的污染和对人体健康的危害,所以应当研制、推广和使用低毒、无公害的化学农药,故A正确;B项,只有全面正确地掌握农药的性质及其对人体、环境的影响,才能更加有效地防止对人体和环境的影响,故B正确;C项,农药虽然能影响人类的健康,但也能杀灭病虫害,不能杜绝使用农药,应合理使用,以防对人体造成危害,故C错误;D项,如果农药不合理使用,则导致了粮食、果品、蔬菜、食品的污染,故D正确。
考向五 合理用药
【例9】关于药物的使用说法错误的是( )
A.合理用药要综合考虑药物和机体两个方面
B.减少药物剂量往往达不到治疗效果,甚至会产生耐药性
C.药物能防病治病,可以大量使用
D.非处方药安全系数大,可以自行购买和使用
【答案】C
【解析】药物在促进人体健康的同时,也可能对机体产生与用药目的无关的有害作用,故不可大量使用,C项错误。
【例10】下列关于药物使用的说法错误的是( )
A.青霉素药物的不良反应是过敏,因此使用此药前要进行皮肤敏感性测试
B.减少药物剂量往往达不到治疗效果,甚至会产生耐药性
C.止咳糖浆可以用饮料稀释服用
D.非处方药安全系数大,可以自行购买和使用
【答案】C
【解析】A项,青霉素是应用广泛的抗菌药物,它本身毒性很小,但容易造成药物过敏,引起不良的反应,故使用前要进行皮肤敏感性测试,故A正确;B项,药物的用量是经过严格的科学实验和大量的临床研究确定的,随意减少药物剂量往往达不到治疗效果,甚至会产生耐药性,故B正确;C项,不可以用饮料稀释止咳糖浆,否则会降低药效,故C错误;D项,非处方药相对于处方药来说安全系数大,所以非处方药可以自行购买,并按照说明书自行使用,故D正确;故选C。
考向六 安全使用食品添加剂
【例11】下列对于食品添加剂的说法中,合理的是( )
A.绝大多数食品添加剂在过量使用时对人体有害,所以应禁止使用食品添加剂
B.防腐剂能延长食品的保存期,所以应大量使用防腐剂
C.食用新鲜食物比食用用防腐剂储存的食物有益,所以应该禁止使用防腐剂
D.对于什么物质可作食品添加剂以及食品添加剂的用量,都应有严格的规定
【答案】D
【解析】绝大多数食品添加剂在过量使用时对人体有害,应合理使用,A项错误;防腐剂过量食用对人体有害,应合理添加,B项错误;合理使用防腐剂可延长食物的保存期,对人体无害,C项错误。
【例12】下列食品添加剂与类别对应正确的一组是( )
A.着色剂——苯甲酸钠 B.调味剂——亚硝酸钠
C.营养强化剂——粮食制品中加入的赖氨酸 D.防腐剂——苋菜红
【答案】 C
【解析】 苯甲酸钠具有防腐性,可以用作防腐剂,不作着色剂,故A项错误;亚硝酸钠有毒,适量亚硝酸钠(NaNO2)可作食品防腐剂,长期食用对人体有害,不能用作调味剂,故B项错误;赖氨酸是人体必需氨基酸之一,能促进人体发育、增强免疫功能,并有提高中枢神经组织功能的作用,可用作食品营养强化剂和饲料添加剂,故C项正确;苋菜红为红褐色或暗红褐色均匀粉末或颗粒,是一种着色剂,故D项错误。
考向七 化学与环境保护
【例13】雾霾天气已经严重影响了我国多数人的正常出行和生活节奏。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是( )
A.加高工厂的烟囱,使烟尘和废气远离地表
B.推广使用燃煤脱硫技术,防止SO2污染
C.研制新型高效可充电电池,发展纯电动汽车
D.开发利用绿色能源(如太阳能)替代化石燃料
【答案】A
【解析】加高工厂的烟囱,并不能减少有害气体的排放,也不可能使烟尘和废气远离地表;推广使用燃煤脱硫技术,能减少SO2的污染;研制新型高效可充电电池,发展纯电动汽车,可以减少化石燃料的使用;开发利用绿色能源替代化石燃料,可以减少化石燃料的使用。
【例14】下列说法正确的是( )
A.在田间焚烧秸秆,以增加草木灰肥料从而减少化肥的使用
B.推广使用可降解塑料及布袋购物,以减少“白色污染”
C.用氯气处理水中的Cu2+、Hg2+等重金属离子
D.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
【答案】B
【解析】在田间焚烧秸秆会产生大量的烟和粉尘颗粒,造成空气污染,对环境不利,故A项错误;“白色垃圾”是难降解的塑料制品,大量使用会造成土壤的污染,推广使用可降解塑料及布袋购物,可以减少“白色污染”,故B项正确;氯气是有毒气体,大量使用会污染空气,重金属离子一般采用加硫化物沉淀的方法处理,故C项错误;燃煤时产生二氧化碳、二氧化硫,氧化钙可以与二氧化硫反应产生亚硫酸钙,最终生成硫酸钙,可以减少酸雨形成,但是氧化钙与二氧化碳反应产生的碳酸钙受热又分解成氧化钙和二氧化碳,并不能减少二氧化碳的排放,故D项错误。
考向八 绿色化学
【例15】构建和谐社会的内容之一是人类与环境的和谐发展,而“绿色化学”的内容是指从技术经济上设计可行的化学反应,尽可能减少对环境的副作用,下列化学反应不符合“绿色化学”理念的是( )
A.消除硫酸厂尾气中的SO2:SO2+2NH3+H2O=(NH4)2SO3
B.消除硝酸工业尾气的氮氧化物的污染:NO+NO2+2NaOH=2NaNO2+H2O
C.制CuSO4:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
D.制CuSO4:2Cu+O2+2H2SO42CuSO4+2H2O
【答案】C
【解析】A项,用氨气和水与二氧化硫反应,减少了污染性气体排放,符合绿色化学理念,A正确;B项,用氢氧化钠溶液吸收氮氧化物,减少了污染性气体排放,符合绿色化学理念,B正确;C项,铜与浓硫酸反应有二氧化硫放出,不符合绿色化学理念,C错误;D项,制备硫酸铜过程无污染性气体产生,符合绿色化学理念,D正确;故选C。
【例16】“绿色化学”是指从源头上消除或减少对环境的污染。下列实验或实验过程符合化学实验“绿色化学”原则的是( )
A.用过氧化氢溶液代替高锰酸钾制取氧气
B.用纳米铜粉代替铜丝进行铜和浓硝酸反应的实验
C.用溴水代替碘水进行萃取实验
D.为了让学生更清楚地看到实验现象,用较多量的氯气进行性质实验
【答案】A
【解析】A项,2H2O22H2O+O2↑,2KMnO4K2MnO4+MnO2+O2↑,用过氧化氢和二氧化锰制取氧气,与用高锰酸钾在加热下制取氧气相比,不需加热,节约能源,并且生成物是水,没有污染,转化成了期望中的产品,符合了绿色化学的理念;B项,用纳米铜粉代替铜丝进行铜和浓硝酸反应的实验,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,仍会产生二氧化氮等污染物,不符合绿色化学的理念;C项,溴水易挥发,溴蒸气有毒,故不符合绿色化学理念;D项,Cl2是有毒气体,故不符合绿色化学理念。
1.下列冶炼金属的方法所涉及的反应一定是置换反应的是( )
A.热分解法 B.电解法 C.铝热法炼铁 D.高炉炼铁
【答案】C
【解析】铝热法炼铁一定是置换反应。
2.下列物质可以作为抗酸药的有效成分的是( )
A.碳酸钠 B.氢氧化钙 C.氢氧化钠 D.氢氧化镁
【答案】D
【解析】碳酸钠水溶液呈碱性,具有较强腐蚀性,不能作为抗酸药的有效成分,故A项错误;氢氧化钙、氢氧化钠为强碱,具有腐蚀性,不能作为抗酸药的有效成分,故B、C两项错误;氢氧化镁难溶于水,且能和盐酸发生反应,能作为抗酸药的有效成分,故D项正确。
3.下列农药具有高效、低毒、低残留特性的是( )
A.DDT B.六六六 C.敌敌畏 D.拟除虫菊酯
【答案】D
【解析】拟除虫菊酯是一类高效、低毒、低残留且对昆虫具有强烈触杀作用的杀虫剂,属于第三代农药。
4.下列物质中,不能作为食品添加剂的是( )
A.白醋 B.白酒 C.甲醇 D.食盐
【答案】C
【解析】A项,白醋是常用的酸味剂,是常用的食品添加剂;B项,白酒是常用的食品杀菌剂、去腥剂,是常用的食品添加剂;C项,甲醇是有毒物质,禁止用作食品添加剂;D项,食盐是常用的咸味剂,是常用的食品添加剂。
5.下列既能作防腐剂又能作调味剂的物质是( )
A.甲醛 B.苏打 C.食盐 D.亚硝酸钠
【答案】C
【解析】甲醛能够使蛋白质变性,具有防腐作用,但会影响人体健康,故不能用作食品的防腐剂,也不能用作调味剂;苏打为碳酸钠,属于食品膨松剂;食盐可以使细菌细胞脱水死亡,可作为防腐剂,同时又具有咸味,故可作调味剂;亚硝酸钠是一种常用的食品添加剂,具有防腐和增色作用,但不是调味剂。
6.下列说法错误的是( )
A.对废旧金属最好的处理方法是回收再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液
D.热还原法中还原剂有焦炭、一氧化碳、氢气、活泼金属等
【答案】C
【解析】活泼金属的冶炼是通过电解其熔融状态的盐,C项错误。
7.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将化学能转化为电能
【答案】C
【解析】海水中的钾元素以化合态形式存在,化合态转化为游离态,一定发生了氧化还原反应,A项不正确;海水蒸发制海盐,发生了物理变化,B项不正确;电解熔融NaCl可以制得Na和Cl2,C项正确;潮汐发电是将机械能转化为电能,D项不正确。
8.石油和煤都是重要的化石能源,下列有关石油和煤的叙述正确的是( )
A.两者都是纯净物 B.两者都含有碳元素
C.两者都是可再生能源 D.两者都有固定的沸点
【答案】B
【解析】煤、石油都属于不可再生能源,都是混合物,都没有固定的沸点。
9.我国在“煤变油”技术上已取得了重大突破,达到5吨煤可以合成1吨成品油的水平。下列有关叙述错误的是( )
A.煤的组成元素主要是C,还含有少量的H、N、S、O等
B.“煤变油”的方法之一是使煤与H2作用生成液态有机物
C.煤能变“油”是因为煤中含有大量的汽油、柴油和煤焦油
D.煤变成成品油需要经过一系列工艺流程,发生复杂的物理、化学变化才能实现
【答案】C
【解析】煤之所以能变“油”,是通过煤的液化将煤中的有机物转化为可燃性液体燃油,并不是因为煤中含有汽油、柴油和煤焦油,C项错误。
10.下列有关合理用药的说法中错误的是( )
A.对症下药是合理用药的首要原则
B.能被充分、快速吸收而无刺激性的药物,可在饭前口服
C.一种药物的用量,是经过严格的科学实验和大量的临床研究确定的
D.中药是天然的,因此无任何毒副作用
【答案】D
【解析】药物一般都有一定的毒副作用,长期大量服用,会危害人体健康,D项错误。
11.下列说法中正确的是( )
A.食品添加剂就是为增强食品的营养而加入的物质
B.只有不法商贩才会使用食品添加剂
C.不使用食品添加剂的纯天然食品最安全
D.在限量范围内使用食品添加剂不会对人体造成危害
【答案】D
【解析】食品添加剂的品种很多,作用各不相同,A项错误;只要是合理使用食品添加剂都是安全的,B项错误;合法使用食品添加剂是安全的,纯天然食品也不一定安全,如芸豆烹调不熟会对人体有害,C项错误。
12.下列有关环境保护与绿色化学的叙述不正确的是( )
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料的燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.燃煤烟气脱硫的石灰石-石膏法,可将烟气中的二氧化硫转化为硫酸钙
【答案】C
【解析】酸雨一般是硫酸型和硝酸型两种,硫的氧化物二氧化硫排放到空气中最终被氧气氧化成三氧化硫,再与水结合形成硫酸,而氮的氧化物二氧化氮与水结合产生硝酸,故A项正确;大气污染物主要是粉尘颗粒和有害气体,而化石燃料燃烧时会有粉尘和二氧化硫产生,再比如硫酸工业尾气中含有二氧化硫,硝酸工业尾气中含有氮的氧化物,这些均是大气污染物,故B项正确;绿色化学的核心是从源头上杜绝污染产生,而不是先污染后治理,故C项错误;石灰石高温时分解生成的生石灰与煤燃烧时产生的二氧化硫反应生成亚硫酸钙,最终被氧气氧化成硫酸钙,起到处理硫的作用,故D项正确。
13.“绿色化学”的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是( )
A.工业生产环氧乙烷:
B.水煤气合成甲醇:CO + 2H2CH3OH
C.制取硫酸铜:Cu + 2H2SO4(浓)CuSO4 + SO2↑+ 2H2O
D.合成甲基丙烯酸甲酯:CH3C≡CH + CO + CH3OHCH2=C(CH3)COOCH3
【答案】C
【解析】A项,工业生产环氧乙烷,反应物原子完全转化为生成物,符合绿色化学要求,故A不符合题意;B项,水煤气合成甲醇,反应物原子完全转化为生成物,符合绿色化学要求,故B不符合题意;C项,反应物的原子没有完全转化为目标产物CuSO4,因此不符合绿色化学要求,故C符合题意;D项,合成甲基丙烯酸甲酯时,反应物原子完全转化为目标产物,符合绿色化学要求,故D不符合题意;故选C。
14.从淡化海水后的浓海水中提取溴的流程如图所示,下列有关说法错误的是( )
A.X为SO2气体,也可将SO2换成Na2SO3
B.设备Y为蒸馏塔
C.在提取溴的过程中一定有Br-被氧化
D.工业上每获得1 mol Br2,需要消耗Cl2的体积最多为22.4 L(标准状况下)
【答案】D
【解析】在海水中加入酸和氯气,氯气氧化海水中的溴离子得到溴单质,溴易挥发,通入空气,可以把溴吹出,溴与X反应生成溴化物,故X为具有还原性的物质,可选用SO2、Na2SO3等;溴化物再与氯气反应生成溴单质,加热蒸馏得到溴蒸气,溴蒸气冷却得到液溴。A项,溴与X反应可生成溴化物,故X为具有还原性的物质,X可为SO2,也可为Na2SO3,A正确;B项,经过设备Y得到溴蒸气,故设备Y为蒸馏塔,B正确;C项,氯气氧化海水中的溴离子得到溴单质,溴化物与氯气反应生成溴单质,这两步都是Br-被氧化,C正确;D项,提取过程中发生反应2Br-+Cl2=2Cl-+Br2,根据离子方程式可知,每生成1 mol Br2,需消耗1 mol 氯气,故两次氧化共需氯气2 mol ,即44.8L(标准状况),但这是理论值,在工业上,两次氧化时,氯气都应过量,且被氧化生成的溴最终不能完全得到,故工业上每获得1 mol Br2,需要消耗Cl2的体积大于44.8L(标准状况),D错误;故选D。
15.金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的应用。完成下列填空:
(1)铝元素在周期表中的位置为 ,工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为 。
(2)Al-Mg合金焊接前需用NaOH溶液处理Al2O3膜,其化学方程式为 ;焊接过程中使用的保护气为 (填化学式)。
(3)镓(Ga)与铝同主族。写出镓的氯化物与氨水反应的化学方程式: 。
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:2Al+4BaO3Ba↑+BaO·Al2O3。常温下Al的金属性比Ba的金属性 (填“强”或“弱”)。利用上述方法可制取Ba的主要原因是 (填字母)。
A.高温时,Al的活泼性强于Ba B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定 D.Ba的沸点比Al的低
【答案】(1)第三周期第ⅢA族 CO2
(2)Al2O3+2NaOH=2NaAlO2+H2O Ar(合理即可)
(3)GaCl3+3NH3·H2O=Ga(OH)3↓+3NH4Cl
(4)弱 d
【解析】(4)依据元素周期律可知Al的金属活泼性弱于Mg,Mg的金属活泼性弱于Ba;根据制取钡的化学方程式可知,Ba的沸点比Al的低。
16.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法: 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
【答案】 (1)蒸馏法、电渗析法(或离子交换法,【答案】合理即可)
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O=4H++SO42-+2Br- 强酸对设备的严重腐蚀
【解析】(2)电解NaCl溶液的反应原理为2NaCl+2H2OH2↑+Cl2↑+2NaOH,由以上反应生成的Cl2和NaOH可进一步反应:Cl2+NaOH=NaCl+NaClO+H2O,故也可得到H2和NaClO。(3)步骤Ⅰ中获得的是低浓度的Br2溶液,再经过步骤Ⅱ、Ⅲ可富集溴元素。(4)SO2有较强还原性,Br2有较强氧化性,二者发生氧化还原反应生成H2SO4和HBr,产物是两种强酸,故在工业生产中要注意强酸对设备的严重腐蚀。
17.请根据背景材料的提示,按要求完成相关问题。
背景材料1:海水中各元素含量情况
元素
浓度/mg·L-1
元素
浓度/mg·L-1
钠
10770
氯
19350
镁
1290
硫
885
钾
380
溴
67
钙
400
碘
0.06
背景材料2:部分化学试剂的市场价格
试剂
氢氧化钾
氢氧化钠
氢氧化钙
氧化钙
价格(元/吨)
5238.00
2300.00
1200.00
700.00
(1)在海水提镁的过程中要实现对镁离子的富集、分离,有以下三个方案。
方案一:直接往海水中加入沉淀剂;
方案二:加热蒸发海水再加入沉淀剂;
方案三:在晒盐后的卤水中加入沉淀剂。
你认为方案 最合理。不选另外两个方案的理由是 。
(2)应该选择 作为镁离子的沉淀剂。不考虑其他费用,沉淀相同量的镁离子所用氢氧化钠和氧化钙的价格之比为 。
(3)为了节省成本,拟考虑以海边上的贝壳为原料,试简述其理由: 。
【答案】(1)三 方案一浪费原料,方案二浪费能源
(2)CaO 230∶49
(3)贝壳中含CaCO3,加热分解生成的CaO可用作沉淀剂,节省了成本
【解析】 (1)海水提镁首先要对海水进行浓缩,然后加入沉淀剂,显然方案一浪费原料,方案二浪费能源,最合理的是方案三。(2)根据市场价格,CaO作为Mg2+的沉淀剂最为经济。假设沉淀a mol Mg2+,则需要NaOH和CaO的价格之比为2a×40×2300∶(a×56×700)=230∶49。(3)贝壳的主要成分为CaCO3,可以通过高温煅烧贝壳的方式生产CaO作为Mg2+的沉淀剂,降低成本。
18.胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末,可缓慢分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸及酸性药物则产生CO2;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)缓慢而持久地与胃酸进行中和作用,可维持3~4小时;(2)凝胶本身覆盖于溃疡面上,具有保护作用;(3)可溶于稀酸或NaOH溶液中。
(1)请推测,甲中含有的主要化学成分是 (填化学式,下同);乙中含有的主要化学成分是 。
(2)试写出甲中含有的主要化学成分引起胃胀气反应的离子方程式: 。
(3)试写出乙中含有的主要化学成分分别与稀盐酸和氢氧化钠溶液反应的离子方程式: 。
【答案】(1)NaHCO3 Al(OH)3
(2)HCO3-+H+=H2O+CO2↑
(3)Al(OH)3+3H+=Al3++3H2O、Al(OH)3+OH-=AlO2-+2H2O
【解析】 大部分胃药都是能与酸反应的物质,碳酸钙、氢氧化镁、氧化镁、碳酸氢钠、氢氧化铝、三硅酸镁等都是常见胃药。根据甲遇酸及酸性药物能产生CO2,结合已有知识可知甲是NaHCO3;根据乙可溶于稀酸或NaOH溶液中,可知乙具有两性,结合其他信息判断乙是Al(OH)3。
19.硫酸铵是农村常用的一种铵态氮肥。试回答下列问题:
(1)实验测得某硫酸铵肥料样品中氮的质量分数为20%,这种样品中可能混有 (填字母,下同)。
A.碳酸氢铵 B.硝酸铵 C.氯化铵 D.磷酸氢二铵
(2)下列物质不能与硫酸铵肥料混合施用的是 。
A.碳酸氢铵 B.草木灰 C.过磷酸钙 D.氯化钾
(3)田间一次施用化肥过多会使植物变得枯萎发黄,俗称“烧苗”,其原因是 。
A.根细胞从土壤中吸收的养分过多 B.根细胞不能从土壤中吸水
C.根系不能将水向上运输 D.根系加速了呼吸作用,释放的能量过多
【答案】(1)A (2)B (3)B
【解析】(1)(NH4)2SO4的含氮量为21.2%>20%,则必定含有含氮量比20%小的一种化肥,经计算只有NH4HCO3的含氮量低于20%。(2)(NH4)2SO4为铵态氮肥,这种肥料不能与碱性物质混合施用,因易产生挥发性物质氨气,降低肥效,而草木灰的主要成分是K2CO3,水解呈碱性。(3)当施用化肥过多时,根细胞不能从土壤中吸水而使植物发黄。
20.2022年3.15晚会曝光了不少食品安全问题严重的食品,如老坛酸菜和双汇火腿肠。食品和药品关系着人们的生存和健康。
(1)具有解热镇痛作用的药品是_______(填字母):
A.阿司匹林 B.碳酸氢钠 C.青霉素
(2)某面包的标签中有以下几种配料:面粉、鸡蛋、白砂糖、黄油、山梨酸钾。其中富含淀粉的是_______,属于防腐剂的是_______。
【答案】(1)A (2) 面粉 山梨酸钾
【解析】(1)具有解热镇痛作用的药品是阿司匹林,故选A;(2)面包中富含淀粉的是面粉,能起防腐剂作用的是山梨酸钾,故答案为:面粉;山梨酸钾。
相关试卷
这是一份考点22 化学实验基础(考点归纳)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2),文件包含考点22化学实验基础教师版docx、考点22化学实验基础学生版docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。
这是一份考点21 化学与可持续发展(测试)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2),文件包含考点21化学与可持续发展解析版docx、考点21化学与可持续发展学生版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
这是一份考点19 乙醇与乙酸(考点归纳)——2023年高中化学学业水平考试专项精讲+测试(人教版2019必修1+必修2),文件包含考点19乙醇与乙酸教师版docx、考点19乙醇与乙酸学生版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。









