

03 常考题空3 分压平衡常数(Kp)计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用)
展开
这是一份03 常考题空3 分压平衡常数(Kp)计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共19页。
常考题空3 分压平衡常数(Kp)计算
【高考必备知识】
1.分压平衡常数(Kp)
(1)气体的分压p(B):相同温度下,当某组分气体B单独存在且具有与混合气体总体积相同的体积时,该气体B所具有的压强,称为气体B的分压强,简称气体B的分压。符号为p(B),单位为Pa或kPa或MPa
(2)分压定律
①分压定律:混合气体的总压等于相同温度下各组分气体的分压之和
p(A)+p(B)+p(C)+p(D)+…=p
②气体的分压之比等于其物质的量之比:=
③某气体的分压p(B)与总压之比等于其物质的量分数:==x(B)
则:气体的分压=气体总压×体积分数=总压×物质的量分数
(3)分压平衡常数Kp (只受温度影响)
一定温度下,气相反应:mA(g)+nB(g)pC(g)+qD(g)达平衡时,气态生成物分压幂之积与气态反应物分压
幂之积的比值为一个常数,称为该反应的压强平衡常数,用符号Kp表示,Kp的表达式如下:
,其中p(A)、p(B)、p(C)、p(D)分别为A、B、C、D各气体的分压
2.Kp计算的两种模板
模板1.根据“某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)”计算压强平衡常数
第一步
根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度
第二步
计算各气体组分的物质的量分数或体积分数。
第三步
根据分压计算公式求出各气体物质的分压,某气体的分压=气体总压强×该气体的体积分(或物质的量分数)
第四步
根据平衡常数计算公式代入计算。例如,N2(g)+3H2(g)2NH3(g),压强平衡常数表达式为Kp=
模板2.直接根据分压强计算压强平衡常数
N2(g) + 3H2(g)2NH3(g)
p(始): p0 3p0 0
Δp: p 3p 2p
p(平): p0-p 3p0-3p 2p
Kp=
【典题示例】
1.SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g)+Cl2(g)SO2Cl2(g)。按投料比1∶1把SO2与Cl2充入一恒压的密闭容器中发生上述反应,SO2的转化率与温度T的关系如下图所示:
若反应一直保持在p压强条件下进行,则M点的压强平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)
2.在温度T下,容积固定的密闭容器中充入3 mol NO和2 mol H2发生2H2(g)+2NO(g)N2(g)+2H2O(g),起始压强为p0,一段时间后,反应达到平衡,此时压强p==0.9p0,则NO的平衡转化率α(NO)==________(结果保留三位有效数字),该反应的平衡常数Kp==________(用含p的代数式表示,Kp为以分压表示的平衡常数,且某气体的分压=总压×该气体的物质的量分数)
3.Binoist等进行了H2S热分解实验:2H2S(g)2H2(g)+S2(g),开始时,当1 mol H2S与23.75 mol Ar混合,在101 kPa及不同温度下反应达平衡时H2、H2S及S2(g)的体积分数如图3所示,该反应在Q点对应温度下的平衡常数Kp=________kPa(Kp为以分压表示的平衡常数,分压=总压×物质的量分数,结果保留小数点后两位)
4.353 K时,在刚性容器中充入CH3OH(g),发生反应:CH3OH(g)CO(g)+2H2(g)。体系的总压强p随时间t的变化如表所示:
t/min
0
5
10
15
20
∞
p/kPa
101.2
107.4
112.6
116.4
118.6
121.2
(1)若升高反应温度至373 K,则CH3OH(g)分解后体系压强p∞(373 K)__________121.2 kPa(填“大于”“等于”或“小于”),原因是__________________________________
(2)353 K时,该反应的平衡常数Kp=________(kPa)2(Kp为以分压表示的平衡常数,计算结果保留1位小数)
5.丙烷无氧脱氢法制备丙烯反应如下:C3H8(g)C3H6(g)+H2(g) ΔH=+124 kJ·mol-1
(1)总压分别为100 kPa、10 kPa 时发生该反应,平衡体系中C3H8和C3H6的物质的量分数随温度变化关系如图所示,100 kPa时,C3H8和C3H6的物质的量分数随温度变化关系的曲线分别是______、______
(2)某温度下,在刚性容器中充入C3H8,起始压强为10 kPa,平衡时总压为13.3 kPa,C3H8的平衡转化率为________,该反应的平衡常数Kp=______kPa(保留1位小数)
6.有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g)===4NO2(g)+O2(g)(慢反应) ΔH<0,2NO2(g)N2O4(g)(快反应) ΔH<0,体系的总压强p总和p(O2)随时间的变化如图所示:
(1)图中表示O2压强变化的曲线是___________(填“甲”或“乙”)
(2)已知N2O5 分解的反应速率v=0.12p(N2O5) kPa·h-1,t=10 h时,p(N2O5)=______ kPa,v=_____kPa·h-1(结果保留两位小数,下同)
(3)该温度下2NO2(g)N2O4 (g)反应的平衡常数Kp=____________kPa-1(Kp为以分压表示的平衡常数)
【真题演练】
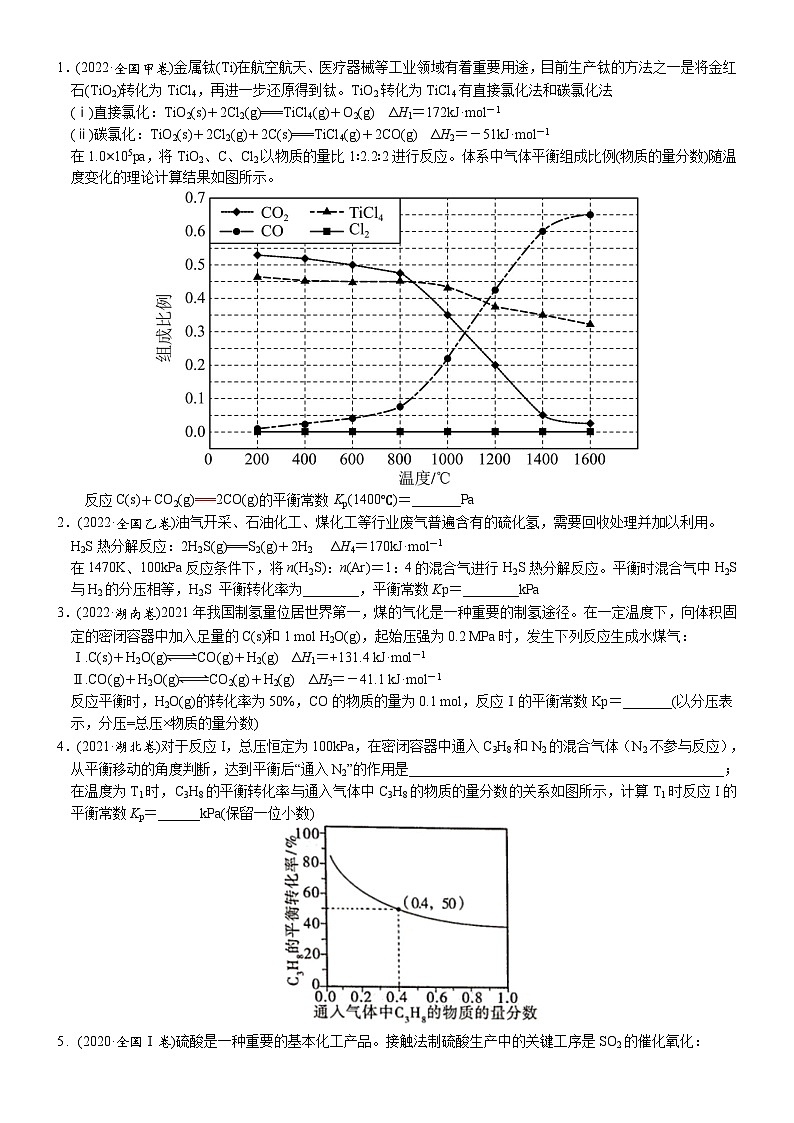
1.(2022·全国甲卷)金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。TiO2转化为TiCl4有直接氯化法和碳氯化法
(ⅰ)直接氯化:TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) ΔH1=172kJ·mol-1
(ⅱ)碳氯化:TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH2=-51kJ·mol-1
在1.0×105pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
反应C(s)+CO2(g)===2CO(g)的平衡常数 Kp(1400℃)=_______Pa
2.(2022·全国乙卷)油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。
H2S热分解反应:2H2S(g)===S2(g)+2H2 ΔH4=170kJ·mol-1
在1470K、100kPa反应条件下,将n(H2S):n(Ar)=1:4的混合气进行H2S热分解反应。平衡时混合气中H2S 与H2的分压相等,H2S 平衡转化率为________,平衡常数Kp=________kPa
3.(2022·湖南卷)2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。在一定温度下,向体积固定的密闭容器中加入足量的C(s)和1 mol H2O(g),起始压强为0.2 MPa时,发生下列反应生成水煤气:
Ⅰ.C(s)+H2O(g)CO(g)+H2(g) ΔH1=+131.4 kJ·mol-1
Ⅱ.CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1 mol,反应Ⅰ的平衡常数Kp=_______(以分压表示,分压=总压×物质的量分数)
4.(2021·湖北卷)对于反应I,总压恒定为100kPa,在密闭容器中通入C3H8和N2的混合气体(N2不参与反应),从平衡移动的角度判断,达到平衡后“通入N2”的作用是_____________________________________________;在温度为T1时,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图所示,计算T1时反应I的平衡常数Kp=______kPa(保留一位小数)
5.(2020·全国Ⅰ卷)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:
SO2(g)+O2(g)SO3(g) ΔH=-98 kJ·mol-1。将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为________,平衡常数Kp=________________________(以分压表示,分压=总压×物质的量分数)。
6.(2020·全国卷Ⅱ)乙烷在一定条件可发生如下反应:C2H6(g)===C2H4(g)+H2(g),容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
7.(2020·全国卷Ⅲ)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
CO2催化加氢生成乙烯和水的反应中理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示
根据图中点A(440 K,0.39),计算该温度时反应的平衡常数Kp= (MPa)-3(列出计算式。以分压表示,分压=总压×物质的量分数)
8.(2019·全国卷Ⅱ)环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
某温度,等物质的量的碘和环戊烯()在刚性容器内发生反应(g)+I2(g)(g)+2HI(g) ΔH>0,起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=______Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
9.(2018·全国卷Ⅰ)F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃时N2O5(g)分解反应:
2N2O5(g)4NO2(g)+O2(g)
2N2O4(g)
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如表所示[t=∞时,N2O5(g)完全分解]:
t/min
0
40
80
160
260
1 300
1 700
∞
p/kPa
35.8
40.3
42.5
45.9
49.2
61.2
62.3
63.1
已知:2N2O5(g)===2N2O4(g)+O2(g) ΔH=-4.4 kJ·mol-1
2NO2(g)N2O4(g) ΔH=-55.3 kJ·mol-1
(1)若提高反应温度至35 ℃,则 N2O5(g)完全分解后体系压强p∞(35 ℃)________63.1 kPa(填“大于”“等于”或“小于”),原因是____________________________________
(2)25 ℃时N2O4(g)2NO2(g)反应的平衡常数Kp=______________ kPa,该温度下,2NO2(g)N2O4(g)的Kp为______________(Kp为以分压表示的平衡常数,计算结果保留1位小数)
(3)对于N2O4(g)2NO2(g)反应达到平衡时Kp(35 ℃)________Kp(25 ℃)(填“>”“”或“T1
(2)m1>m2>m3
(3)乙醇
解析:(1)反应为放热反应,温度越高转化率越小,则T3>T2>T1。
(2)图2中m1、m2、m3投料比从大到小的顺序为m1>m2>m3,因相同温度下,增大氢气的量,平衡正向移动,二氧化碳的转化率增大。
(3)温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量增大,由图可知,曲线a代表的物质为H2,b表示CO2,c为H2O,d表示乙醇;设开始氢气的投入量是3n mol,则二氧化碳是n mol,二氧化碳的转化量是x,则
2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g)
起始量/mol n 3n 0 0
变化量/mol x 3x 0.5x 1.5x
平衡量/mol n-x 3n-3x 0.5x 1.5x
P点a、c的体积分数相同,所以3n-3x=1.5x,解得x=n,总物质的量是n-x+3n-3x+0.5x+1.5x=n,总压为5 MPa的恒压条件下,p(二氧化碳)=p(乙醇)=×5 MPa=0.125×5 MPa,p(氢气)=p(水)=×5 MPa=0.375×5 MPa,T4温度时,该反应的平衡常数Kp=。
5.C+2NON2+CO2 >
解析:1 L恒容密闭容器中加入0.100 0 mol NO和2.030 mol固体活性炭,生成A、B两种气体,从不同温度下测得平衡体系中各物质的物质的量以及容器内压强数据可以看出:n(C)∶n(NO)∶n(A)∶n(B)=1∶2∶1∶1,所以可以推断出生成的A、B两种气体为N2和CO2,反应的化学方程式为C+2NON2+CO2。该反应的平衡常数Kp=,容器的体积为1 L,平衡分压之比等于平衡浓度之比,代入表中数据计算得200 ℃时的平衡常数Kp=。
6.4 MPa
7.(1)48 (2)0.1
解析:在一定条件下 ,压强之比等于物质的量之比,因此可以直接用压强代替物质的量计算。
4NO(g)N2(g)+2NO2(g)
开始的压强/MPa 15 0 0
转化的压强/MPa 4x x 2x
平衡的压强/MPa 15-4x x 2x
(1)20 min时,15-x=13.2,x=1.8,NO的转化率为α=×100%=48%。
(2)平衡时,15-x=12.5,x=2.5,NO、N2、NO2的压强分别为5、2.5、5,代入公式Kp===0.1。
8.(1)p1>p2>p3
(2)(kPa)-3
解析:(1)该反应的正反应是一个反应前后气体体积减小的可逆反应,增大压强平衡正向移动,氧气转化率增大,所以压强:p1>p2>p3。(2)若初始时通入7.0 mol O2,p2为7.0 kPa,A点氧气转化率为50%,则A点n(O2)=7.0 mol×(1-50%)=3.5 mol,生成n(SO2)=×4 =2 mol,恒温恒容条件下气体压强之比等于物质的量之比,所以A点压强为×7.0 kPa=5.5 kPa,p(O2)=×5.5 kPa=3.5 kPa,p(SO2)=(5.5-3.5)kPa=
2 kPa,则A点平衡常数Kp==(kPa)-3=(kPa)-3 。
9.(1)66.7% >
(2)104.7
解析:(1)设平衡时甲烷转化x mol,根据三段式法有:
2CH4(g)C2H4(g)+2H2(g)
起始量/mol 0.12 0 0
变化量/mol x x
平衡量/mol 0.12-x x
结合题意知0.12-x=,解得x=0.08,故CH4的平衡转化率为×100%≈66.7%。根据题图知,2CH4(g)C2H4(g)+2H2(g)为吸热反应,改变温度,甲烷的浓度增大,即平衡左移,则温度降低,t1>t2。(2)将气体的平衡浓度换为平衡分压,可知t3℃时,该反应的压强平衡常数Kp== Pa2=104.7 Pa2。
10.(1)90%
(2)48 MPa-2
解析:假设到平衡时氮气转化的物质的量为x mol,则有
根据压强比等于物质的量比可知,
=,解之得x=0.9;
(1)达到平衡时N2的转化率为×100%=90%;
(2)用压强表示该反应的平衡常数
Kp==48 MPa-2。
11.(1)>
(2)20% 减小起始时或减小压强 (3)9.1×10-3 6.6×10-4
解析:(1)根据图像,随着温度升高,反应物H2S的量逐渐下降,所以反应是吸热反应,所以ΔH>0;
(2)M点时,CH4与H2的物质的量分数相等,列三段式:
所以有1-a=4a,a=0.2,H2S的转化率为a(H2S)=20%;为提高硫化氢转化率,从平衡移动的角度分析还可以减压或者增加CH4的进料提高CH4与H2S的比例;
(3)N点时,H2S与H2的物质的量分数相同,列三段式:
所以2-2a=4a,a=,即N点时二硫化碳的物质的量分数为:n(CS2)%===≈9.1×10-2,所以p(CS2)=n(CS2)%×p总=9.1×10-3 MPa;通过三段式可知n(H2S)%=n(H2)%=,n(CH4)%=,所以Kp==×p≈6.6×10-4(MPa)2。
12.(1)m1>m2>m3 Kp=
(2)1 200 Pa
解析:(1)在同温同压下,对于可逆反应SO2+O2SO3,SO2平衡转化率:①SO2的起始浓度增加,平衡转化率α(SO2)下降;②O2起始浓度增加,平衡转化率α(SO2)增大。迁移分析:在同温同压下,增加二氧化硫的量,会使原料气中SO2和O2的物质的量之比m变大,m越大,平衡转化率α(SO2)越小。
(2)总压强为105 Pa,根据题给信息,A点是500 ℃,二氧化硫的转化率为88%;
n(SO2)=10 mol,n(O2)=24.4 mol,n(N2)=70 mol,进行如下计算:
SO2(g) + O2(g)SO3(g)
起始量/mol 10 24.4 0
变化量/mol 10×88% ×10×88% 10×88%
平衡量/mol 10×12% 24.4-5×88% 10×88%
平衡时,混合气体总量为10×12%+(24.4-5×88%)+10×88%+70=104.4-5×88%=100 (mol)。
达平衡时SO2的分压p(SO2)=×100%×105=1 200 Pa。
13.(1)>
(2)
相关试卷
这是一份08 常考题空8 溶度积( Ksp)的相关计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共9页。
这是一份07 常考题空7 电解质溶液中有关电离(水解)平衡常数的计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共9页。
这是一份06 常考题空6 有关晶胞参数的计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共20页。









