



2023年高三下学期5月三校联考化学及答案
展开【详解】A. 不粘锅的耐热涂层是聚四氟乙烯,A错误;C. 硅胶、生石灰是干燥剂无法防止食品氧化,C错误;D. 煤油是石油分馏的产品,D错误。
2.【答案】A
【详解】C.淀粉的分子式是(C6H10O5)n,C错误。
3.【答案】A
【详解】A.10 g 14N16O2和16O2混合气体中,设14N16O2和16O2物质的量分别为x和y,根据混合气体总质量46x+32y=10,质子数为23x+16y=5,质子数为5NA,A正确;B. 标准状况下NO2不是气体,不能用气体摩尔体积计算,B错误;;C.常温下,1 L pH=9 的 CH3COONa 溶液中,水电离出的 H+的数目为10-5NA,C错误;D. 等物质的量的N2和C2H2所并未说明物质的量是1 ml,D错误。
4.【答案】B
【详解】A.二元弱碱N2H4与足量硫酸溶液反应生成N2H6(HSO4)2,A错误;C.Fe(SCN)3中Fe3+与SCN-以配位键结合形成配合物,不能拆,C错误;D.Na2S2O3溶液中通少量Cl2生成的H+与过量的Na2S2O3不共存,D错误。
5.【答案】C
【详解】A.[Al(CH3)3]中心原子Al形成3根σ键,为sp2杂化,空间结构为平面三角形,结构对称是非极性分子,A推测合理;[Al(CH3)3]与水反应生成一种可燃性气体,方程式可能为[Al(CH3)3]+3H2O=3CH4↑+Al(OH)3↓,B推测合理;C. 中心原子Al有空轨道,SO2- 4中的O原子有孤电子对,S无孤电子对,因此Al与O形成配位键,C推测不合理;D.原子半径C>O,键长Al-C>Al-O,因此[Al(OCH3)3]更稳定,与水反应不如[Al(CH3)3]剧烈,D推测合理。
6.【答案】D
【详解】A. 该物质与足量H2加成的产物只有2个手性碳,结构如图
A错误;B. 该物质含有酚羟基和醇羟基,可与碳酸钠和钠反应,不能与碳酸氢钠反应,B错误;C. 酚羟基含有邻位H,另外碳碳双键能和单质溴发生加成反应,所以最多消耗单质溴3 ml,C错误;分子中含酰胺基、碳溴键、酚羟基均能和氢氧化钠反应,1 ml该物质与足量NaOH溶液反应,最多可消耗4 ml NaOH,D正确;
7.【答案】C
【详解】A.D2和HD的相对分子质量不同,可以用质谱区分,A正确;B.类似于钠和水的反应, Li与D2O反应生成LiOD与D2,化学方程式是2Li+2D2O=2LiOD+D2↑,B正确;C.D2由Li与D2O反应生成,HD通过反应LiH+D2O=LiOD+HD↑,n(D2)/n(HD)越大,则n(Li)/n(LiH)越大,C错误;D.升高温度,2Li(s)+H2(g)⇌2LiH(s) △H<0,平衡左移,Li增多,LiH减少,则结合选项C可知:80℃下的n(D2)/n(HD)大于25℃下的n(D2)/n(HD) ,D正确;
8.【答案】B
【详解】A.丙酮与水互溶,不能用于萃取碘水中的I2,A错误;B. 含苯环的蛋白质可与浓硝酸发生显色反应,B正确;C. 有色鲜花中含有水,无法验证干燥的氯气是否具有漂白性,C错误;D. 探究浓度对化学反应速率的影响要控制变量,两组实验中溶液的体积不同,各反应物的浓度均不同,无法探究浓度对反应速率的影响,D错误。
9.【答案】B
【详解】A.为使化学能有效的转化为电能,需要用Al2O3绝缘体隔离正负极,A正确;B.LLZTO导体管只允许Li+通过,因此电池工作时负极发生反应:Li−e-=Li+,B错误;C.根据用1.8V电压充电后,电池正极材料中S、Fe的原子个数比为1.02(不计Li2S,下同);2.3V电压充电后,S、Fe的原子个数比为2.01,说明电池正级材料的变化为FeS2 ⇌ FeS ⇌ Fe,C正确。
10.【答案】D
【详解】A.NH3与H+通过配位键形成NH4+,A正确;B.由图可知,NO与O2吸附在Fe3+配位点上形成NO2,该过程中气体体积减小,增大压强平衡正向移动,B正确;C.在反应过程中,有O-O键的断裂和N-N键的形成,存在N-O键的断裂和N-H键的形成,C正确;D.中间产物NO2(NH4+)2中NO2和NH4+比例应为1:2,总方程式为:4NH3+4NO+O2 = 4N2+6H2O
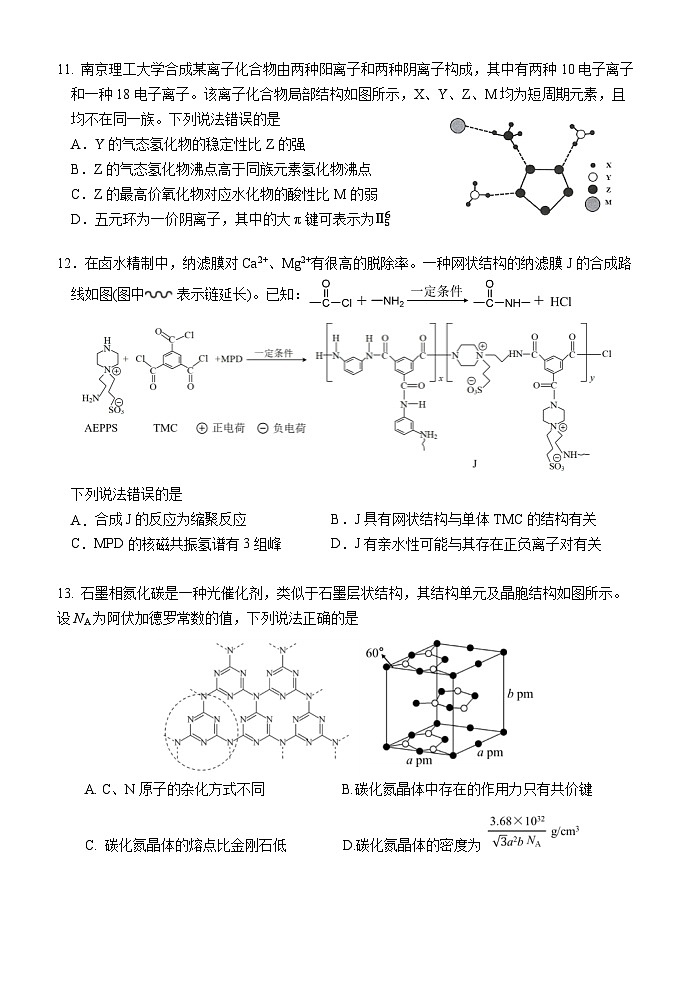
11.【答案】B
【分析】物质由两种阳离子和两种阴离子构成,由图可知,M的离子半径最大,应该为18电子的离子,即M为Cl-,10电子离子应该为H3O+和NH4+,所以对应的元素分别为H、N、O和Cl,依据原子半径的关系可推知X为H、Y为O、Z为N、M为Cl。
【详解】A.O的电负性大于N,故H2O分子比NH3稳定,A正确;B.NH3的沸点知识比PH3、AsH3高,比SbH3、BiH3低,B错误。C.酸性:HNO3<HClO4,C正确。D.五元环为N5-,其中存在的大π键为Π56,D正确。
12.【答案】C
【详解】A.反应除生成高聚物J外,还有小分子HCl生成,该反应为缩聚反应,故A项正确;B.单体TMC中三个侧链均发生反应,使高聚物J形成网状结构,故B项正确; C.MPD的结构简式为,核磁共振氢谱中有4组峰,故C项错误;D.正、负离子容易与水形成水合离子,高聚物J有亲水性可能与其存在正负离子对有关。
13.【答案】D
【详解】A. 石墨相氮化碳类似于石墨层状结构,故N、C原子杂化相同,均为sp2杂化,A错误。B. 碳化氮晶体中存在的作用力除共价键外,还有层与层间的范德华力,B错误。C..原子半径:N
【分析】Cu和FeCl3溶液反应生成FeCl2和CuCl2,若铜过量,溶液黄色褪去,加入蒸馏水后生成白色沉淀,可能是发生了反应:CuCl2+Cu=2CuCl↓,据此分析解答。
【详解】A. 实验I、II、III中的现象为溶液黄色变浅或溶液黄色褪去,说明Fe3+被Cu还原,A正确;B. 对比实验I、II现象,说明白色沉淀的产生与铜粉的量有关,B正确;
C. 对比实验II、III,参加反应的Fe3+的量相同,则生成的Cu2+应相同,但由于实验II生成CuCl,所以加入蒸馏水后c(Cu2+)不相同,C错误;D. 实验III溶液为蓝色,含有Cu2+和过量的铜,向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀CuCl,D正确。
15.【答案】C
【详解】A.酸给出质子转变为相应的碱,HA给出质子得到A-,故A-是HA的共轭碱,A正确;B.由图可知,c(HA)=c(A-)时,pH=5,则Ka(HA)=10-5,B正确;
C.,增大pH过程中,氢离子浓度减小,则的值增大,C错误;D.根据A守恒可知,曲线上任意一点均满足δ(HA)+δ(A-)=1.0,D正确;
16.(14分)(每空2分)
(1)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(2) 2滴FeSO4溶液和1滴蒸馏水 2
(3)层状结构不被破坏,故根据电荷守恒可知,当部分Fe(Ⅱ)被氧化为Fe(Ⅲ)时,层间会引入阴离子平衡电荷。 取少量灰绿色沉淀加入足量的盐酸溶解,再加BaCl2溶液,生成白色沉淀,说明灰绿色沉淀的层间嵌入了SO42-(或取少量样品溶液于试管中,滴加氯化钡溶液生成白色沉淀) 5Fe2++MnO4-+8H+ =5Fe3++Mn2+ +4H2O 4:2:12:1
【详解】(1)向2mL0.1ml/L新制 FeSO4溶液中滴加少量0.1ml/LNaOH溶液,生成Fe(OH)2白色沉淀,迅速被O2氧化变为灰绿色,最终变成红褐色Fe(OH)3沉淀,反应为Fe(OH)2和氧气、水共同作用生成氢氧化铁,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(2)①由实验操作可知,实验Ⅱ验证猜想2,实验Ⅰ验证猜想1,实验Ⅰ需要使用Fe2+过量且需要保证硫酸亚铁溶液的浓度与实验Ⅱ相同,则需要向两片玻璃片中心分别滴加2滴FeSO4溶液和1滴蒸馏水,然后再2滴NaH溶液,面对面快速夹紧;
②实验Ⅰ、实验Ⅱ变量为是否存在三价铁,实验Ⅱ现象为玻璃片夹缝中立即有灰绿色浑浊,实验Ⅰ现象为玻璃片夹缝中有白色浑浊,分开玻璃片,白色浑浊迅速变为灰绿色;说明呈现灰绿色的原因是存在三价铁,故猜想2正确。
(3)①共沉淀物为灰绿色的原因是铁元素部分被氧化后,Fe(Ⅱ)、Fe(Ⅲ)形成的;Fe(OH)2层状结构中OH-位于八面体的顶点,Fe2+占据八面体的中心,两层间有空隙,当部分Fe(Ⅱ)被氧化为Fe(Ⅲ)时,层状结构不被破坏,故根据电荷守恒可知,当部分Fe(Ⅱ)被氧化为Fe(Ⅲ)时,层间会引入阴离子平衡电荷;硫酸根离子能和钡离子生成不溶于酸的硫酸钡沉淀,则证明SO42-的实验操作和现象是:取少量灰绿色沉淀加入足量的盐酸溶解,再加BaCl2溶液,生成白色沉淀,说明灰绿色沉淀的层间嵌入了SO42-;
③滴定过程中Fe2+被高锰酸钾氧化为Fe3+,高锰酸根离子被还原为锰离子同时生成水,离子方程式为:5Fe2++MnO4-+8H+ =5Fe3++Mn2+ +4H2O;
③滴定过程中Fe2+被高锰酸钾氧化为Fe3+,高锰酸根离子被还原为锰离子同时生成水,离子方程式为:5Fe2++MnO4-+8H+ =5Fe3++Mn2+ +4H2O;
17.(13分)
(14分)(每空2分)
(1)①Y3+在溶液中存在平衡:Y3++3HRYR3+3H+,pH增大,c(H+) 减小(或c(OH-)
增大),平衡右移,Y3+萃取率提高 ②1.5
(2)①< ②2Fe 3++2 H3PO4+ 3CO32-= 2FePO4↓+ 3CO 2↑+3H2O ③磷酸法
(3)分液 (4)a
【详解】考查化学反应原理的综合运用,(1)①Y3+的溶液中存在:Y3++3HRYR3+3H+,pH增大,c(H+)减小,根据勒夏特列原理,平衡向正反应方向移动,Y3+的转化率增大,即Y3+萃取率提高;②为使Y3+萃取率≥50%,且杂质离子尽可能少,最佳pH应为1.5左右
(2)①表2采用的是中和沉淀法,通过调节pH,Fe3+去除率高,其原因可能是Ksp[Fe(OH)3]
19. (14分)(每空2分)
(1)还原
(2)①盐酸具有还原性,能与NaClO反应
②
③溶液初始pH高,c(H+)小,有利于和正向进行,NOx脱除率大
(3)①
②
③偏低
江苏省四校2023-2024学年高三下学期期初测试联考化学试卷: 这是一份江苏省四校2023-2024学年高三下学期期初测试联考化学试卷,共12页。试卷主要包含了下列叙述正确的是,下列说法正确的是,下列化学反应表示正确的是等内容,欢迎下载使用。
安徽省“江南十校”2023-2024学年高三下学期3月联考化学试卷: 这是一份安徽省“江南十校”2023-2024学年高三下学期3月联考化学试卷,文件包含安徽省“江南十校”2024届高三下学期3月联考化学试卷pdf、2024届安徽省江南十校联考化学答案pdf等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。
海南省四校2023届高三下学期联考化学试卷(含答案): 这是一份海南省四校2023届高三下学期联考化学试卷(含答案),共14页。












