




【期末复习】第3章 走进溶液世界——初中化学九年级单元知识点梳理(沪教版·上海)
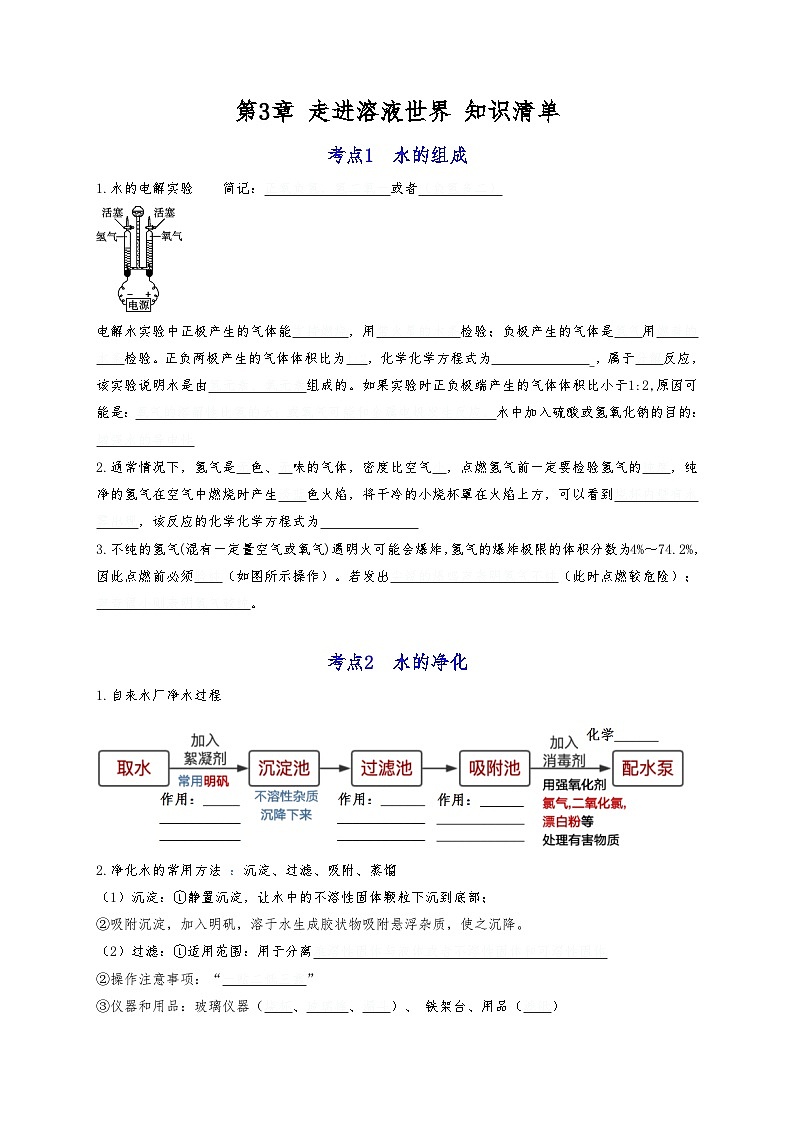
展开水的电解实验 简记:正氧负氢,氢二氧一或者(负氢多二)
电解水实验中正极产生的气体能支持燃烧,用带火星的木条检验;负极产生的气体是氢气用燃着的木条检验。正负两极产生的气体体积比为1:2,化学化学方程式为2H2Oeq \(=====,\s\up7(通电)) 2H2↑+O2↑,属于分解反应,该实验说明水是由氢元素、氧元素组成的。如果实验时正负极端产生的气体体积比小于1:2,原因可能是:氧气的溶解性比氢的大;或氧气可能和金属电极发生反应。水中加入硫酸或氢氧化钠的目的:增强水的导电性
2.通常情况下,氢气是无色、无味的气体,密度比空气小,点燃氢气前一定要检验氢气的纯度,纯净的氢气在空气中燃烧时产生淡蓝色火焰,将干冷的小烧杯罩在火焰上方,可以看到烧杯内壁有水雾出现,该反应的化学化学方程式为2H2Oeq \(=====,\s\up7(通电)) 2H2↑+O2↑
3.不纯的氢气(混有一定量空气或氧气)遇明火可能会爆炸,氢气的爆炸极限的体积分数为4%~74.2%,因此点燃前必须验纯(如图所示操作)。若发出尖锐的爆鸣声表明氢气不纯(此时点燃较危险);声音很小则表明氢气较纯。
考点2 水的净化
1.自来水厂净水过程
2.净化水的常用方法 : 沉淀、过滤、吸附、蒸馏
沉淀:①静置沉淀,让水中的不溶性固体颗粒下沉到底部;
②吸附沉淀,加入明矾,溶于水生成胶状物吸附悬浮杂质,使之沉降。
(2)过滤:①适用范围:用于分离难溶性固体与液体或者不溶性固体和可溶性固体
②操作注意事项:“一贴二低三靠”
③仪器和用品:玻璃仪器(烧杯、玻璃棒、漏斗)、 铁架台、用品(滤纸)
④过滤后,如果滤液仍然浑浊,可能原因有:
A承接滤液的烧杯不干净 B倾倒液体时液面高于滤纸边缘 C滤纸破损
⑤过滤后仍然浑浊的处理方法:清洗仪器,更换滤纸,重新过滤。
小卵石、石英砂、
活性炭不能交换位置
吸附:常用的吸附剂活性炭(有疏松多孔的结构,具有吸附性,物理性质);
除去水中的难溶性杂质、吸附色素和异味等可溶性杂质。
(市场上出售的净水器,有些就是利用活性炭来吸附、过滤水中的杂质的)
(4)蒸馏:利用液体沸点不同将液体分离的方法;可以除去水中所有杂质。得到的水是纯净物。
(5)各种净化方法除去的杂质的种:(在对应项目上画√)
水的净化效果由低到高的是:沉淀、过滤、吸附、蒸馏(均为物理方法),
其中净化效果最好的是蒸馏;既有过滤作用又有吸附作用的净水剂是活性炭。
考点3 硬水和软水
1.硬水是含有较多可溶性钙、镁化合物的水;软水是不含或含较少可溶性钙、镁化合物的水。
2.鉴别方法:加入等量的肥皂水,出现浮渣较多、泡沫较少现象的是硬水,出现泡沫较多、浮渣较少现象的是软水。
3.硬水软化的方法:在实验室采用蒸馏的方法、生活中采用煮沸的方法。
4.爱护水资源的途径:节约用水,防治水体污染
考点4 水的性质
1.水的物理性质:通常情况下,水是无色,无味的透明液体,4℃时水的密度是1g/cm3,
在标况下,水的沸点是100℃,水的凝固点是0℃。水结冰时体积膨胀,所以冰的密度比水小,能浮在水面上。
2.水的化学性质:
(1)在通电条件下能分解,化学方程式为:2H2Oeq \(=====,\s\up7(通电)) 2H2↑+O2↑
(2)与CO2反应生成碳酸,化学方程式为CO2+H2O==H2CO3
植物以水和二氧化碳为原料进行光合作用,生成葡萄糖和氧气,化学方程式为
6CO2+6H2OC6H12O6+6O2
(3)与CaO反应生成氢氧化钙,化学方程式为CaO+H2O==Ca(OH)2
(4)与无水硫酸铜反应,变成蓝色,用于检验水。化学方程式为CuSO4+5H2O==CuSO4•5H2O
考点5 溶液
1.概念:由一种或一种以上物质分散到另一种物质中形成均一、稳定的混合物。
2.特征:具有均一性、稳定性,属于混合物(悬浊液和乳浊液属于混合物,但不均一、不稳定)。
【注意】均一、稳定的液体不一定是溶液,如蒸馏水、乙醇等。溶液不一定都是无色的,如硫酸铜溶液为蓝色,氯化亚铁溶液为浅绿色,氯化铁溶液为黄色。溶质可以是固体,也可以是液体或气体。溶液质量=溶质质量+溶剂质量,但溶液体积≠溶质体积+溶剂体积。
3.组成:溶液由溶质和溶剂组成,若固体、气体与液体混合,固体、气体为溶质,液体为溶剂,若两种液体混合,量多的为溶剂,量少的为溶质;若溶液中有水,水为溶剂。
【注意】水能溶解很多种物质,是一种最常用的溶剂。汽油、酒精等也可以作溶剂,如汽油能溶解油脂、酒精能溶解碘,等等。
4.影响溶解快慢的因素
(1)温度:温度越高,溶解速率越快。
(2)溶质颗粒的大小:溶质颗粒越小,溶解速率越快。
(3)搅拌:搅拌能加快溶解速率。
考点6 乳浊液和乳化
1.乳浊液:小液滴分散到液体里形成的混合物。其特征是:不均一、不稳定、长期放置易分层。
2.乳化现象:洗涤剂使植物油分散成无数细小的液滴,而不聚集成大的油珠的过程,形成的乳浊液能够稳定存在。
3.溶液和乳浊液
悬浊液:由固体小颗粒分散到液体里形成的混合物叫做悬浊液。例如钡餐(硫酸钡的悬浊液)、粉刷墙壁用的涂料、黄河水都是悬浊液。
考点7 溶质的质量分数
1.溶液中溶质的质量分数等于溶液中溶质的质量与溶液的质量之比。计算公式为:
2.溶液稀释:
3.配制一定溶质质量分数氯化钠溶液:
步骤:计算、称量、溶解、装瓶贴标签。
仪器:托盘天平、玻璃棒、量筒、烧杯、药匙、胶头滴管。
注意:若所配制溶液溶质质量分数偏小,则可能原因是称量时左右盘放颠倒、药品倒入烧杯中洒落、药品不纯、量筒量取水时仰视读数、配制溶液烧杯中有水等;若所配制溶液溶质质量分数偏大,可能的原因是量取的水倒入烧杯时外溅、量筒读数时俯视等;而装瓶时洒落不影响(影响或不影响)溶质质量分数。
4.用液体配制溶液:
(1)实验用品:量筒、胶头滴管、烧杯、玻璃棒。
(2)实验步骤:①计算:计算液体或浓溶液的体积和所需溶剂水的体积。
②量取:用量筒量取所需液体或浓溶液体积,用量筒量取所需水的体积。
③配制(稀释):
④装瓶贴标签:
考点8 饱和溶液、不饱和溶液
1.概念:
饱和溶液:在一定温度下,一定量的溶剂中,不能再继续溶解某种物质的溶液。
不饱和溶液:在一定温度下,一定量的溶剂中,能再继续溶解某种物质的溶液。
2.判断方法
(1)当溶液中有固态溶质时,若固体不再减少,那么该溶液是饱和的;若固体不断减少,那么该溶液是不饱和的。
(2)当溶液中没有固态溶质时,向溶液中加入少量相应的溶质,若固体不溶解,则原溶液是饱和的;若固体继续溶解,则原溶液是不饱和的。
(3)当溶液中有晶体析出时,析出晶体后的溶液一定是饱和溶液。
3.转化 :
对大多数固体溶质而言:
加溶质、蒸发水、 降温 蒸发水
不饱和溶液 饱和溶液 结晶
加水、升温 冷却(即降温)
对氢氧化钙或气体溶质而言:
加溶质、蒸发水、 降温 蒸发水
不饱和溶液 饱和溶液 结晶
加水、升温 冷却(即降温)
4.溶液的稀、浓与溶液是否饱和的关系如图所示,饱和溶液不一定是浓溶液;不饱和溶液不一定是稀溶液;但同种溶质在同一温度下,其饱和溶液一定比其不饱和溶液浓。
考点9 溶解度
1.物质的溶解性
①碘几乎不溶于水,却能溶解在汽油中,说明同一种物质在不同溶剂中的溶解性不同。
②高锰酸钾几乎不溶于汽油,碘却能溶解在汽油,说明不同种物质在同一溶剂中的溶解性不同。
③物质的溶解性受温度影响。
2.固体溶解度
(1)概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
(2)四要素:①一定温度下;②100g溶剂;③达到饱和状态;④所溶解溶质的质量,单位为g。
(3)影响因素
①内因:溶质和溶剂的性质。
②外因:温度。
a.多数固体物质的溶解度随温度的升高而增大,如KNO3;
b.少数固体物质的溶解度随温度变化的影响很小,如NaCl;
c.极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
(4)溶解度的相对大小(20℃)
3.气体溶解度
(1)定义:通常是指该气体的压强为101kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素
①内因:气体和溶剂本身的性质。
②外因:温度、压强。
一般来说,温度越高,气体的溶解度越小;压强越大,气体的溶解度越大。
4.固体溶解度曲线
(1)意义
图1 图2
(2)应用
①判断某物质在不同温度下的溶解度。
②比较不同物质在同一温度时的溶解度。
③比较不同物质的溶解度受温度变化影响的大小。
④判断物质的溶解度受温度影响的变化趋势。
⑤判断某物质的饱和溶液与不饱和溶液的转化方法。
⑥确定混合物的分离、提纯方法。
5.结晶:
蒸发结晶(蒸发溶剂):适用于溶解度受温度变化不大的固体
降温结晶(冷却热饱和溶液):适用于溶解度随温度变化较大的固体
6.如何从某溶液中提取固体溶质?
(1)对于所有固体溶质的溶液,都可用“蒸发溶剂法”;
t/℃
溶解度/g
(2)对于形如的溶质的溶液,还可用“降温结晶法”;
(3)对于形如的溶质的溶液,一般只采用“蒸发溶剂法”;
(4)对于形如的溶质的溶液,还可用“升温结晶法”。
7.
(a)t3℃时A的溶解度为 80g ;
(b)P点的的含义 在该温度时,A和C的溶解度相同;
(c)N点为 t3℃时A的不饱和溶液 ,可通过 加入A物质 、 降温、 蒸发溶剂 的方法使它变为饱和;
(d)t1℃时A、B、C、溶解度由大到小的顺序C>B>A;
(e)从A溶液中获取A晶体可用降温结晶 的方法获取晶体;
(f)从B的溶液中获取晶体,适宜采用蒸发结晶的方法获取晶体;
(g)t2℃ 时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B 无晶体析出的有 C ,所得溶液中溶质的质量分数由小到大依次为 A
考点10 溶液的酸碱性
1.酸、碱指示剂:检验溶液酸碱性的指示剂叫酸碱指示剂。
(1)常见的酸碱指示剂
说明:⑴pH越大,碱性越强;pH越小,酸性越强。
⑵pH是在0~14这个范围内变化的,不能小于0或大于14。
⑶书写pH符号时要注意规范化,即“p”要小写,“H”要大写
(2)用pH试纸测定溶液方法:
用玻璃棒蘸取被测液滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,即得pH。
说明: ①不可将试纸放入被测液中,以免将整瓶试剂污染。
②pH试纸不能用水湿润,以免测得的pH值不准。
③pH>7是碱性溶液;pH﹤7是酸性溶液,pH=7是水或中性盐溶液
2、常见的酸溶液、碱溶液
(1)常见的酸:硝酸HNO3、硫酸H2SO4、盐酸HCl:酸性很强;碳酸H2CO3、亚硫酸H2SO3:酸性较弱。(使紫色石蕊试液变红,酚酞试液不变色,pH<7)
(2)常见的碱:氢氧化钠NaOH、氢氧化钡Ba(OH)2: 碱性很强;氢氧化钙Ca(OH)2微溶,碱性不强;氨水NH3•H2O:碱性较弱
(使紫色石蕊试液变蓝,酚酞试液变红,pH>7)
(3)溶液的酸碱性
酸性溶液不一定是酸的溶液,碱性溶液不一定是碱的溶液。很多物质既不属于酸,也不属于碱,但其水溶液却不是中性的。如氯化铵、硫酸铜、氯化铁、硝酸银等溶液均呈酸性。而碳酸钠、碳酸氢钠、醋酸钠、碳酸钾等溶液均呈碱性。
3、酸碱性与生产生活的关系
(1)一些常用食物的pH范围
(2)人体中一些体液的pH
胃液中含有盐酸,pH在0.8~1.5,是强酸性,胃液中的盐酸能杀死进入胃里的细菌,减少和避免得病的机会。
正常人的皮肤,由于汗腺分泌乳酸,呈酸性,pH在5.2~5.8。皮肤的酸性环境不利于大多数微生物的生长繁殖,所以皮肤是维护人体健康的体表屏障。
人体各部分的pH必须保持大致稳定,否则将带来疾病。
(3)酸性土壤施用石灰的作用:当土壤的pH小于4或大于8时,农作物就难于生长。
A.中和土壤酸性。
B.改善土壤中有益微生物的活动条件,促使土壤中某些养分有效化。
C.改善土壤耕作的层的物理性状,提高土壤的吸收和保肥能力。
(4)酸雨的形成和危害
正常的雨水略带酸性,pH为5.6,由于工厂燃烧煤和石油产生的二氧化硫、二氧化氮等气体大量排放,使它们在某些地区空气中含量过高,降水时溶解于水造成酸雨。酸雨最严重时pH可以达到2~3。酸雨的降落还使得江湖水质酸化,水生物死亡。酸雨的降落还使得金属锈蚀加快,建筑物、古迹被腐蚀损坏。难溶性杂质
可溶性杂质
降低水的硬度
沉淀
√
过滤
√
吸附
√
√
蒸馏
√
√
√
溶液
乳浊液
分散物质的溶解性
溶
不溶
分散物质原来的状态
固态、液态、气态
液态
分散粒子
分子或离子
许多分子的集合体
特征
均一、稳定
不均一、不稳定
相同点
都是混合物
溶解度/g
<0.01
0.01~1
1~10
>10
一般称为
难溶
微溶
可溶
易溶
内容
意义
曲线(如图1曲线甲)
表示物质的溶解度受温度影响的变化趋势
曲线上方的点(如图1点C)
表示溶液饱和且有未溶解的固体
曲线下方的点(如图1点A)
表示溶液为不饱和溶液
曲线上的点(如图1点B)
表示物质在对应温度时的溶解度
曲线交点(如图2点d)
表示几种物质在某温度时的溶解度相等
种类
变色情况
石蕊试液(或石蕊试纸)
紫色石蕊试液遇酸性溶液变红色,遇碱性溶液变蓝色
无色酚酞试液
遇酸性溶液不变色,遇碱溶液变红色
pH试纸
酸性增强 碱性增强
食物
pH
食物
pH
柠檬汁
2.2~2.4
牛奶
6.3~6.6
食醋
2.4~3.4
饮用水
6.5~8.0
葡萄酒
2.8~3.8
蛋
7.6~8.0
桔子汁
3~4
软饮料
2.0~4.0
啤酒
4~5
【期末复习】第6章 溶解现象 ——初中化学九年级单元知识点梳理(沪教版): 这是一份【期末复习】第6章 溶解现象 ——初中化学九年级单元知识点梳理(沪教版),文件包含第6章溶解现象初中化学九年级单元知识点梳理沪教版学生版docx、第6章溶解现象初中化学九年级单元知识点梳理沪教版教师版docx等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
【期末复习】第7章 化学与生活——初中化学九年级单元知识点梳理(沪教版·上海): 这是一份【期末复习】第7章 化学与生活——初中化学九年级单元知识点梳理(沪教版·上海),文件包含第7章化学与生活初中化学九年级单元知识点梳理沪教版·上海学生版docx、第7章化学与生活初中化学九年级单元知识点梳理沪教版·上海教师版docx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
【期末复习】第6章 常用的金属和盐——初中化学九年级单元知识点梳理(沪教版·上海): 这是一份【期末复习】第6章 常用的金属和盐——初中化学九年级单元知识点梳理(沪教版·上海),文件包含第6章常用的金属和盐初中化学九年级单元知识点梳理沪教版·上海学生版docx、第6章常用的金属和盐初中化学九年级单元知识点梳理沪教版·上海教师版docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。












