有机化学综合性归纳总结——【期末复习】高二化学单元复习知识点梳理(人教版2019选择性必修3)
展开综合性归纳总结
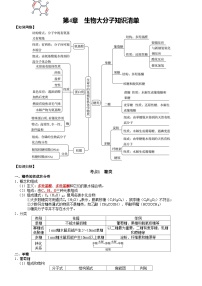
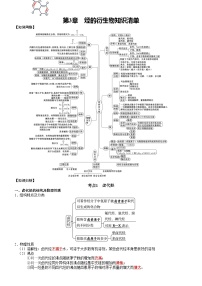
一、官能团的识别
1.烃基官能团
名称 | 碳碳双键 | 碳碳三键 | 甲基 | 苯基 |
符号 | -C≡C- | -CH3 | ||
说明 | 官能团 | 非官能团 | ||
2.含氧官能团
名称 | 羟基 | 醛基 | 酮羰基 | 羧基 | 酯基 | 醚键 | 磺酸基 |
符号 | -OH | -CHO | -- | -COOH | --OR | -SO3H |
3.含氮官能团
名称 | 氨基 | 硝基 | 氰基 | 酰胺基(肽键) |
符号 | -NH2 | -NO2 | -CN |
4.含卤官能团
名称 | 碳氟键 | 碳氯键 | 碳溴键 | 碳碘键 | 酰氯基 |
符号 | -COCl |
二、有机物性质的共性
1.有机物的燃烧
(1)除了CCl4外,所有的有机物都能够燃烧,都能够发生氧化反应
(2)各类有机物燃烧的现象
①甲烷:产生淡蓝色火焰
②乙烯:产生明亮火焰,冒黑烟
③乙炔:产生明亮火焰,冒浓黑烟
④苯:产生明亮火焰,冒浓黑烟
⑤乙醇:产生淡蓝色火焰
(3)火焰的明亮程度及黑烟的浓烈程度取决于含碳量的高低
①乙烯和聚乙烯燃烧现象:相同
②乙酸和葡萄糖燃烧现象:相同
③乙炔和苯燃烧现象:相同
2.能使酸性KMnO4溶液褪色的物质
(1):烯、植物油、裂化汽油、天然橡胶、聚某炔和焦炉气(含乙烯)
(2)含碳碳叁键的物质:如乙炔、丁炔等
(3)含羟基物质:醇、酚
(4)含醛基物质
①醛类物质:乙醛、苯甲醛
②甲酸系列:甲酸、甲酸盐、甲酸酯
③还原性糖:葡萄糖和麦芽糖
(5)苯的同系物:与苯环相连的碳原子上必须有氢原子
(6)苯和聚乙烯不能使酸性KMnO4溶液褪色
3.各类有机物与溴水或溴的CCl4溶液的作用
(1)加成而褪色:含碳碳叁键和碳碳叁键的物质
(2)取代而褪色:酚类的物质
(3)还原而褪色:含醛基的物质
(4)互溶不褪色:乙醇和乙酸
(5)萃取溴水层褪色
①上层颜色深:苯、分馏汽油、乙酸乙酯
②下层颜色深:四氯化碳、氯仿
三、有机反应类型
1.加成反应:不饱和键变成饱和键,形式类似化合(不饱和度减少)
(1)碳碳双键、碳碳叁键
①加成物质:H2、X2、HX、H2O、HCN等
②加成特点:自由加成
CH3CH=CH2+HBrCH3CH2CH2Br或CH3--CH3
③共轭二烯烃:可发生1,2、3,4、1,4、完全加成
CH2=CH-CH2+Br2CH2Br-CH-CH2Br(1,4-加成)
(2)苯环
①H2:+3H2
②Cl2:+3Cl2
(3)醛、酮
①加成物质:H2、NH3、HCN、ROH等
②加成特点:定向加成,氢加在氧上,其余部分加在碳上
CH3--H+ROHCH3--OR
2.消去反应:饱和键变成不饱和键,形式类似分解(不饱和度增多)
(1)卤代烃
①反应条件:NaOH的醇溶液,加热
②消去原理:消卤素原子及β-碳的氢
③消去产物:烯或炔
④邻二卤代烃:优先考虑生成共轭二烯烃,再考虑生成炔烃
+2NaOH或+NaCl+2H2O
(2)醇
①反应条件:浓硫酸,加热
②消去原理:消羟基及β-碳的氢
③消去产物:烯或炔
④邻二醇:优先考虑生成共轭二烯烃,再考虑生成炔烃
CH3---CH3 CH2=CHCH=CH3或CH3C≡CCH3+2H2O
3.取代反应:上一个原子或原子团,一个原子或原子团,类似复分解
(1)卤代反应
①烷烃的卤代反应:光照、纯净的卤素单质蒸气
②苯和苯的同系物侧链上的卤代反应:光照、纯净的卤素单质蒸气
③苯和苯的同系物苯环上的卤代反应:铁或卤化铁催化,纯净的卤素单质
④醇的卤代反应:氢卤酸,加热
⑤酚的卤代:卤素原子取代羟基邻、对位的氢
⑥含-H的烯烃在高温下与卤素单质取代
CH3CH=CH2+Cl2Cl-CH2CH=CH2+HCl
(2)水解反应
①卤代烃水解:羟基取代卤素原子形成醇
CH3CH2Br+NaOHCH3CH2OH+NaBr
②酯的水解:C-O断裂,O上加氢,C加羟基
CH3CO18OCH2CH3+H2OCH3COOH+CH3CH218OH
③肽的水解:C-N断裂,N上加氢,C加羟基
④二糖和多糖的水解:蔗糖水解成葡萄糖和果糖,其余水解最终产物都是葡萄糖
(3)酯化反应:酸脱羟基,醇脱氢
CH3CH218OH+CH3COOHCH3CO18OCH2CH3+H2O
(4)成醚反应:醇分子间脱水
2CH3CH2CH2OHCH3CH2CH2OCH2CH2CH3+H2O
(5)成肽反应:氨基脱氢,羧基脱羟基,生成肽键()
(6)硝化反应
①苯的硝化反应:发生一硝基取代
+HO-NO2NO2+H2O
②甲苯的硝化反应:发生甲基邻、对位的三硝基取代
(7)磺化反应:磺酸基取代苯环上的氢原子
+H2SO4(浓)+H2O
(8)钠和醇或酸或酚的反应,属于置换反应,不属于取代反应
①2CH3CH2OH+2Na2CH3CH2ONa+H2↑
②2CH3COOH+2Na2CH3COONa+H2↑
③2OH+2Na2ONa+H2↑
4.氧化反应:加氧去氢
(1)有机物的燃烧反应
(2)醇和醛的催化氧化
①R1CH2OHR1CHO
②R1--R2R1--R2
③不能催化氧化
④2RCHO+O22RCOOH
(3)酸性KMnO4溶液褪色
(4)醛基使溴水褪色
①反应:RCHO+Br2+H2ORCOOH+2HBr
②注意:溴的四氯化碳溶液不褪色
(5)醛基的银镜反应
①反应:CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3+H2O
②现象:水浴加热,产生光亮的银镜
(6)醛基的斐林反应
①反应:CH3CHO+2Cu(OH)2CH3COOH+Cu2O↓+2H2O
②现象:加热煮沸,产生砖红色沉淀
5.还原反应:加氢去氧
(1)有机物和氢气反应:、-C≡C-、酮羰基、醛羰基、-C≡N
(2)-NO2-NH2
(3)RCOOHRCH2OH
6.聚合反应:有高分子化合物生成
(1)加聚反应:、-C≡C-、酮羰基、醛羰基等
①链节中含偶数个碳原子,一般不含N、O等原子
②高聚物链节的组成与单体的化学组成相同
(2)缩聚产物:分子中至少含两个能脱去小分子的基团(羟基、氨基、羧基)
①链节中含碳原子数不确定,一般含N、O等原子
②高聚物链节的组成与单体的化学组成不同
四、有机化学中常用的定量关系
1.消耗氢气的量(一定发生加成反应)
(1)1mol消耗1mol H2
(2)1mol-C≡C-消耗2mol H2
(3)1mol消耗3mol H2
(4)1mol醛羰基和酮羰基消耗1mol H2
(5)1mol酸羰基或酯羰基或肽羰基消耗0mol H2
(6)1mol-C≡N消耗2mol H2
2.消耗氧气的量
(1)1mol CxHy完全燃烧消耗(x+)mol O2
(2)1mol CxHyOz完全燃烧消耗(x+-)mol O2
3.消耗溴或氯气的量
(1)加成反应
①1mol 消耗1mol Br2
②1mol -C≡C-消耗2mol Br2
(2)取代反应
①1mol烷烃中的氢原子完全被取代消耗(2n+2)mol Cl2
②1mol酚含有n mol邻、对位氢原子,完全被取代消耗nmol Br2
(3)氧化反应:1mol-CHO被溴水氧化消耗1mol Br2
4.消耗NaOH溶液的量
(1)基本反应
①1mol羧基(-COOH)消耗1mol NaOH
②1mol酚羟基消耗1mol NaOH
③1mol卤化氢(HX)消耗1mol NaOH
(2)卤代烃
①1mol卤代烃(RX)消耗1mol NaOH
②1mol卤代苯完全水解消耗2mol NaOH
(3)酯基
①1mol酯基(-COOR)消耗1mol NaOH
②1mol油脂完全水解消耗3mol NaOH
③1mol酚酯完全水解消耗2mol NaOH
④1mol高分子酯完全水解消耗nxmol NaOH
⑤1mol肽键()完全水解消耗1mol NaOH
5.消耗钠的量
(1)钠能够和羟基(醇、酸、酚)发生置换反应
(2)产生1mol H2消耗2mol-OH消耗2mol Na
6.产生二氧化碳的量
(1)1mol羧基消耗1mol NaHCO3产生1mol CO2
(2)1mol羧基消耗0.5mol Na2CO3产生0.5mol CO2
(3)1mol酚羟基消耗1mol Na2CO3产生0mol CO2
7.银镜反应
(1)RCHO~2[Ag(NH3)2]OH~2Ag↓
(2)HCHO~4[Ag(NH3)2]OH~4Ag↓
8.消耗氢氧化铜的量
(1)中和反应:1mol羧基消耗0.5mol Cu(OH)2
(2)铜镜反应(斐林反应)
①RCHO~2Cu(OH)2~1Cu2O↓
②HCHO~4Cu(OH)2~2Cu2O↓
(3)1mol下图有机物完全反应消耗3mol Cu(OH)2
五、有机反应小实验
1.常见液体有机物的密度和溶解性
(1)水溶性有机物
①简单的醇类:乙醇、甘油(丙三醇)
②简单的酸醛:乙酸、乙醛
③单糖和二糖:葡萄糖、果糖、蔗糖、麦芽糖
(2)脂溶性有机物
密度比水小 | ①液态烃类:苯、汽油、己烷、环己烷、甲苯 |
②酯和油脂:乙酸乙酯、植物油 | |
密度比水大 | ①多卤代烃:CH2Cl2、CHCl3、CCl4 |
②溴代烃:溴苯、溴乙烷、1,2-二溴乙烷 | |
③硝基化合物:硝基苯 |
2.某些有机反应的条件
(1)烷烃和卤素的取代反应
①反应条件:光照和纯净的卤素单质
②烷烃不能使卤水褪色,液体烷烃和卤水混合发生萃取反应
③产物特点:每一种产物都有,氯化氢最多
(2)苯的同系物和卤素的取代反应
①反应条件:光照或催化剂和纯净卤素单质
②苯和苯的同系物不能使卤水褪色,和卤水混合发生萃取反应
(3)苯酚和卤素的取代反应
①反应现象:产生白色沉淀
②反应条件:浓溴水,不能用稀溴水或溴的四氯化碳溶液
(4)醛和葡萄糖的银镜反应
①反应条件:水浴加热
②反应环境:碱性溶液(银氨溶液自身显强碱性)
(5)醛和葡萄糖的铜镜反应
①反应条件:加热煮沸
②反应环境:碱性溶液(NaOH溶液过量)
③反应试剂:新制的氢氧化铜悬浊液(不能用氢氧化铜沉淀)
(6)催化剂的使用
①烯、炔、苯环和氢气的加成反应:一般用镍(Ni)作催化剂
②酯化反应:一般用浓硫酸作催化剂
③酯、油脂、蔗糖、麦芽糖、淀粉的水解:一般用稀硫酸作催化剂
④纤维素水解:一般用浓硫酸作催化剂
3.有机物反应的可逆性
(1)烷烃和氯气的取代反应
(2)苯的同系物和氯气在光照下的取代反应
(3)酯和油脂的酸性水解
(4)酸和醇的酯化反应
4.淀粉水解程度的检验
(1)流程:淀粉水解液中和液
(2)程度验证
①没有水解:向中和液中加入新制的氢氧化铜悬浊液,加热煮沸,无砖红色沉淀
②完全水解:向水解液中加入新制的碘水,溶液不变蓝
5.卤代烃水解产物的检验
(1)流程:R-X水解液中和液AgX↓
(2)现象:氯代烃:白色沉淀;溴代烃:浅黄色沉淀;碘代烃:黄色沉淀
六、典型有机物之间的转化关系
第2章 官能团与有机化学反应 烃的衍生物——【期末复习】高二化学单元复习知识点梳理(鲁科版2019选择性必修3): 这是一份第2章 官能团与有机化学反应 烃的衍生物——【期末复习】高二化学单元复习知识点梳理(鲁科版2019选择性必修3),共21页。
有机化学综合性归纳总结——【期末复习】高二化学单元复习知识点梳理(鲁科版2019选择性必修3): 这是一份有机化学综合性归纳总结——【期末复习】高二化学单元复习知识点梳理(鲁科版2019选择性必修3),共6页。试卷主要包含了官能团的识别,有机物性质的共性,有机反应类型,有机化学中常用的定量关系,有机反应小实验,典型有机物之间的转化关系名称等内容,欢迎下载使用。
专题1 有机化学的发展及研究思路——【期末复习】高二化学单元复习知识点梳理(苏教版2019选择性必修3): 这是一份专题1 有机化学的发展及研究思路——【期末复习】高二化学单元复习知识点梳理(苏教版2019选择性必修3),共6页。试卷主要包含了我国早期有机化学,有机化学的形成,现代有机化学,仪器分析法,平均值法等内容,欢迎下载使用。