
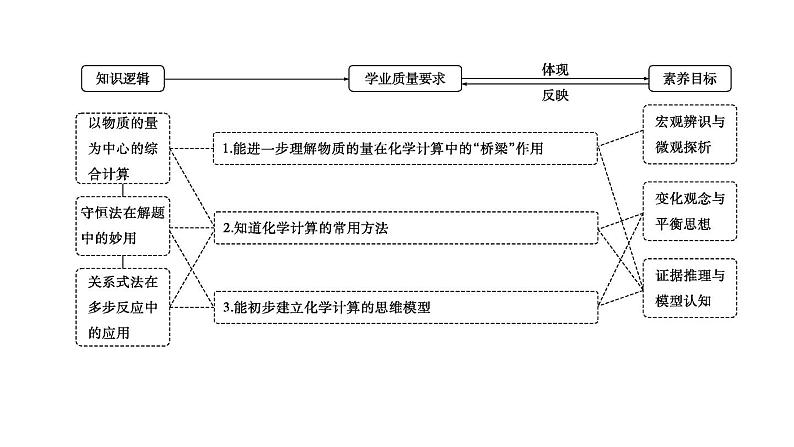










2024届高考化学一轮复习课件 第二章 物质的量 第2讲 化学计算的常用方法
展开第2讲 化学计算的常用方法
必备知识·整合
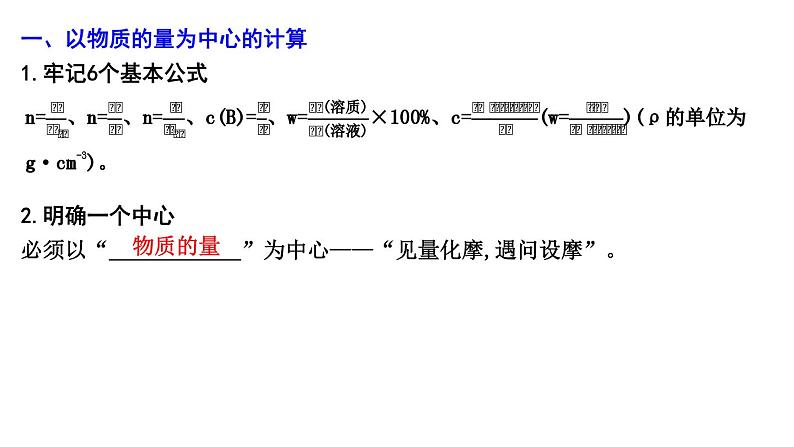
一、以物质的量为中心的计算1.牢记6个基本公式
2.明确一个中心必须以“ ”为中心——“见量化摩,遇问设摩”。
物质的量
结论:化学方程式中各物质的化学计量数之比等于各物质的 之比。
物质的量
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。(1)标准状况下,22.4 L HCl溶于1 L水,所得溶液的物质的量浓度为1 mol/L。( )解析:(1)22.4 L HCl溶于1 L水后,得到的溶液不是1 L,所得溶液的物质的量浓度小于1 mol/L。(2)化学方程式中各物质的化学计量数之比等于质量之比。( )
×
×
×
√
二、化学计算的常用方法1.差量法根据化学反应前后物质的有关物理量发生的变化,找出“理论差量”,如反应前后的 差、物质的量差、气体 差等,该差量的大小与反应物的有关量成正比。差量法就是借助这种比例关系,解决一定量变的计算题的方法。例如:把一铁棒插入CuSO4溶液后,过一段时间取出,铁棒质量增加了4 g,据此可求出参加反应的Fe的质量。
质量
体积
2.关系式法当已知量和未知量之间是靠多个反应来联系时,只需直接确定 和未知量之间的比例关系,即“关系式”。(1)根据化学方程式确定关系式。写出发生反应的化学方程式,根据量的关系写出关系式。例如:把CO还原Fe2O3生成的CO2通入澄清石灰水中,求生成沉淀的量。
则关系式为3CO~3CO2~3CaCO3,即 。(2)根据原子守恒确定关系式。上述例子中也可直接根据碳原子守恒得出CO~CaCO3。
已知量
CO~CaCO3
3.守恒法所谓“守恒”就是物质在发生“变化”的过程中某些量的总量保持“ ”。在化学变化中有各种各样的守恒,如质量守恒、原子守恒、得失电子守恒、电荷守恒、能量守恒等。
不变
原子个数
电子
正电荷
电荷
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。
解析:(1)反应中0.5 mol Cu溶解,析出1 mol Ag,溶液减轻76 g。(2)使用关系式法时,需根据中间产物找出最初反应物和最终生成物之间的物质的量关系。( )(3)1 mol Na无论生成Na2O或Na2O2,或两者的混合物,均转移1 mol电子。( )(4)离子方程式中,反应物的正电荷总数等于生成物的正电荷总数。( )解析:(4)离子方程式中,反应物的电荷总数等于生成物的电荷总数且电性相同。
×
√
√
×
关键能力·提升
考点一 以物质的量为中心的综合计算(比例式法、差量法)
结合化学方程式列比例式计算
答案:(1)30.0
答案:(1)0.06 mol
答案:(2)①0.56 g
答案:②0.5
[归纳拓展] 以物质的量为中心的综合计算题解答步骤(1)根据题意写出并配平化学方程式。(2)依据题中所给信息及化学方程式判断过量物质,用完全反应物质的量进行计算。(3)把已知的和需要求解的量分别写在化学方程式有关化学式的下面,两个量及单位“上下一致,左右相当”。(4)选择有关量(如物质的量、气体体积、质量等)的关系作为计算依据,列比例式,求未知量。
结合化学方程式找差量计算
3.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,请列式计算该样品中Na2CO3的质量分数。
[归纳拓展] 差量法的解题步骤(1)分析题意:分析化学反应各物质之间的数量关系、引起差值的原因。(2)确定是否能用差量法:分析差值与始态量或终态量是否存在比例关系,以确定是否能用差量法。(3)写出正确的化学方程式。(4)根据题意确定“理论差量”与题中提供“实际差量”,列出比例关系,求出答案。
考点二 守恒法在解题中的妙用
(2021·浙江6月选考)将3.00 g某有机物(仅含C、H、O元素,相对分子质量为150)样品置于燃烧器中充分燃烧,依次通过吸水剂、CO2吸收剂,燃烧产物被完全吸收。实验数据如下表:
请回答:(1)燃烧产物中水的物质的量为 mol。 (2)该有机物的分子式为 (写出计算过程)。
答案:(1)0.060 0
(1)实验中吸水剂和CO2吸收剂可以选择哪些物质?提示:吸水剂可以选择浓硫酸或无水CaCl2;CO2吸收剂可以选择碱石灰、CaO、NaOH固体或NaOH浓溶液等。(2)有机物燃烧生成CO2和H2O,若未给出是否含C、H、O元素,怎样确定是否含O元素?提示:根据有机物燃烧生成CO2、H2O的质量,可确定有机物中C、H的质量,若m(有机物)>m(C)+m(H),则有机物中一定含O元素,若 m(有机物)=m(C)+m(H),则有机物中一定不含O元素。
1.有一份在空气中暴露过的KOH固体样品,经分析知其内含水7.12%、K2CO3 2.88%、KOH 90%,若将此样品1 g加入46.00 mL的1 mol·L-1盐酸中,过量的酸再用1.07 mol·L-1KOH溶液中和,蒸发中和后的溶液可得固体 g。
答案:3.427
解析:此题中发生的反应很多,但仔细分析可知蒸发溶液后所得固体为KCl,其Cl-全部来自盐酸中的Cl-,在整个过程中Cl-守恒,即n(KCl)=n(HCl),故m(KCl)=0.046 L×1 mol·L-1×74.5 g·mol-1=3.427 g。
2.将a g Fe2O3、Al2O3样品溶解在过量的200 mL pH=1的硫酸溶液中,然后向其中加入NaOH溶液,使Fe3+、Al3+刚好沉淀完全,用去NaOH溶液100 mL,则NaOH溶液的浓度为 。
答案:0.2 mol·L-1
答案:(1)偏大
解析:(2)根据题意,计算出消耗K2Cr2O7的物质的量,然后根据氧化还原反应的电子得失守恒,找出关系式,列等式求出铁原子的物质的量,得出铁元素的质量,最后得出样品中铁元素的质量分数。
[归纳总结] 应用守恒法解题的一般步骤第一步:明确题目要求解的量;第二步:根据题目要求解的量,分析反应过程中物质的变化,找出守恒类型及相关的量;第三步:根据守恒原理,梳理出反应前后守恒的量,列式计算求解。
考点三 关系式法在多步反应中的应用
答案:(2)31.5%
[思维建模] 关系式法的解题步骤
高考真题·导向
1.(2022·浙江1月选考)某同学设计实验确定 Al(NO3)3·xH2O的结晶水数目。称取样品 7.50 g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06 g,残留的固体产物是Al2O3,质量为1.02 g。计算:(1)x= (写出计算过程)。
1.(2022·浙江1月选考)某同学设计实验确定 Al(NO3)3·xH2O的结晶水数目。称取样品 7.50 g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06 g,残留的固体产物是Al2O3,质量为1.02 g。计算:(2)气体产物中n(O2)= mol。
答案:(2)0.010 0
3.(2022·湖南卷,节选)某实验小组用重量法测定产品中BaCl2·2H2O的含量测定①称取产品0.500 0 g,用100 mL水溶解,酸化,加热至近沸;②在不断搅拌下,向①所得溶液逐滴加入热的0.100 mol·L-1 H2SO4溶液;③沉淀完全后,60 ℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为0.466 0 g。产品中BaCl2·2H2O的质量分数为 (保留三位有效数字)。
答案:97.6%
4.(2021·全国甲卷,节选)胆矾(CuSO4·5H2O)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的CuO(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:(1)结晶水测定:称量干燥坩埚的质量为m1,加入胆矾后总质量为m2。将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为m3。根据实验数据,胆矾分子中结晶水的个数为 (写表达式)。
4.(2021·全国甲卷,节选)胆矾(CuSO4·5H2O)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的CuO(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:(2)下列操作中,会导致结晶水数目测定值偏高的是 (填标号)。 ①胆矾未充分干燥②坩埚未置于干燥器中冷却③加热时有少量胆矾迸溅出来
解析:(2)胆矾未充分干燥,会使测定的水的质量偏高,则会导致结晶水数目测定值偏高,①符合题意;坩埚未置于干燥器中冷却,会使测定的水的质量偏低,则会导致结晶水数目测定值偏低,②不符合题意;加热时有少量胆矾迸溅出来,会使测定的水的质量偏高,则会导致结晶水数目测定值偏高,③符合题意。
答案:(2)①③
点击进入 课后作业·集训
2024届高考化学一轮复习 第二章 化学常用计量 第4讲 以物质的量为中心的化学计算常用方法课件PPT: 这是一份2024届高考化学一轮复习 第二章 化学常用计量 第4讲 以物质的量为中心的化学计算常用方法课件PPT,共38页。PPT课件主要包含了答案D,解题步骤,答案A,三热重分析法等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第2章 第8讲 化学计算的常用方法 (含解析): 这是一份新高考化学一轮复习精品课件 第2章 第8讲 化学计算的常用方法 (含解析),共60页。PPT课件主要包含了内容索引,利用差量法计算,必备知识,关键能力,利用关系式法计算,答案2579t,答案5195t,容量瓶,得关系式,答案932%等内容,欢迎下载使用。
2024年高考化学一轮复习(新高考版) 第2章 第8讲 化学计算的常用方法: 这是一份2024年高考化学一轮复习(新高考版) 第2章 第8讲 化学计算的常用方法,文件包含2024年高考化学一轮复习新高考版第2章第8讲化学计算的常用方法pptx、2024年高考化学一轮复习新高考版第2章第8讲化学计算的常用方法docx、第2章第8讲化学计算的常用方法docx、第2章第8练化学计算的常用方法docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












