
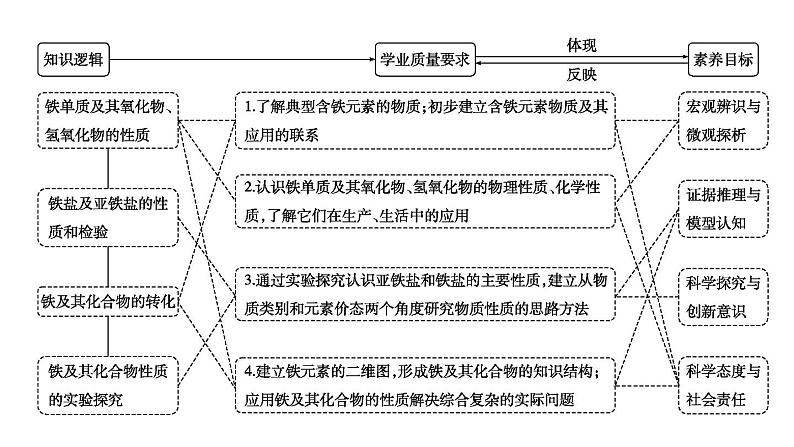

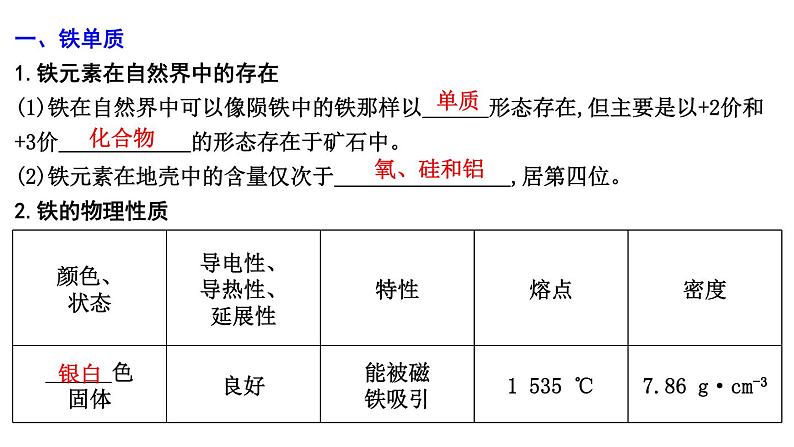
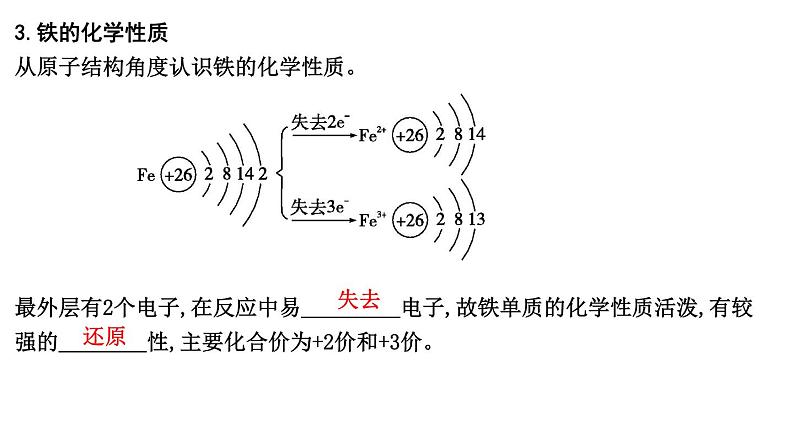
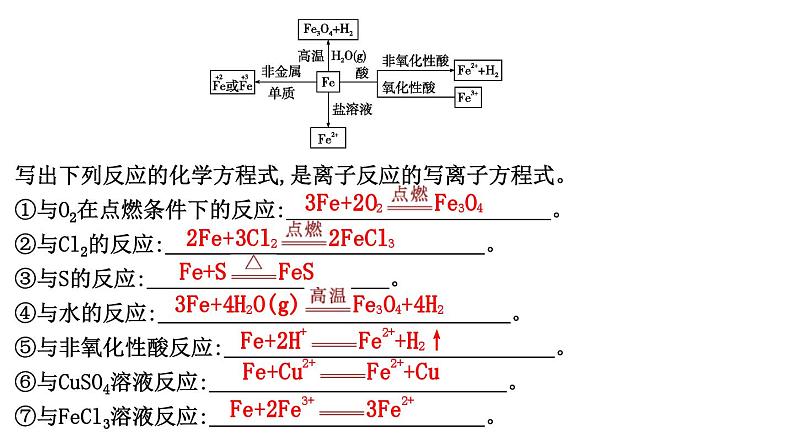



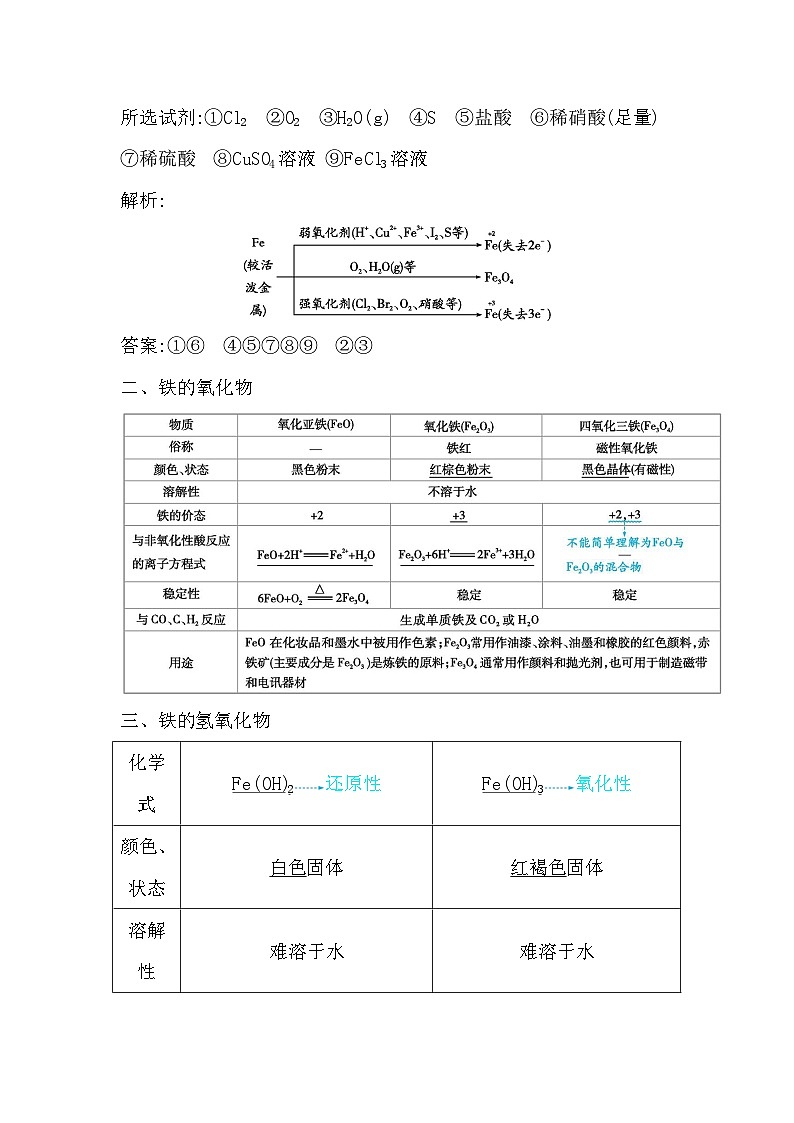
2024届高考化学一轮复习课件 第三章 金属及金属材料 第2讲 铁及其化合物
展开第2讲 铁及其化合物
(40分钟)
选题表
知识点 | 题号 | ||
基础 | 能力 | 创新 | |
铁及其氧化物、氢氧化物性质 | 1,2 |
|
|
铁盐、亚铁盐 |
| 4,5, 7,10 | 11 |
铁及其化合物的转化 | 3 | 9 |
|
工艺流程中的铁 |
| 6,8 | 12 |
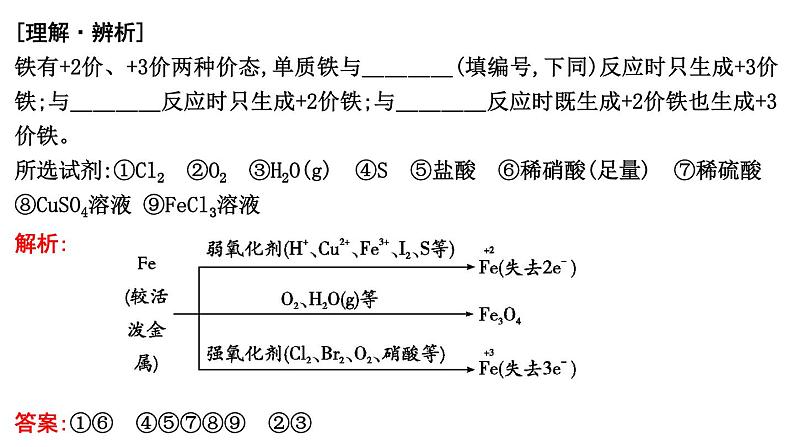
1.《天工开物》中“冶铁”原典中记载:“凡冶铁成器,取已炒熟铁为之……凡炉中炽铁用炭,煤炭居十七,木炭居十三……即用煤炭也别有铁炭一种,取其火性内攻、焰不虚腾者,与炊炭同行而有分类也……”下列说法正确的是( D )
A.熟铁是纯净的铁单质,生铁是铁和碳的混合物
B.冶铁过程只涉及化合反应与置换反应
C.铁炭和炊炭均为碳元素的同素异形体
D.冶铁用到的煤炭和木炭均可还原铁的氧化物
解析:生铁是铁合金,属于混合物,生铁的含碳量为2%~4.3%,熟铁指的是钢,也是铁合金,属于混合物,钢的含碳量为0.03%~2%,A错误;冶铁过程中CO与铁的氧化物反应生成铁和CO2属于氧化还原反应,B错误;铁炭和炊炭不互为同素异形体,铁炭指铁合金,为混合物,C错误;冶铁用到的煤炭和木炭主要成分为碳,有还原性,均可还原铁的氧化物得到单质,D正确。
2.下列有关铁及其化合物的性质与用途具有对应关系的是( A )
A.铁粉具有还原性,可用作食品保存的抗氧化剂
B.纳米Fe3O4能与酸反应,可用作铁磁性材料
C.FeCl3溶液呈酸性,可用于腐蚀印刷电路板上的Cu
D.聚合硫酸铁能水解并形成胶体,可用于自来水的消毒
解析:铁粉具有还原性,能消耗食品包装袋内的氧气,可用作食品保存的抗氧化剂,A正确;Fe3O4具有磁性,所以纳米Fe3O4可用作铁磁性材料,与Fe3O4能与酸反应无关,B错误;FeCl3溶液可用于腐蚀印刷电路板上的Cu,是因为Fe3+能把Cu氧化为Cu2+,C错误;聚合硫酸铁能水解并形成胶体,可用于净水,不能消毒,D错误。
3.在指定条件下,下列选项所示的物质间转化能实现的是( B )
A.FeFe2O3Fe(OH)3
B.Fe3O4FeFeCl2
C.FeS2SO3H2SO4
D.Fe3O4FeCl3(aq)无水FeCl3
解析:铁在不同条件下可以生成不同的氧化物,Fe2O3不溶于水,不能直接与水反应生成氢氧化铁,A项错误;铁的氧化物均能被CO还原为铁,铁与盐酸发生置换反应生成二价铁,B项正确;含低价硫元素的化合物在空气中充分反应,氧化产物均只能生成二氧化硫,C项错误;四氧化三铁与盐酸反应会生成氯化亚铁和氯化铁两种产物,且两种产物均要发生水解,应用热的HCl气体烘干制取无水氯化铁,D项错误。
4.室温下,探究FeCl3溶液和KI溶液反应的限度,实验步骤如下。
步骤Ⅰ:取5 mL 0.1 mol·L-1 KI溶液,向其中加入1 mL 0.1 mol·L-1 FeCl3溶液,振荡,观察实验现象。
步骤Ⅱ:继续向上述溶液中加入2 mL苯,充分振荡后静置,观察实验
现象。
步骤Ⅲ:取下层溶液,向其中滴加5~6滴15%硫氰化钾溶液,观察溶液的颜色。
下列说法不正确的是( D )
A.步骤Ⅰ中反应的离子方程式:2Fe3++2I-2Fe2++I2
B.步骤Ⅱ中通过分液可将水溶液与苯分离
C.步骤Ⅲ中加入硫氰化钾溶液后溶液变红说明反应有一定限度
D.步骤Ⅲ反应后溶液中大量存在Fe3+、Fe2+、Cl-、SCN-
解析:步骤Ⅰ中铁离子与碘离子反应的离子方程式为2Fe3++2I-2Fe2++I2,故A正确;苯不溶于水,所以步骤Ⅱ中通过分液的方法可将水溶液与苯分离,故B正确;由题意可知,碘化钾溶液与氯化铁溶液反应时,碘化钾溶液过量,若步骤Ⅲ中加入硫氰化钾溶液后溶液变红,说明溶液中存在铁离子,即铁离子与碘离子的反应不能完全进行,有一定限度,故C正确;溶液中铁离子会与硫氰酸根离子反应生成红色的硫氰化铁,则铁离子不可能与硫氰酸根离子在溶液中大量共存,故D不正确。
5.滴定法测铀时需添加VOSO4作催化剂,该物质易被氧化,实验室常用Fe2+去除VOSO4溶液中的(VO2)2SO4,实验装置如图所示。下列分析正确的是( B )
A.VOSO4和(VO2)2SO4中V元素的化合价相同
B.b中反应所生成气体的作用之一是将装置中的空气排尽
C.用小试管在m处收集气体并验纯后,应先关闭K2,再打开K3
D.实验完毕,可用氯水和KSCN溶液检验c中溶液是否含有Fe2+
解析:VOSO4中V的化合价为+4价,(VO2)2SO4中V的化合价为+5价,A错误;VOSO4易被氧化,所以b中反应生成的H2的作用之一就是排尽装置中的空气,防止VOSO4被氧化,B正确;用小试管在m处收集气体并验纯,应先打开K3,再关闭K2,C错误;实验完毕后,c中含有较多VOSO4,VOSO4易被氧化,可与氯水反应,故不能用氯水和KSCN溶液检验c中溶液是否含有Fe2+,D错误。
6.一种利用废旧镀锌铁皮制备磁性Fe3O4纳米粒子的工艺流程如图
所示。
下列有关说法不正确的是( B )
A.“碱洗”主要是为了去除废旧镀锌铁皮中的锌
B.“氧化”后的溶液中金属阳离子主要有Fe3+、Na+
C.“氧化”时发生反应的离子方程式为2Fe2++ClO-+2H+2Fe3++Cl-+H2O
D.用激光笔照射“加热沉铁”后所得分散系,产生丁达尔效应
解析:锌和氢氧化钠反应,因此“碱洗”是为了去除废旧镀锌铁皮表面的油污和锌,故A正确;“氧化”是次氯酸钠和亚铁离子反应,因为要制取Fe3O4纳米粒子,所以溶液中金属阳离子主要有Fe2+、Fe3+、Na+,故B错误;“氧化”时次氯酸钠和亚铁离子反应生成铁离子和氯离子,因此发生反应的离子方程式为2Fe2++ClO-+2H+2Fe3++Cl-+H2O,故C正确;加热沉铁即把氢氧化亚铁、氢氧化铁加热分解生成Fe3O4胶体,因此用激光笔照射“加热沉铁”后所得分散系,产生丁达尔效应,故D正确。
7.一定量的某磁黄铁矿(主要成分为FexS,S为 -2价)与100 mL盐酸恰好完全反应(杂质不与盐酸反应),生成0.1 mol硫单质、0.4 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。下列有关说法正确的是( C )
A.c(HCl)=4.0 mol/L
B.x=0.85
C.生成了0.4 mol H2S
D.FexS中,n(Fe2+)∶n(Fe3+)=2∶1
解析:盐酸恰好反应生成0.4 mol FeCl2,根据氯原子守恒得c(HCl)=
=8 mol/L,故A错误;部分HCl中的氢离子转化为H2S,根据氢原子、氯原子守恒得H2S的物质的量n(H2S)=0.5n(HCl)=n(FeCl2)=
0.4 mol,FexS中S的物质的量等于S和H2S物质的量之和,n(S)=
0.1 mol+0.4 mol=0.5 mol,n(Fe)=0.4 mol,所以n(Fe)∶n(S)=0.4 mol∶0.5 mol=0.8,所以 x=0.8,故B错误,C正确;FexS中S为-2价,生成硫单质中S的化合价为0,则生成0.1 mol S,生成H2S气体不发生化合价变化,则共转移电子为0.1 mol×2=0.2 mol,生成亚铁离子不存在化合价变化,则根据转移电子守恒得n(Fe3+)=0.2 mol,n(Fe2+)=
0.4 mol-0.2 mol=0.2 mol,所以Fe2+与Fe3+的物质的量之比为0.2 mol∶0.2 mol=1∶1,故D错误。
8.(不定项)以高硫铝土矿(主要成分为Fe2O3、Al2O3、SiO2,少量FeS2和硫酸盐)为原料制备聚合硫酸铁[Fe2(OH)x(SO4)y]n和明矾的部分工艺流程如图所示。下列说法错误的是( BC )
已知:赤泥液的主要成分为Na2CO3。
A.赤泥液的作用是吸收“焙烧”阶段中产生的SO2
B.聚合硫酸铁可用于净化自来水,与其组成中的Fe3+具有氧化性有关
C.在“聚合”阶段,若增加Fe2O3用量,会使[Fe2(OH)x(SO4)y]n中x变小
D.从“滤液”到“明矾”的过程中还应有“除硅”步骤
解析:焙烧时,FeS2与O2反应生成Fe2O3和SO2,即4FeS2+11O22Fe2O3+
8SO2,用赤泥液吸收生成的SO2,即Na2CO3+SO2Na2SO3+CO2,故A正确;聚合硫酸铁可用于净化自来水,与其组成中的Fe3+具有水解产生胶体的性质有关,与其组成中的Fe3+具有氧化性无关,故B错误;在“聚合”阶段,若增加Fe2O3用量,碱性增强,x变大,故C错误;从“滤液”到“明矾”的过程中,由于“碱浸”造成二氧化硅溶于氢氧化钾溶液,滤液中含硅酸盐,需要进行“除硅”步骤,故D正确。
9.(不定项)微生物法浸出黄铜矿(CuFeS2,其中Cu为+2价)中铜元素的过程如图。下列说法错误的是( A )
A.该方法的原料只有黄铜矿和氧气
B.Fe2(SO4)3和H2SO4可以循环利用
C.微生物在整个转化过程中起催化作用
D.当黄铜矿中的铁元素全部转化为Fe3+时,生成2 mol S同时消耗4.25 mol O2
解析:根据图示各物质的转化关系可知,CuFeS2与H+反应生成Cu2+、H2Sn、Fe2+,Fe3+被还原为Fe2+,后在微生物作用下被O2氧化为Fe3+;Fe3+与H2Sn反应生成S8,S8在微生物作用下与O2和H2O反应生成H2SO4,而H2SO4又可重新参加反应。题给方法的原料为黄铜矿、硫酸和氧气,故A错误;H2SO4和Fe2(SO4)3可循环利用,故B正确;微生物在整个转化过程中起催化作用,故C正确;当黄铜矿中的铁元素全部转化为铁离子时,生成2 mol硫酸根离子,反应消耗氧气的物质的量为17 mol×=4.25 mol,故D正确。
10.某学习小组拟研究FeSO4的分解实验,请你利用所学知识帮该小组同学完成以下实验探究。
[实验目的] 探究FeSO4分解产物与温度的关系。
[提出假设]
假设1:Fe2O3、SO3、SO2;
假设2:FeO、SO3、SO2;
假设3:Fe3O4、SO3、SO2。
[查阅资料] 几种物质的物理性质如表所示。
物质 | SO3 | SO2 | O2 | N2 |
熔点/℃ | 16.8 | -72.4 | -218.4 | -209.9 |
沸点/℃ | 44.8 | -10 | -182.9 | -195.8 |
回答下列问题。
(1)根据所学知识判断,假设2肯定不成立,理由是 。
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是 ,(只填操作),当A处固体完全分解后通入N2的目的是 。
(3)实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备N2,该反应的离子方程式为 。
(4)低温浴槽Ⅰ收集的物质是 (填化学式),低温浴槽Ⅱ控制的温度范围为 。
(5)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
实验 | A处温 度/℃ | FeSO4 质量/g | 低温浴 槽Ⅰ净增 质量/g | 低温浴 槽Ⅱ净增 质量/g |
甲 | T1 | 3.04 | 0.80 | 0.64 |
乙 | T2 | 4.56 | 1.60 | 0.64 |
甲组实验中A装置得到固体产物是 (填化学式)。
(6)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是
。
[实验结论] 通过上述实验得出,FeSO4分解产物与温度有关。
[交流反思] FeSO4分解反应中是否有O2生成?
(7)为验证实验猜想,他们设计两种方案检验O2。
方案1:将D管导出的气体通入酸化的淀粉KI溶液中。
方案2:将带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案 (填“1”或“2”)可行。
解析:(1)根据所学氧化还原反应的规律可知,有元素化合价升高,必有元素化合价降低,而假设2中根据分解产物分析可知,反应后部分硫元素化合价降低,但无化合价升高的元素,不符合氧化还原反应的规律,所以假设2错误。
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前需通入一定量氮气,可排除装置内的空气,避免氧气或水蒸气干扰实验;当A处固体完全分解后通入N2,随着气流方向可使产生的气体全部进入下一装置,使其全部被吸收。
(3)饱和氯化铵溶液和亚硝酸钠溶液共热可发生归中反应生成氮气、氯化钠和水,其离子方程式为N+NN2↑+2H2O。
(4)根据表中数据可知,SO3的沸点为44.8 ℃,SO2的沸点为-10 ℃,所以低温浴槽Ⅰ收集的物质应为SO3,控制的温度范围为-10~44.8 ℃;低温浴槽Ⅱ收集的是SO2,则控制的温度范围为 -72.4~-10 ℃。
(5)甲组实验中,FeSO4的质量为3.04 g,则其物质的量为=
0.02 mol,低温浴槽Ⅰ中SO3的质量为0.8 g,其物质的量为=
0.01 mol,低温浴槽Ⅱ中SO2的质量为0.64 g,其物质的量为=
0.01 mol,根据元素守恒可知,得到的固体为Fe2O3,其物质的量为 0.01 mol。
(6)根据(5)分析可知,乙组实验中,FeSO4的质量为4.56 g,则其物质的量为=0.03 mol,低温浴槽Ⅰ中SO3的质量为1.60 g,其物质的量为=0.02 mol,低温浴槽Ⅱ中SO2的质量为0.64 g,其物质的量为=0.01 mol,根据元素守恒可知,得到的固体为Fe3O4,其物质的量为0.01 mol,所以取乙组实验得到的固体溶于稀硫酸,溶液中含铁离子与亚铁离子,在一份溶液中滴加 K3[Fe(CN)6] 溶液,会产生蓝色沉淀,在另一份溶液中滴加NH4SCN溶液,观察到的现象是溶液显红色。
(7)N2不燃烧也不支持燃烧,假设过程中持续缓缓通入N2,若用带火星的木条检验氧气的存在,现象会受干扰,而氧气具有氧化性,在酸性条件下可氧化碘离子生成能使淀粉变蓝的碘单质,不受氮气的干扰,所以方案1可行。
答案:(1)化合价只有降低,不符合氧化还原反应化合价变化规律
(2)通入一段时间N2 使A中残留的三氧化硫和二氧化硫分别排入Ⅰ和Ⅱ中
(3)N+NN2↑+2H2O
(4)SO3 -72.4~-10 ℃
(5)Fe2O3
(6)溶液显红色
(7)1
11.Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如[Fe(H2O)6]3+、[Fe(SCN)6]3-(红色)、[FeF6]3-(无色)等,已知[Fe(H2O)6]3+为浅紫色。某同学按如下步骤完成实验:
下列说法不正确的是( C )
A.溶液Ⅰ呈黄色,可能是Fe3+水解产物的颜色所致
B.为了能观察到溶液Ⅰ的浅紫色,可向该溶液中加入硝酸
C.Ⅱ到Ⅲ溶液颜色的变化一定是由[Fe(SCN)6]3-全部转化为[FeF6]3-引起的
D.可以推测H2O、SCN-、F-三种微粒结合Fe3+的能力依次增强
解析:[Fe(H2O)6]3+为浅紫色,最后溶液呈黄色,说明存在其他物质,Fe3+极易水解,联想大部分铁盐溶液呈黄色,则可能是Fe3+水解导致,A正确;为了观察到浅紫色,需要除去红褐色,即抑制铁离子的水解,所以可向溶液中加硝酸,B正确;也可能是[Fe(SCN)6]3-中存在电离平衡[Fe(SCN)6]3-Fe3++6SCN-,加入NaF后,平衡正向移动,导致[Fe(SCN)6]3-减少,直到颜色消失,C错误;[Fe(H2O)6]3+中加入KSCN,溶液转化为红色,说明生成了[Fe(SCN)6]3-,再向红色溶液中加入NaF,则溶液恢复无色,说明[Fe(SCN)6]3-转化为[FeF6]3-,因此H2O、SCN-、F-结合Fe3+的能力依次增强,D正确。
12.(2022·河北卷)以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6颜料。工艺流程如下:
回答下列问题:
(1)红渣的主要成分为 (填化学式),滤渣①的主要成分为 (填化学式)。
(2)黄铁矿研细的目的是 。
(3)还原工序中,不生成S单质的反应的化学方程式为 。
(4)工序①的名称为 ,所得母液循环使用。
(5)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为
,氧化工序发生反应的离子方程式为 。
(6)若用还原工序得到的滤液制备Fe2O3·xH2O和(NH4)2SO4,所加试剂为 和 (填化学式,不引入杂质)。
解析:已知黄铁矿高温煅烧生成Fe2O3,反应原理为4FeS2+11O22Fe2O3+8SO2,故产生的红渣主要成分为Fe2O3,将红渣粉碎后加入足量的50%的H2SO4溶液加热充分酸浸,反应原理为Fe2O3+3H2SO4Fe2(SO4)3+3H2O,过滤出滤渣①,主要成分为SiO2,向滤液中加入黄铁矿进行还原,将Fe3+还原为Fe2+,由(3)小问可知不生成S单质,则硫元素被氧化为S,反应原理为14Fe3++FeS2+8H2O15Fe2++2S+16H+,然后进行工序①,为蒸发浓缩、冷却结晶、过滤洗涤,得到FeSO4晶体和母液(主要含有 FeSO4 和H2SO4),加水溶解FeSO4晶体,向所得溶液中加入(NH4)2SO4、K4[Fe(CN)6]并用H2SO4调节溶液的pH为3,进行沉铁过程,反应原理为Fe2++2N+[Fe(CN)6]4-Fe(NH4)2Fe(CN)6↓,然后过滤出沉淀,洗涤后加入H2SO4和NaClO3进行氧化步骤,反应原理为6Fe(NH4)2Fe(CN)6+Cl+6H+6Fe(NH4)Fe(CN)6+3H2O+Cl-+6N,过滤、洗涤、干燥即制得 ,据此分析解题。
(1)由分析可知,红渣的主要成分为Fe2O3,滤渣①的主要成分为SiO2。
(2)黄铁矿研细的主要目的是增大固液接触面积,加快反应速率,提高黄铁矿的利用率。
(3)由分析可知,还原工序中,不产生S单质,则硫元素被氧化为S,反应原理为14Fe3++FeS2+8H2O15Fe2++2S+16H+。
(4)由分析可知,工序①的名称为蒸发浓缩、冷却结晶、过滤洗涤,所得母液主要含有FeSO4和H2SO4,可以循环利用。
(5)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为+2价,由分析可知,氧化工序所发生反应的离子方程式为6Fe(NH4)2Fe(CN)6+Cl+6H+6Fe(NH4)Fe(CN)6+3H2O+Cl-+6N。
(6)由分析可知,还原工序所得到的滤液中主要含有FeSO4和H2SO4,向滤液中先加入一定量的H2O2溶液将Fe2+完全氧化为Fe3+,再向氧化后的溶液中加入氨水至不再产生沉淀为止,过滤、洗涤,对沉淀进行灼烧,即可制得Fe2O3·xH2O和(NH4)2SO4,故所需要加入的试剂为H2O2和NH3·H2O。
答案:(1)Fe2O3 SiO2
(2)增大固液接触面积,加快反应速率,提高黄铁矿的利用率
(3))3+FeS2+8H2O15FeSO4+8H2SO4
(4)蒸发浓缩、冷却结晶、过滤洗涤
(5)+2 6Fe(NH4)2Fe(CN)6+Cl+6H+6Fe(NH4)Fe(CN)6+3H2O+
Cl-+6N
(6)H2O2 NH3·H2O
2024届高考化学一轮复习 第三章 金属及其化合物 第3讲 金属材料课件PPT: 这是一份2024届高考化学一轮复习 第三章 金属及其化合物 第3讲 金属材料课件PPT,共58页。PPT课件主要包含了2常见合金材料,答案B,答案C,2化学性质,答案D,答案A等内容,欢迎下载使用。
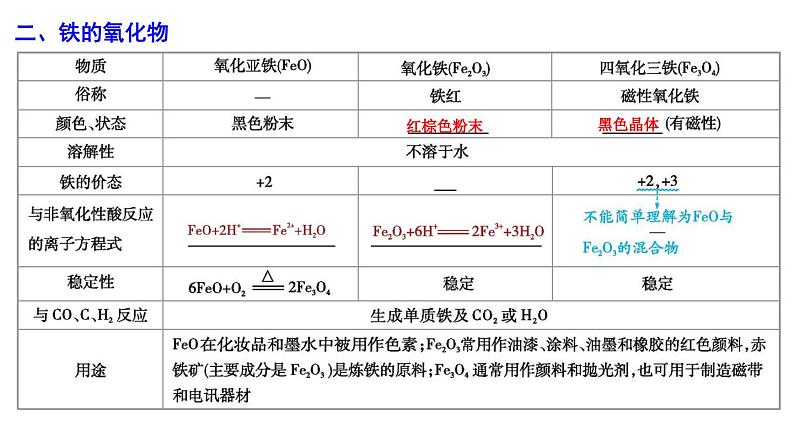
2024届高考化学一轮复习 第三章 金属及其化合物 第2讲 铁及其化合物课件PPT: 这是一份2024届高考化学一轮复习 第三章 金属及其化合物 第2讲 铁及其化合物课件PPT,共48页。PPT课件主要包含了二铁的氧化物,磁性氧化铁,红棕色,FeOH3↓,答案D,答案A,答案C等内容,欢迎下载使用。
2024届高考化学一轮复习课件 第三章 金属及金属材料 第3讲 金属材料 金属矿物的开发利用: 这是一份2024届高考化学一轮复习课件 第三章 金属及金属材料 第3讲 金属材料 金属矿物的开发利用,文件包含第3讲金属材料金属矿物的开发利用pptx、第3讲金属材料金属矿物的开发利用docx、第3讲金属材料金属矿物的开发利用课后作业docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












