











所属成套资源:备战2024年高考化学一轮复习课件(含PPT课件、课后练习含教师版及学生版)
2024届高考化学一轮复习课件 第七章 化学反应速率与化学平衡 第2讲 化学平衡
展开
这是一份2024届高考化学一轮复习课件 第七章 化学反应速率与化学平衡 第2讲 化学平衡,文件包含第2讲化学平衡docx、第2讲化学平衡pptx、第2讲化学平衡课后作业docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
第2讲 化学平衡
必备知识·整合
一、可逆反应和化学平衡状态
同一条件下
同一条件
同时
反应物
生成物
小于
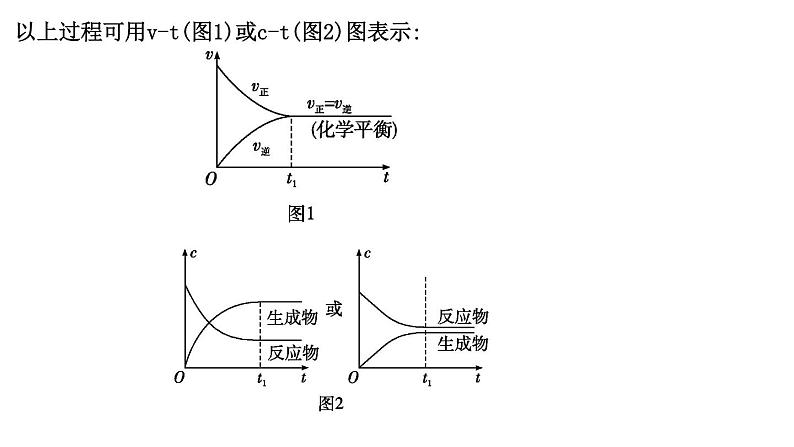
2.化学平衡状态(1)概念:在一定条件下的可逆反应中,当反应进行到一定“限度”时,正反应速率和逆反应速率 ,反应物的浓度和生成物的浓度均 的状态。
相等
保持不变
(2)建立。在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中,反应过程如下:
最大
逐渐减小
逐渐增大
=
保
持不变
以上过程可用v-t(图1)或c-t(图2)图表示:
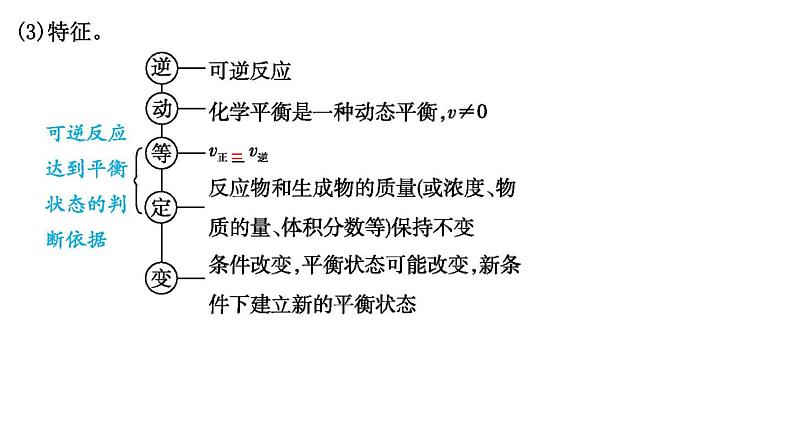
(3)特征。
=
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。
解析:(1)不是在同一条件下同时进行。(2)可逆反应到达平衡时,各组分的浓度相等。( )解析:(2)可逆反应到达平衡时,各组分的浓度保持不变但不一定相等。(3)可逆反应平衡时,生成物不再变化,反应停止了。( )解析:(3)可逆反应平衡时,v正=v逆≠0。(4)到达平衡前的v正一定大于v逆。( )解析:(4)若反应正向进行达到平衡,平衡前的v正大于v逆,若反应逆向进行达到平衡,平衡前的v逆大于v正。
×
×
×
×
二、化学平衡常数1.概念在一定温度下,当一个可逆反应达到化学平衡时,生成物 与反应物 的比值,用符号 表示。
浓度幂之积
浓度幂之积
K
3.意义及影响因素
大
大
4.应用判断可逆反应的反应方向(或化学平衡移动的方向)以及反应是否达到平衡。
正
>
逆
v逆:平衡 移动。(2)v正=v逆:反应达到平衡状态,平衡 。(3)v正c+d。(3)保持温度不变,若向该容器中充入一定量的“惰性气体”,平衡是否移动?若改为恒温恒压容器,反应达到平衡后亦向其中充入一定量的“惰性气体”,平衡是否移动?
提示:恒温、恒容条件,
恒温、恒压条件,
(4)若上述反应中B为气体时,建立平衡后,当同等倍数地加入A(g)和B(g),达到新的平衡时,A、B的转化率如何变化?若将容器改为恒温恒压呢?
提示:可通过虚拟“中间态”判断平衡移动的结果,恒温恒容新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
若a+bc+d,A、B的转化率都增大;若a+b=c+d,A、B的转化率都不变。若为恒温恒压容器,新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动,A、B的转化率都不变。
关键能力·提升
考点一 可逆反应与化学平衡的建立
可逆反应及其特征判断
解析:可逆反应的特点是不能进行彻底,FeCl3溶液和过量的碘化钠溶液反应,若仍有三价铁离子存在,则说明该反应为可逆反应,所以加入CCl4振荡后,取上层清液,滴加KSCN溶液,若溶液变红色,证明有三价铁离子存在,说明该反应为可逆反应。
1.向10 mL 0.2 mol·L-1NaI溶液中滴加4~5滴0.1 mol·L-1FeCl3溶液后,再进行下列实验,可证明FeCl3溶液和NaI溶液的反应为可逆反应的是( )A.再滴加AgNO3溶液,观察是否有AgI沉淀产生B.加入CCl4振荡后,观察下层液体颜色C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否出现红色
D
C
A.SO2为0.4 mol/L、O2为0.2 mol/LB.SO2、SO3均为0.15 mol/LC.SO3为0.25 mol/LD.SO3为0.4 mol/L
[思维建模] 极值法确定浓度范围的方法
化学平衡状态的建立和判定
ac
(2)tm时,v正 (填“大于”“小于”或“等于”)v逆。 (3)tm时,v逆 (填“大于”“小于”或“等于”)tn时v逆,理由是 。
大于
小于
tm时生成物浓度较低
[方法规律] 判断化学平衡状态的方法——“正逆相等,变量不变”(1)动态标志:v正=v逆≠0,先看“正逆”,后判相等。①同种物质:同一物质的生成(正)速率等于消耗(逆)速率。
(2)静态标志:“变量”不变,平衡出现,始终不变,不能判断。在未达到平衡时不断变化、达到平衡时不再发生变化的各种物理量(如各物质的质量、物质的量、浓度、百分含量、压强、密度或颜色等),如果不再发生变化,即达到平衡状态。
影响化学平衡的因素辨析
B
①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v正减小③压强增大一倍,平衡不移动,v正、v逆不变④增大B的浓度,v正>v逆,平衡常数K增大⑤加入催化剂,平衡时反应体系压强不发生改变A.①② B.仅⑤ C.①⑤ D.④⑤
解析:A为固体,增加A的量,化学平衡不移动,①错误;升高温度,v正、v逆都增大,由于v逆增大的倍数大于v正增大的倍数,所以化学平衡向吸热的逆反应方向移动,②错误;该反应有气体参加,是反应前后气体物质的量不等的反应,所以压强增大一倍,v正、v逆都增大,化学平衡向气体体积减小的逆反应方向移动,③错误;增大B的浓度,v正>v逆,化学平衡向正反应方向移动,但平衡常数只与温度有关,温度不变,化学平衡常数K不变,④错误;加入催化剂,能够降低反应的活化能,更多的普通分子变为活化分子,从而使v正、v逆都增大,由于v正、v逆增大的倍数相同,因此化学平衡不发生移动,气体的物质的量不变,体系的压强不变,⑤正确。
BD
5.(不定项)(2022·山东滕州一中期中)下列实验操作或现象能用平衡移动原理解释的是( )
[思维建模] 判断化学平衡移动问题的思维步骤
考点二 化学平衡常数、转化率及相关计算
1.在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
C
AC
A.当温度为T1时,该反应的化学平衡常数为0.05B.若5 min时容器Ⅰ中达到平衡,则5 min内的平均反应速率:v(H2)=0.04 mol/(L·min)C.达到平衡时,容器Ⅱ中H2O的转化率比容器Ⅰ中的小D.达到平衡时,容器Ⅲ中的CO的转化率小于66.7%
(1)能表示该反应的平衡常数K与温度T的关系的直线为 (填“x”“y”或“z”)。
答案:(1)x
(2)反应进行到20 min时,H2的转化率为 ,CO的平均反应速率v(CO)= mol/(L·min)。该温度下的平衡常数K= 。
答案:(2)75% 0.075 2.25
(3)若25 min后,保持温度不变,向该容器中再充入CH3OCH3(g)、H2O(g)各0.25 mol、CO(g) 0.5 mol,平衡将 (填“正向”“逆向”或“不”)移动。
答案:(3)正向
[思维建模] 化学平衡常数、转化率等相关计算的解题模板
微专题17 高考热点——压强平衡常数及其应用
1.Kp含义在化学平衡体系中,用各气体物质的分压代替浓度,计算得到的平衡常数叫压强平衡常数,其单位与表达式有关。2.Kp计算(1)根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度。(2)计算各气体组分的物质的量分数或体积分数。(3)根据分压计算公式求出各气体物质的分压,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)。(4)根据平衡常数计算公式代入计算。
(5)计算技巧。①在恒温恒容容器中,分压之比等于物质的量之比,因而在计算过程中,可以将气体分压理解为物质的量直接进行计算。②在恒温恒压容器中,利用分压等于总压强乘以体积分数(或物质的量分数)计算。
(1)反应a、c、e中,属于吸热反应的有 (填字母)。
(3)在图中A点对应温度下、原料组成为 n(CO2)∶n(CH4)=1∶1、初始总压为100 kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40 kPa。计算CH4的平衡转化率,写出计算过程: 。
①ΔH2 (填“>”或“p2。③若为使用催化剂引起,使用适宜催化剂时,反应达平衡所需时间短。如图丙中a使用催化剂。
(3)“峰回路转”,认识“V”形(或倒“V”形)图。明确线上点是否全为平衡点,然后分段分析:
③不是平衡点,往往涉及工业生产的条件选择,可综合考虑催化剂活性影响、副反应的干扰或影响等。
“定一议二”原则:如图甲,通过分析相同压强下,不同温度时反应物A的转化率大小来判断平衡移动的方向,从而确定该化学反应的热效应,即ΔHq。
4.综合融通,综合思维解决复杂图像在工业生产过程中,如何提升原料利用率、优化化学反应条件、提高产物的产率等是化学工作者研究的重要课题。命题者可以根据实际工业生产,结合图像,从分析投料比、转化率、产率等角度来命题,因此是现代高考及平时模拟考试的常驻题型。解读此类图像需综合利用以上技巧,分析“面—线—点”并结合题设情境进行解答。
(1)用各物质的平衡分压表示总反应的平衡常数,表达式Kp= 。 (2)图中对应等压过程的曲线是 ,判断的理由是 。 (3)当x(CH3OH)=0.10时,CO2的平衡转化率α= ,反应条件可能为 或 。
(1)在其他条件不变的情况下,考查温度对该反应(2 L恒容密闭容器内)的影响,实验结果如图所示(注:T1、T2均大于300 ℃)。
下列说法正确的有哪些?
(2)在一定温度和催化剂条件下,将1 mol CO2和3 mol H2通入2 L密闭容器中进行反应(此时容器内总压强为200 kPa),H2的分压随时间的变化曲线如图所示。
①若保持容器容积不变,t1 min时反应达到平衡。0~t1 min内,用CH3OH的浓度变化表示的平均反应速率v(CH3OH)= mol/(L·min)(用含t1的代数式表示);此时反应的平衡常数 Kp= kPa-2(Kp为以分压表示的平衡常数,列出计算式即可)。
(2)在一定温度和催化剂条件下,将1 mol CO2和3 mol H2通入2 L密闭容器中进行反应(此时容器内总压强为200 kPa),H2的分压随时间的变化曲线如图所示。
②t2 min时将容器容积迅速扩大至4 L并保持不变,图中能正确表示扩大容积后H2分压变化趋势的曲线是a、b、c、d中的哪条?理由是什么?
(3)若往此2 L恒容密闭容器中充入1.2 mol CO2和3.6 mol H2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制图像:
①催化剂效果最佳的反应是哪组?提示:①反应Ⅰ②T3的b点v(正)、v(逆)关系如何?提示:②v(正)>v(逆) ③T4的a点转化率比T5的c点转化率高的原因是什么?提示:③该反应为放热反应,温度升高,平衡逆向移动 ④在温度为T5时,试求算该反应的平衡常数K。
[思维建模] 平衡图像题解题流程
1.(2022·黑龙江哈尔滨六中月考)根据如图有关图像,下列说法正确的是( )
B
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH1B.图乙中,A线表示逆反应的平衡常数C.温度为T1、w=2时,Cl2的转化率为50%D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将增大
D
下列说法错误的是( )A.该反应的ΔH>0B.由图可知,1 100 ℃时Al2O3几乎失去催化活性C.不加催化剂时,温度越高,反应速率越快,达到平衡的时间越短D.A点达到平衡时,若此时气体总压强为p,则平衡常数Kp=0.25p
高考真题·导向
BC
A.ΔH>0B.气体的总物质的量:na12D.反应速率:va正
相关课件
这是一份2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第6讲 工业生产中的化学平衡图像分析课件PPT,共60页。PPT课件主要包含了灵活运用解题技巧,答案B等内容,欢迎下载使用。
这是一份2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第5讲 化学平衡移动 化学反应的方向课件PPT,共51页。PPT课件主要包含了2vt图像解释,逆反应,正反应,答案①③④,答案C,答案D等内容,欢迎下载使用。
这是一份2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第3讲 化学平衡状态 化学平衡常数课件PPT,共46页。PPT课件主要包含了同一条件,反应物,生成物,3特征,答案B,K1·K2,3意义及影响因素,答案D等内容,欢迎下载使用。








