








所属成套资源:备战2024年高考化学一轮复习课件(含PPT课件、课后练习含教师版及学生版)
2024届高考化学一轮复习课件 第七章 化学反应速率与化学平衡 热点强化练8 化学平衡常数综合训练
展开
这是一份2024届高考化学一轮复习课件 第七章 化学反应速率与化学平衡 热点强化练8 化学平衡常数综合训练,文件包含热点强化练8化学平衡常数综合训练pptx、热点强化练8化学平衡常数综合训练docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
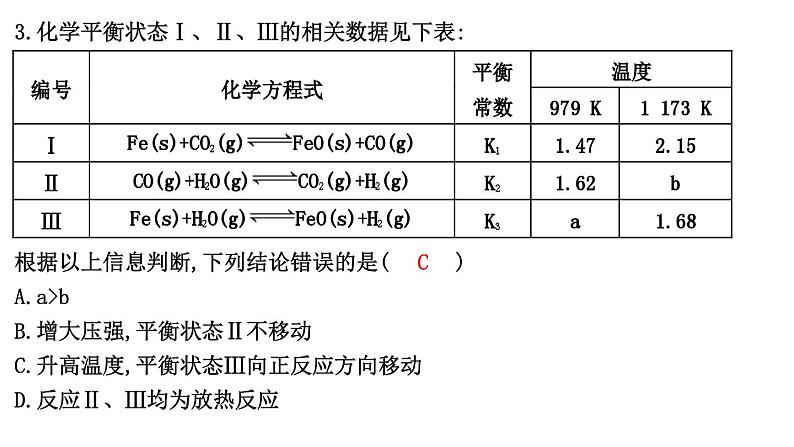
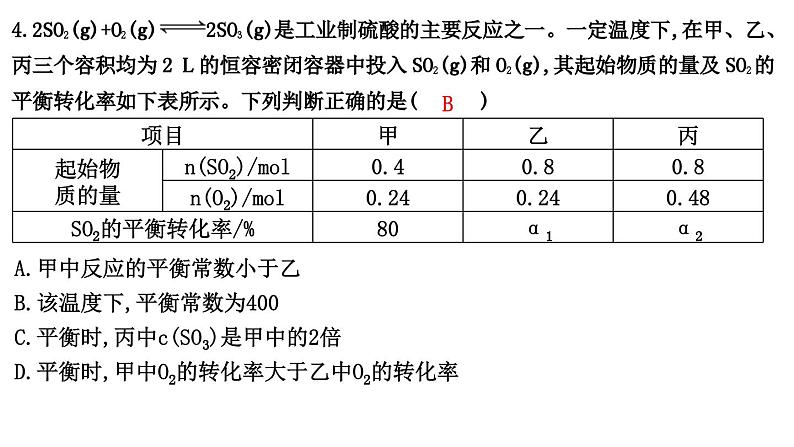
热点强化练8 化学平衡常数综合训练1.(2022·山东济南模拟)反应:Fe(s)+CO2(g)FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是( C )A.升高温度,该反应的正反应速率增大,逆反应速率减小B.该反应的化学平衡常数表达式为K=C.该反应的正反应是吸热反应D.增大CO2浓度,平衡常数增大解析:升高温度,正、逆反应速率均增大,A项错误;固体物质浓度视为常数,不列入平衡常数的表达式,该反应的化学平衡常数表达式为K=,B项错误;温度升高,K增大,则该反应的正反应为吸热反应,C项正确;平衡常数只与温度有关,故增大反应物浓度,平衡常数不变,D项错误。2.(2022·河北保定模拟)将2 mol CH4(g)和5 mol H2O(g)通入一密闭容器中,发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。CH4(g)的平衡转化率与温度、压强的关系如图所示,下列有关平衡常数的判断正确的是( B )A.KA>KB=KC>KD B.KA<KB=KC<KDC.KA=KB>KC=KD D.KA=KB<KC=KD解析:由图可知B、C点温度相同,则平衡常数相同,即KB=KC,压强为p1时,A点到C点随着温度升高,CH4的平衡转化率增大,则说明平衡正向移动,平衡常数也增大,所以KA<KC,同理压强为p2时,B点到D点随着温度升高,CH4的平衡转化率增大,则说明平衡正向移动,平衡常数也增大,所以KB<KD,则平衡常数的大小关系为KA<KB=KC<KD。3.化学平衡状态Ⅰ、Ⅱ、Ⅲ的相关数据见下表:编号化学方程式平衡常数温度979 K1 173 KⅠFe(s)+CO2(g)FeO(s)+CO(g)K11.472.15ⅡCO(g)+H2O(g)CO2(g)+H2(g)K21.62bⅢFe(s)+H2O(g)FeO(s)+H2(g)K3a1.68根据以上信息判断,下列结论错误的是( C )A.a>bB.增大压强,平衡状态Ⅱ不移动C.升高温度,平衡状态Ⅲ向正反应方向移动D.反应Ⅱ、Ⅲ均为放热反应解析:由Ⅰ+Ⅱ=Ⅲ,得K3=K1·K2,则a=1.47×1.62≈2.4,b=1.68÷2.15≈0.78,a>b,A项正确;Ⅱ反应前后气体体积不变,增大压强,平衡不移动,B项正确;由A项分析可知,随温度升高,K2、K3均减小,故反应Ⅱ、Ⅲ均为放热反应,D项正确;升温时,平衡状态Ⅲ向逆反应方向移动,C项错误。4.2SO2(g)+O2(g)2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是( B )项目甲乙丙起始物质的量n(SO2)/mol0.40.80.8n(O2)/mol0.240.240.48SO2的平衡转化率/%80α1α2A.甲中反应的平衡常数小于乙B.该温度下,平衡常数为400C.平衡时,丙中c(SO3)是甲中的2倍D.平衡时,甲中O2的转化率大于乙中O2的转化率解析:温度相同时,该反应的平衡常数不变,则甲、乙中反应的平衡常数相等,A错误;根据题意列三段式 2SO2(g)+O2(g)2SO3(g)开始/mol 0.4 0.24 0转化/mol 0.32 0.16 0.32平衡/mol 0.08 0.08 0.32则SO2、O2、SO3的平衡浓度分别为0.04 mol/L、0.04 mol/L、0.16 mol/L,所以该温度下,平衡常数为=400,B正确;容器容积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,即丙中c(SO3)大于甲中 c(SO3)的2倍,C错误;由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,则乙中O2的转化率大于甲中O2的转化率,D错误。5.(2022·北大附中三模)某同学设计实验方案,利用沉淀滴定法测定“Ag++Fe2+Fe3++Ag↓”的平衡常数K。一定温度下,先将0.010 0 mol·L-1 Ag2SO4溶液与0.040 0 mol·L-1 FeSO4溶液(pH=1)等体积混合,待反应达到平衡时,过滤,取V mL滤液用c1 mol·L-1KSCN标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液V1 mL。已知:Ag++SCN-AgSCN↓(白色) K1Fe3++SCN-[Fe(SCN)]2+(红色) K2下列说法正确的是( B )A.Ag2SO4溶液和FeSO4溶液(pH=1)可替换为AgNO3溶液和Fe(NO3)2溶液(pH=1)B.K1≫K2,Fe3+是滴定终点的指示剂C.若不过滤,直接用浊液做滴定实验测定 c(Ag+),则所测K偏大D.若改为测定滤液中c(Fe3+),选择合适的滴定方法直接滴定滤液,也能达到目的解析:由于硝酸根离子在酸性环境下具有强氧化性,能将亚铁离子氧化为铁离子,会干扰实验,故不可用AgNO3溶液和Fe(NO3)2溶液(pH=1)替换原试剂,A错误;用KSCN标准溶液滴定Ag+,至出现稳定的浅红色时实验达到终点,说明SCN-先与Ag+反应完全后再与Fe3+反应,故K1≫K2,出现稳定的浅红色时实验达到终点,说明Fe3+是滴定终点的指示剂,B正确;若不过滤,直接用浊液做滴定实验测定c(Ag+),滴入KSCN溶液时发生反应Ag++SCN-AgSCN↓,使Ag++Fe2+Fe3++Ag↓逆向移动,银离子浓度增大,K=,K偏小,C错误;若改为测定滤液中c(Fe3+),Fe2+容易被空气中的氧气氧化为Fe3+,滴定结果不准确,D错误。6.(不定项)T ℃时,向容积为2 L的刚性容器中充入1 mol CO2和一定量的H2发生反应:CO2(g)+2H2(g)HCHO(g)+H2O(g),达到平衡时,HCHO的分压(分压=总压×物质的量分数)与起始的关系如图所示。已知:初始加入2 mol H2时,容器内气体的总压强为1.2p kPa。下列说法错误的是( BD )A.5 min时反应到达c点,v(H2)=0.1 mol·L-1·min-1B.随增大,HCHO的平衡压强不断增大C.b点时反应的平衡常数Kp= kPa-1D.c点时,再加入CO2(g)和H2O(g),使两者分压均增大0.2p kPa,平衡正向移动解析:根据c点的三段式分析 CO2(g)+2H2(g)HCHO(g)+H2O(g)开始/mol 1 2 0 0变化/mol x 2x x x平衡/mol 1-x 2-2x x x则平衡时容器内气体的总压强为p(平衡)=×1.2p kPa,故有p(HCHO)=×p(平衡)=××1.2p kPa=0.2p kPa,解得x=0.5,故p(平衡)=p kPa,据此分析解题。A.起始时容器内气体的总压强为1.2p kPa,若5 min时反应到达c点,由分析可知,v(H2)==0.1 mol·L-1·min-1,正确;B.随增大,平衡正向移动,CO2的转化率增大,若H2的物质的量无限制增大,则HCHO的平衡压强肯定减小,即HCHO的平衡压强不是不断增大,错误;C.温度不变,化学平衡常数不变,故b点时反应的平衡常数与c点对应的平衡常数相等,由分析可知,c点平衡下,p(CO2)=×p kPa=0.2p kPa,同理 p(H2)=0.4p kPa,p(HCHO)=p(H2O)=0.2p kPa,故Kp==kPa-1= kPa-1= kPa-1,正确;D.c点时,再加入CO2(g)和H2O(g),使两者分压均增大0.2p kPa,则此时Qp== kPa-1= kPa-1=Kp,平衡不移动,错误。7.向甲、乙、丙三个容积均为0.5 L的密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图所示:容器甲乙丙温度/℃T1T2T2反应物起始量1.5 mol A0.5 mol B1.5 mol A0.5 mol B3.0 mol A1.0 mol B下列说法正确的是( B )A.10 min内甲容器中反应的平均速率v(A)=0.1 mol/(L·min)B.x=1C.由图可知:T1<T2,且该反应为吸热反应D.T1 ℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%解析:由图可知,10 min内甲容器中C的浓度变化量为1 mol/L,v(C)==0.1 mol/(L·min),速率之比等于化学计量数之比,所以v(A)=v(C)=0.05 mol/(L·min),A错误;乙与丙容器内反应温度相同,丙容器内起始反应物浓度为乙容器的两倍,由图可知,达到平衡时,丙容器内C的浓度为乙容器内C的浓度的两倍,说明增加压强的情况下平衡不移动,由此可知x=1,B正确;甲与乙容器内起始反应物浓度相同,温度不同,由图可知,乙容器内先达到平衡状态,说明乙容器内温度高于甲容器,即T2>T1,升高温度时,C的平衡浓度减小,说明平衡逆向移动,正反应为放热反应,C错误;T1℃时,甲容器内 A(g)+B(g)2C(g)起始/(mol/L) 3 1 0转化/(mol/L) 0.75 0.75 1.5平衡/(mol/L) 2.25 0.25 1.5该温度下反应的平衡常数K==4,令T1 ℃,起始时甲容器中充入0.5 mol A、1.5 mol B,反应到达平衡时A的浓度变化量为x mol/L,则 A(g)+B(g)2C(g)起始/(mol/L) 1 3 0转化/(mol/L) x x 2x平衡/(mol/L) 1-x 3-x 2xK==4,解得x=0.75,因此A的转化率为×100%=75%,D错误。8.在一定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:t/℃7008008301 0001 200K0.60.91.01.72.6回答下列问题。(1)该反应的化学平衡常数表达式为 K= 。 (2)该反应的正反应为 (填“吸热”或“放热”)反应。 (3)某温度下,各物质的平衡浓度符合关系式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 。 (4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K (填“大于”“小于”或“等于”)1.0。 (5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的容积,平衡 (填“向正反应方向”“向逆反应方向”或“不”)移动。 (6)若1 200 ℃时,在某时刻反应体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应 (填“向正反应方向进行”“向逆反应方向进行”或“处于平衡状态”)。 解析:(1)根据化学方程式CO2(g)+H2(g)CO(g)+H2O(g)可知,该反应的平衡常数表达式为K=。(2)根据题干中的表格可知,随着温度的升高,平衡常数逐渐增大,说明该反应的正反应为吸热反应。(3)某温度下,各物质的平衡浓度符合关系式3c(CO2)·c(H2)=5c(CO)·c(H2O),根据平衡常数表达式K=可知,K==0.6,平衡常数只与温度有关,温度一定,平衡常数为定值,所以此时对应的温度为700 ℃。(4)化学平衡常数只与温度有关,与反应物和生成物的浓度无关,所以只要在830 ℃条件下,该反应平衡常数的数值都为1.0。(5)830 ℃时达到平衡,扩大容器容积的瞬间,反应物和生成物的浓度都减小相同的倍数,根据平衡常数表达式K=可知,反应物和生成物同时改变相同的倍数,Q=K,平衡不移动。(6)1 200 ℃时,Q=,将各物质的浓度代入可得Q=4,而此温度下的平衡常数为 2.6,即Q>K,所以该反应向逆反应方向进行。答案:(1) (2)吸热 (3)700 ℃(4)等于 (5)不 (6)向逆反应方向进行
相关课件
这是一份2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第3讲 化学平衡状态 化学平衡常数课件PPT,共46页。PPT课件主要包含了同一条件,反应物,生成物,3特征,答案B,K1·K2,3意义及影响因素,答案D等内容,欢迎下载使用。
这是一份2024版新教材高考化学全程一轮总复习第七章化学反应速率与化学平衡第24讲化学平衡常数化学反应的方向课件,共60页。PPT课件主要包含了化学平衡,浓度幂之积,答案D,答案A,56×105,答案C,答案B,反应Ⅰ,无需借助外力,混乱程度等内容,欢迎下载使用。
这是一份2024年高考化学一轮复习(新高考版) 第8章 热点强化19 化学反应速率和化学平衡简答题,文件包含2024年高考化学一轮复习新高考版第8章热点强化19化学反应速率和化学平衡简答题pptx、2024年高考化学一轮复习新高考版第8章热点强化19化学反应速率和化学平衡简答题docx、第8章热点强化19化学反应速率和化学平衡简答题docx等3份课件配套教学资源,其中PPT共35页, 欢迎下载使用。









