



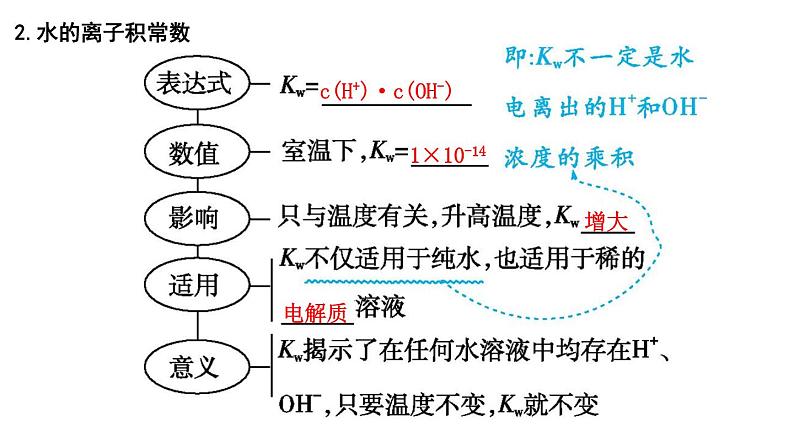
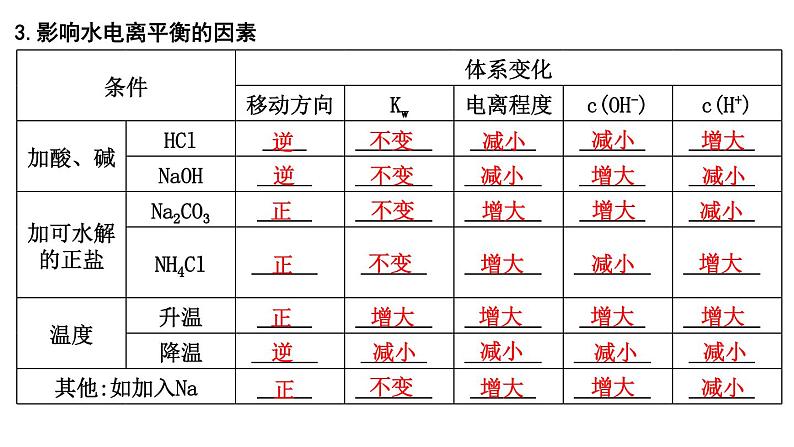








2024届高考化学一轮复习课件 第八章 水溶液中的离子反应与平衡 第2讲 水的电离和溶液的pH
展开第2讲 水的电离和溶液的pH
(40分钟)
选题表
知识点 | 题号 | ||
基础 | 能力 | 创新 | |
水的电离、Kw | 4(1) |
| 11 |
溶液的酸碱性和pH | 1,2,4 | 5,8 |
|
酸碱中和滴定及其拓展应用 | 3 | 6,7,9,10 | 12 |
1.常温下,0.1 mol·L-1某一元酸(HA)溶液中=1×10-8,下列叙述正确的是( B )
A.该一元酸溶液的pH=1
B.该溶液中由水电离出来的c(H+)=1×10-11mol·L-1
C.该溶液中水的离子积常数为1×10-22
D.用pH=11的NaOH溶液V1L和V2L 0.1 mol·L-1该一元酸(HA)溶液
混合,若混合溶液的pH=7,则V1<V2
解析:将c(OH-)=代入原题关系式中可得=1×10-8,解得c(H+)=1×10-3mol·L-1,所以该溶液的pH=3,A项错误;该溶液中水电离出来的c(H+)=c(OH-)= mol·L-1=1×10-11mol·L-1,B项正确;
常温下,水的离子积是一个常数,为1×10-14,C项错误;由题干推知,
0.1 mol·L-1的酸pH=3,若等体积混合,溶液显酸性,欲使混合溶液的pH=7,则V1>V2,D项错误。
2.常温下,下列叙述不正确的是( D )
A.c(H+)>c(OH-)的溶液一定显酸性
B.pH=3的弱酸溶液与pH=11的强碱溶液等体积混合后溶液呈酸性
C.pH=5的硫酸溶液稀释到原来的500倍,稀释后c(S)与c(H+)之比约为1∶10
D.中和10 mL 0.1 mol·L-1醋酸与100 mL 0.01 mol·L-1醋酸所需NaOH的物质的量不同
解析:pH=3的弱酸溶液与pH=11的强碱溶液等体积混合,弱酸浓度大,有大量剩余,反应后溶液呈酸性,B正确;pH=5的硫酸溶液稀释到原来的500倍,则溶液接近于中性,c(H+)约为 10-7mol·L-1,
c(S)= mol·L-1=10-8mol·L-1,则c(S)∶c(H+)=1∶10,
C正确;两份醋酸的物质的量相同,则所需NaOH的物质的量相同,
D不正确。
3.用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1盐酸过程中的pH变化如图所示。下列说法错误的是( D )
A.b点时,加入极少量NaOH溶液都会引起pH的突变
B.选指示剂时,其变色范围应在4.30~9.70之间
C.若将盐酸换成同浓度的CH3COOH溶液,曲线ab段将会上移
D.都使用酚酞作指示剂,若将NaOH溶液换成同浓度的氨水,所消耗氨水的体积较NaOH溶液小
解析:题图中反应终点的pH在4.30~9.70之间,选择指示剂的变色范围应在反应终点的pH范围内,B正确;滴定终点时醋酸钠溶液水解显碱性,曲线ab段将会上移,C正确;使用酚酞作指示剂,用同浓度氨水代替NaOH溶液,要使溶液由无色变为浅红色,则消耗氨水的体积大于NaOH溶液,D错误。
4.已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:
(1)95 ℃时,水的电离平衡曲线应为B,请说明理由: 。25 ℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为 。
(2)95 ℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是 。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1 (填“大于”“小于”“等于”或“无法确定”)α2。
(4)曲线B对应温度下,将0.02 mol·L-1Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,混合溶液的pH= 。
解析:(1)25 ℃时,pH=9的NaOH溶液中,c(OH-)=10-5mol·L-1,pH=4的H2SO4溶液中,c(H+)=10-4mol·L-1,若所得混合溶液的pH=7,n(OH-)=n(H+),
则c(OH-)·V(NaOH)=c(H+)·V(H2SO4),故V(NaOH)∶V(H2SO4)=c(H+)∶c(OH-)=10∶1。
(2)95 ℃时,水的离子积常数Kw=10-12,100体积pH=a的某强酸溶液中n(H+)=100×10-amol=102-amol,1体积pH=b的某强碱溶液中 n(OH-)=
mol=10b-12mol,混合后溶液呈中性,则n(H+)=n(OH-)=102-amol=
10b-12mol,即2-a=b-12,所以a+b=14。
(3)曲线A所对应的温度是25 ℃即室温,在室温下,pH=2的HCl溶液中,c(H+)水=10-12mol·L-1,pH=11的某BOH溶液中,c(H+)水=10-11mol·L-1,水电离产生的H+的浓度越大,水的电离程度就越大,用α1、α2表示,则 α1<α2。
(4)曲线B所对应的温度是95 ℃,该温度下水的离子积常数Kw=10-12,在曲线B所对应的温度下,将0.02 mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,则反应后溶液中c(OH-)==
0.01 mol·L-1,由于该温度下水的离子积常数Kw=10-12,所以c(H+)=
10-10mol·L-1,所得混合液的pH=10。
答案:(1)水的电离是吸热过程,温度高时,电离程度大,c(H+)、c(OH-)均增大 10∶1 (2)a+b=14 (3)小于 (4)10
5.(2022·上海金山二模)常温下,等体积等浓度的盐酸与下列溶液分别恰好完全中和。
①V1 mL pH=9的氨水;②V2 mL pH=10的氨水
下列判断正确的是( D )
A.10V2>V1
B.的比值:②>①
C.水的电离程度:②>①
D.反应后溶液的pH:①>②
解析:设pH=9的氨水的浓度为c1,电离程度为α1,则c1=;设pH=10的氨水浓度为c2,电离程度为α2,则c2=;因为pH=9的氨水比pH=10的氨水电离程度大,故α1>α2,则=<,根据盐酸和氨水反应的关系之比为1∶1,得等体积、等浓度的盐酸与其恰好完全中和时,消耗的氨水的量满足V1×c1=V2×c2,即10V2<V1,故A不正确;的比值即是两溶液的电离度,根据溶液越稀电离程度越大判断,②<①,故B不正确;根据氨水溶液中水的电离受到抑制,抑制程度越大,水的电离程度越小,故②<①,故C不正确;反应后pH=9的氨水消耗的体积大,故最终溶液的体积大,但生成的氯化铵的量相同,故①中最终的氯化铵溶液的浓度较小,故水解后氢离子浓度小,pH大,故D正确。
6.(2023·云南玉溪三月模拟)常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA(电离常数为Ka)溶液,滴定曲线如图所示。下列说法不正确的是( C )
A.由图可知,c1>c2>c3
B.M点溶液中存在:2c(H+)=c(A-)-c(HA)+2c(OH-)
C.恰好中和时,三种溶液的pH相等
D.由pH=7的溶液计算得Ka=(V0是消耗的NaOH溶液的体积)
解析:A项,NaOH溶液浓度越大,溶液pH越大,根据图像,滴定终点之后溶液pH大小顺序为c1>c2>c3,所以浓度大小为c1>c2>c3,正确;B项,M点为加入NaOH溶液体积为10 mL,此时恰好生成起始时等物质的量的NaA和HA,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),存在物料守恒2c(Na+)=c(HA)+c(A-),则存在2c(H+)=2c(OH-)+c(A-)-c(HA),正确;C项,恰好中和时,溶液中酸碱恰好完全反应生成NaA,A-水解,溶液呈碱性,但三种溶液的浓度不相等,A-水解程度不一样,则溶液的pH不相等,不正确;D项,溶液中pH=7时,c(H+)=c(OH-),根据电荷守恒c(Na+)+c(H+)=
c(OH-)+c(A-),则有c(Na+)=c(A-),此时消耗NaOH溶液体积为V0,所以c(A-)=mol/L,根据物料守恒 c(A-)+c(HA)=mol/L,
则c(HA)=mol/L,所以Ka===,正确。
7.(不定项)(2023·河南商丘三模)用0.10 mol·L-1的NaOH溶液分别滴定20.00 mL浓度为c1的醋酸、c2的草酸(H2C2O4)溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列说法错误的是( D )
A.由滴定曲线可判断:c1>c2
B.滴定过程中始终有n(CH3COOH)=0.02c1+n(OH-)-n(H+)-n(Na+)
C.若a点V(NaOH)=7.95 mL,则a点有c(Na+)>c(C2)>c(HC2)>
c(H2C2O4)
D.若b点时溶液中 c(CH3COO-)=c(CH3COOH),则b点消耗了8.60 mL的NaOH溶液
解析:草酸是二元弱酸,滴定过程中有两次滴定突变;醋酸是一元酸,滴定时只有一次滴定突变,所以根据图示可知X曲线代表草酸,Y曲线代表醋酸。其中c、d为两种酸恰好完全中和的化学计量点,滴定根据恰好反应时消耗NaOH溶液的体积数值可知 c2==0.026 5 mol·L-1,
c1==0.086 0 mol·L-1,c1>c2,故A正确;
对于醋酸溶液,在滴定过程中始终存在电荷守恒n(H+)+n(Na+)=n-)+
n(CH3COO-),根据物料守恒可知n(CH3COOH)+n(CH3COO-)=0.02c1,
故n(H+)+n(Na+)=n(OH-)+0.02c1-n(CH3COOH),所以有 n(CH3COOH)=
0.02c1+n(OH-)-n(H+)-n(Na+),故B正确;完全中和时需消耗V(NaOH)=10.60 mL,若a点 V(NaOH)=7.95 mL时为NaHC2O4、Na2C2O4按1∶1形成的混合溶液,pH<7,显酸性,故HC2的电离程度大于HC2及C2的水解程度,则c(Na+)>c(C2)>c(HC2)>c(H2C2O4),故C正确;若b点时加入氢氧化钠溶液体积为8.60 mL,则此时溶液中 n(CH3COOH) 和n(CH3COONa)相等,由图可知此时溶液显酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),如果要求c(CH3COO-)=c(CH3COOH),则此时加入氢氧化钠溶液的体积V<mL,即V<8.60 mL,D错误。
8.(2022·福建福州4月模拟)常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出的c(H+)与NaOH溶液的体积之间的关系如图所示。下列推断正确的是( B )
A.可用pH试纸测定E点对应溶液,其pH=3
B.G点对应溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
C.H、F点对应溶液中都存在:c(Na+)=c(Cl-)+c(ClO-)
D.常温下加水稀释H点对应溶液,溶液的pH增大
解析:由题图可知,E点为新制氯水,溶液显酸性,由水电离出的
c水(H+)=10-11mol/L,溶液中OH-完全是由水电离出来的,所以
c(OH-)=c水(H+)=10-11mol/L,则溶液中c(H+)==10-3mol/L,则溶液pH=3,但新制氯水有漂白性,不能用pH试纸测量其pH,应该用pH计,
A错误;G点,氯水与氢氧化钠溶液恰好完全反应生成等物质的量的NaCl、NaClO,ClO-水解使溶液呈弱碱性,所以有 c(Na+)>c(Cl-)>
c(ClO-)>c(OH-)>c(H+),B正确;H点对应溶液中溶质为NaCl、NaClO和NaOH,根据电荷守恒可知 c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(ClO-),此时溶液为碱性,则c(OH-)>c(H+),所以 c(Na+)>c(Cl-)+c(ClO-),C错误;加水稀释H点对应的溶液,H点为碱性溶液,加水稀释时促使溶液的碱性减弱,所以pH降低,D错误。
9.(不定项)(2022·山东烟台二中摸底联考)酒石酸(,
用H2R表示)可作食品抗氧化剂,是一种二元弱酸。25 ℃时,Ka1=10-3.04,向10 mL 0.01 mol·L-1的酒石酸溶液中滴加0.01 mol·L-1的氢氧化钠溶液,溶液中-lg与所加氢氧化钠溶液的体积关系如图所示。下列说法正确的是( AB )
A.n点溶液呈中性
B.p点溶液中存在c(OH-)=c(HR-)+2c(H2R)+c(H+)
C.n点到p点过程中水的电离程度变小
D.NaHR溶液中HR-的电离平衡常数小于其水解平衡常数
解析:n点时-lg=0,则c(OH-)=c(H+),此溶液呈中性,A项正确;
p点时加入0.01 mol·L-1的氢氧化钠溶液体积为20 mL,
与10 mL 0.01 mol·L-1的酒石酸恰好完全反应,得到Na2R溶液,根据此时溶液的电荷守恒2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+)及物料守恒c(Na+)=2c(HR-)+2c(H2R)+2c(R2-)关系,可得c(OH-)=c(HR-)+2c(H2R)+
c(H+),B项正确;n点溶液呈中性说明此时溶液中HR-电离与HR-及R2-水解恰好相等,继续滴加氢氧化钠溶液,HR-减少,R2-增多,水的电离程度应变大,C项错误;当加入0.01 mol·L-1的氢氧化钠溶液体积为
10 mL时,溶液中溶质为NaHR,m点时-lg >0,即c(OH-)<c(H+),溶液呈酸性,说明此时溶液中HR-的电离程度大于其水解程度,即HR-的电离平衡常数大于其水解平衡常数,D项错误。
10.(2022·山东东营广饶一中月考)测定溶液中甘油浓度通常采用高碘酸氧化还原法,实验步骤如下:
ⅰ.配制准确浓度的硫代硫酸钠(Na2S2O3)溶液
①称取16 g Na2S2O3,溶于1 000 mL水中,冷却,备用。
②称取0.147 g重铬酸钾(K2Cr2O7),置于碘量瓶中,溶于25 mL水,加
2 g碘化钾及20 mL 4 mol·L-1 的硫酸,摇匀。于暗处放置10分钟。
加75 mL水,用硫代硫酸钠溶液滴定(I2+2S22I-+S4),近终点时加1 mL 0.5%指示剂,继续滴定至溶液由蓝色变为亮绿色。再重复滴定2次,平均用硫代硫酸钠溶液30 mL。
ⅱ.甘油含量测定
①准确量取10 mL甘油溶液,放入250 mL碘量瓶中,再加入20 mL
0.04 mol·L-1KIO4溶液、10 mL 0.6 mol·L-1H2SO4溶液、5 mL正己烷,盖好塞盖,摇匀,在室温下于暗处放置30 min。
②加入1.5 g KI反应3 min后,再加水75 mL,剩余的I和反应生成的I被还原析出碘,析出的碘用配制好的Na2S2O3标准液滴定,滴定至颜色变亮时加入1 mL指示剂,此时溶液呈现不透明深蓝色,继续滴至蓝色恰好消失为止。
③再重复滴定 2次,平均用Na2S2O3溶液V mL。
回答下列问题。
(1)步骤ⅰ①的实验操作是否正确? (填“正确”或“错误”)。
(2)步骤ⅰ②的目的是 ,
所用的指示剂是 ,Na2S2O3溶液浓度是 。
(3)甘油(C3H8O3)溶液与KIO4溶液反应生成甲醛、甲酸、KIO3,写出步骤ⅱ①反应的离子方程式:
。
步骤ⅱ②中高碘酸与KI反应的离子方程式为 。
(4)下列因素引起步骤ⅱ中测定结果偏高的是 (填字母)。
a.将碘量瓶换成普通锥形瓶
b.加入的KI过量
c.KIO4溶液浓度偏小
d.指示剂一褪色就停止滴定、读数
e.滴定前正视读数,滴定后仰视读数
解析:(1)此操作不是配制一定物质的量浓度的溶液,而是配成Na2S2O3溶液,然后用标准液K2Cr2O7溶液进行标定其浓度,故步骤ⅰ①的实验操作正确。
(2)由实验步骤可知,步骤ⅰ②的目的是用标准液K2Cr2O7进行标定Na2S2O3溶液的浓度,利用I2能使淀粉溶液变蓝的特性,故所用的指示剂是淀粉溶液,根据得失电子总数相等可得关系式K2Cr2O7~3I2~6Na2S2O3,
故n(Na2S2O3)=6n(K2Cr2O7),即c(Na2S2O3)×30×10-3L=6×,
解得Na2S2O3溶液浓度是 0.1 mol·L-1。
(4)根据滴定原理可知,整个过程中1 mol甘油失去4 mol电子,
1 mol I-失去1 mol电子,1 mol I得到7 mol电子,故根据得失电子守恒可知4n(甘油)+n(I-)=7n(I),根据I原子守恒有n(I2)=
[n(I)+n(I-)],滴定时又有n(I2)=n(S2)。将碘量瓶换成普通锥形瓶,将导致I2升华,从而使得消耗Na2S2O3的量偏小,即n(I-)偏小,则甘油的量偏大,a符合题意;由于实验中本身KI就是过量的,故KI过量对实验结果无影响,b不符合题意;KIO4溶液浓度偏小,将导致生成的I2的量偏小,导致消耗Na2S2O3的量偏小,即n(I-)偏小,则甘油的量偏大,c符合题意;指示剂一褪色就停止滴定、读数,将导致消耗Na2S2O3的量偏小,即n(I-)偏小,则甘油的量偏大,d符合题意;滴定前正视读数,滴定后仰视读数,将导致消耗Na2S2O3的量偏大,即n(I-)偏大,则甘油的量偏小,e不符合题意。
答案:(1)正确
(2)标定Na2S2O3溶液的浓度 淀粉溶液 0.1 mol·L-1 (3)C3H8O3+2I2HCHO+HCOOH+2I+H2O I+7I-+8H+4I2+4H2O (4)acd
11.(不定项)常温下,向20 mL浓度均为0.1 mol·L-1的HX和CH3COOH的混合溶液中滴加0.1 mol·L-1的氨水,测得溶液的电阻率(溶液的电阻率越大,导电能力越弱)与加入氨水的体积(V)的关系如图所示。(CH3COOH的Ka=1.8×10-5,NH3·H2O的 Kb=1.8×10-5),下列说法正确的是( D )
A.常温时,同浓度的HX溶液比CH3COOH溶液的pH大
B.a→c过程,水的电离程度先减小后增大
C.溶液pH=7时对应的点在c点和d点之间,此时溶液中存在:=
D.混合时若忽略体积变化,d点时:4c(N)+4c(NH3·H2O)=0.3 mol·L-1
解析:常温下Kw=10-14,若HX和CH3COOH都是弱酸,则随着NH3·H2O的加入,酸碱反应生成盐,溶液导电性将增强、电阻率将减小,但图像上随着NH3·H2O的加入,溶液电阻率增大、导电性减弱,说明原混合溶液中离子浓度更大,即HX为强电解质,常温下0.1 mol·L-1HX的pH比同浓度CH3COOH的pH小,故A项错误;酸或碱都抑制水的电离,滴加NH3·H2O溶液的过程a到c为HX和CH3COOH反应转化为NH4X、CH3COONH4的过程,溶液的酸性减弱,水的电离程度增大,故B项错误;根据分析,c点溶液中溶质为NH4X、CH3COONH4,且两者的物质的量相等,其中铵根离子和醋酸根离子均发生水解N+H2ONH3·H2O+H+、CH3COO-+H2OCH3COOH+OH-,且铵根离子浓度大于醋酸根离子,故溶液为酸性即 c(H+)>c(OH-),故溶液pH=7时对应的点在 c点和d点之间,此时,存在c(H+)=c(OH-),根据质子守恒c(H+)+c(CH3COOH)=c(OH-)+c(NH3·H2O),则有c(CH3COOH)=c(NH3·H2O),故=1,又因为 Ka=Kb,所以=1+≠1,故C项错误;d点溶液中共加入0.1 mol·L-1的氨水 60 mL,d点时,溶液体积共为80 mL,根据物料守恒4c(NH3·H2O)+
4c(N)=4×=0.3 mol·L-1,故D正确。
12.维生素C(简写为Vc)的分子式为C6H8O6,溶于水后显酸性,在高温或碱性条件下极易被氧化。许多新鲜水果和蔬菜中含有丰富的Vc,新鲜橙汁中Vc含量约500 mg/L。某化学活动小组欲用滴定法测定某品牌软包装橙汁中Vc的含量,请帮助完成实验报告。
(1)实验目的: 。
(2)实验原理:酸性条件下,C6H8O6可被I2氧化为C6H6O6。写出该反应的化学方程式:
。
(3)实验用品:2.00×10-3mol/L I2标准溶液、2 mol/L醋酸、蒸馏水、指示剂、仪器(略)。其中指示剂应选用 。
(4)实验步骤:
①检查仪器:检查酸式滴定管 。
②洗涤仪器:所有仪器用蒸馏水洗净后,还需用待装溶液润洗的仪器是 。
③装液:向两支酸式滴定管中分别加入I2标准溶液和橙汁,使液面位于滴定管 处。按要求调整好液面,读出读数。
④取橙汁:从滴定管放出10.00 mL橙汁于锥形瓶中,加入10 mL
2 mol/L醋酸和数滴指示剂。
⑤滴定:用I2标准溶液滴定至 即为终点。平行滴定3次。
(5)数据记录与处理:
①完成实验数据记录表格(能够写出的数据必须给出)
滴定 次数 | 待测橙汁 体积/mL | I2标准溶液 | ||
|
|
| ||
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
平均值 |
|
|
|
|
②数据处理后,滴定时消耗I2标准溶液的体积平均值为10.00 mL。
则待测橙汁中Vc的含量为 mg/L。
(6)讨论
①从测定结果来看,此软包装橙汁 (填“可能是”“一定是”或“不是”)纯天然橙汁。
②制造商生产该橙汁时,可能采用的做法是 (填字母)。
A.将天然橙汁浓缩
B.向天然橙汁中添加Vc
C.加水稀释天然橙汁
D.用水和其他原料混合制作
解析:(2)酸性条件下,C6H8O6可被I2氧化为O6,由此写出该反应的化学方程式。(3)由碘单质反应为碘离子,故可用淀粉溶液作指示剂。(4)酸式滴定管使用前要检查是否漏水;盛装待装溶液时为保证浓度准确,还需用待装溶液润洗;为了便于读数,需要把液面调至“0”或一个整数值,故需要让液面在刻度线“0”以上2~3 mL处,再按要求调整好液面,读出读数;⑤酸性条件下,+I2C6H6O6+2HI,用淀粉溶液作指示剂,用I2标准溶液滴定至溶液呈蓝色即Vc全部反应,即为终点。(5)①需要测定滴定前后I2标准溶液消耗的体积,故需要分别记录滴定前读数/mL、滴定后读数/mL、消耗体积/mL;为了减小实验误差,可以用酸式滴定管取等体积的橙汁 10.00 mL,平均值也为10.00 mL;②由C6H8O6+I2C6H6O6+2HI得n(Vc)=n(I2)=10.00 mL×10-3L/mL×
2.00×10-3mol/L=2×10-5mol,则待测橙汁中Vc的含量为=3.52×102mg/L。
答案:(1)测定某品牌软包装橙汁中Vc含量
(2)C6H8O6+I2C6H6O6+2HI
(3)淀粉溶液
(4)①是否漏水 ②酸式滴定管 ③刻度线“0”以上2~3 mL ⑤溶液呈蓝色
(5)①滴定前读数/mL 滴定后读数/mL 消耗体积/mL 10.00 10.00 10.00 10.00 ②3.52×102
(6)①可能是 ②CD
新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第24讲水的电离和溶液的pH课件: 这是一份新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第24讲水的电离和溶液的pH课件,共60页。PPT课件主要包含了考点一,考点二,考点三,考点一水的电离,必备知识·梳理夯实,×10-14,电解质,OH-,归纳拓展,cH+等内容,欢迎下载使用。
2024年高考化学一轮总复习 第7单元 第2讲 水的电离和溶液的pH 课件: 这是一份2024年高考化学一轮总复习 第7单元 第2讲 水的电离和溶液的pH 课件,共60页。PPT课件主要包含了×10-14,稀的电解质溶液,-lgcH+,表面皿,玻璃棒,标准比色卡,溶液pH的计算方法,标准液的体积,滴定终点,酸式滴定管等内容,欢迎下载使用。
新高考化学一轮复习课件 第8章 第47讲 水的电离和溶液的pH: 这是一份新高考化学一轮复习课件 第8章 第47讲 水的电离和溶液的pH,共60页。PPT课件主要包含了高考化学一轮复习策略,水的电离和溶液的pH,归纳整合,专项突破,溶液的酸碱性与pH,真题演练明确考向,课时精练等内容,欢迎下载使用。












