

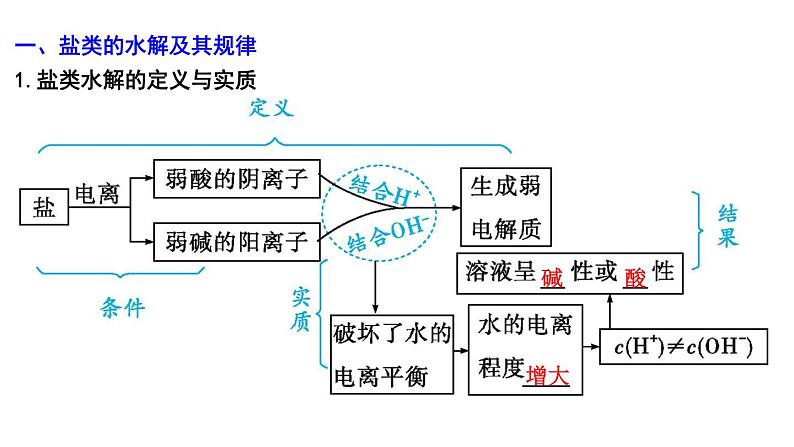

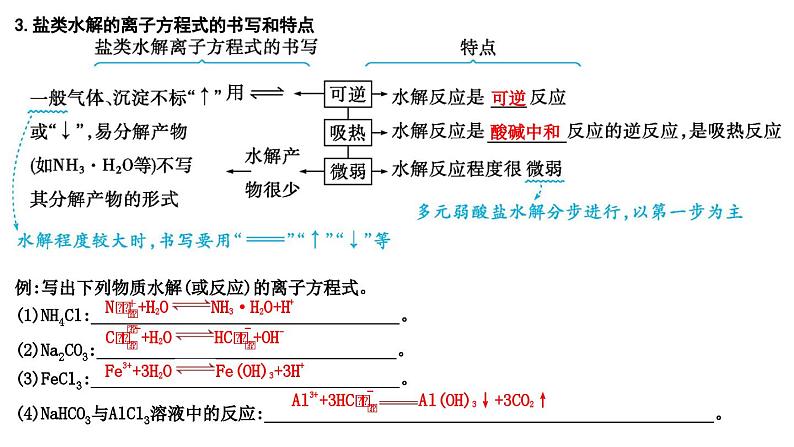








2024届高考化学一轮复习课件 第八章 水溶液中的离子反应与平衡 第3讲 盐类的水解
展开第3讲 盐类的水解
(40分钟)
选题表
知识点 | 题号 | ||
基础 | 能力 | 创新 | |
盐类的水解及其规律 | 1,2 |
|
|
盐类水解的影响因素及应用 | 3 | 5,6,7 | 12 |
综合 | 4 | 8,9,10 | 11,13 |
1.(2020·浙江7月选考)水溶液呈酸性的是( B )
A.NaCl B.NaHSO4
C.HCOONa D.NaHCO3
解析:氯化钠是强酸强碱盐,水溶液呈中性,A项错误;硫酸氢钠在水中完全电离出钠离子、氢离子和硫酸根离子,水溶液呈酸性,B项正确;甲酸钠是弱酸强碱盐,水溶液呈碱性,C项错误;碳酸氢钠是弱酸强碱盐,水溶液呈碱性,D项错误。
2.25 ℃时,浓度均为1 mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液中c(X-)=1 mol/L,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是( D )
A.AY溶液的pH小于7
B.AY溶液的pH小于BY溶液的pH
C.稀释相同倍数,BX溶液的pH变化小于BY溶液的
D.电离平衡常数K(BOH)小于K(HY)
解析:根据AX、BX、BY溶液的pH,推知AX为强酸强碱盐,BX为强酸弱碱盐,BY为弱酸弱碱盐,则AY为强碱弱酸盐,溶液的pH>7,A、B错误;稀释相同倍数,BX、BY溶液的pH均增大,BX溶液的pH变化大于BY溶液的,C项错误;BY溶液的pH=6,因此电离平衡常数K(BOH)小于 K(HY),D项正确。
3.(2022·天津河东区期末)关于下列实验的分析不正确的是( C )
A.Na2CO3与NaHCO3溶液中所含粒子种类相同
B.Al2(SO4)3能促进Na2CO3、NaHCO3水解
C.CaCl2能促进Na2CO3、NaHCO3水解
D.Al2(SO4)3与Na2CO3、NaHCO3反应都能产生大量CO2
解析:Na2CO3与NaHCO3溶液中均含有H2O、Na+、H2CO3、HC、C、H+、OH-,故所含粒子种类相同,A正确;铝离子均能与HC、C发生相互促进的水解反应,产生大量CO2,B、D正确;Ca2++CCaCO3↓,会促进HC的电离,抑制Na2CO3的水解,C错误。
4.NH4Al(SO4)2常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题。
(1)NH4Al(SO4)2可作净水剂,其原理是 (用离子方程式说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2溶液中的c(N) (填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中的c(N)。
(3)几种均为0.1 mol·L-1的电解质溶液的pH随温度变化的曲线如图所示。
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线
是 (填罗马数字)。NH4Al(SO4)2溶液的pH随温度变化的原因是
。
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中 2c(S)-c(N)-
3c(Al3+)= mol·L-1。(列计算式不必化简)
(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加
0.1 mol·L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线
如图所示。
①试分析图中a、b、c、d四个点,水的电离程度最大的是 点。
②在b点,溶液中各离子浓度由大到小的排列顺序是 。
③由b到c发生反应的离子方程式为
。
解析:(3)①NH4Al(SO4)2溶于水电离出的N、Al3+在溶液中水解使溶液显酸性,水解反应是吸热反应,升高温度,平衡向正反应方向移动,溶液中氢离子浓度增大,pH减小,则符合条件的曲线是Ⅰ;
②由图可知,20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH为3,由溶液中的电荷守恒关系 2c(S)+c(OH-)=c(N)+c(H+)+3c(Al3+)可得20 ℃时,2c(S)-c(N)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol·L-1-
10-11 mol·L-1。
(4)①向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,发生的反应为H++OH-H2O、OH-+NNH3·H2O,由方程式可知,a点时NaOH溶液恰好中和溶液中H+,得到等浓度的(NH4)2SO4和Na2SO4的混合溶液,溶液中的N水解促进水的电离;a点之后,N与OH-反应生成抑制水电离的NH3·H2O,c(N)越小,促进水的电离程度越小,所以溶液中水的电离程度最大的是a点;②由图可知b点时,溶液pH为7,该点为Na2SO4、(NH4)2SO4和NH3·H2O的混合溶液,则溶液中各离子浓度由大到小的排列顺序是 c(Na+)>c(S)>c(N)>
c(OH-)=c(H+);③由b到c发生反应的离子方程式为OH-+NNH3·H2O。
答案:(1)Al3++3H2OAl(OH)3(胶体)+3H+
(2)小于
(3)①Ⅰ NH4Al(SO4)2水解使溶液呈酸性,升高温度其水解程度增大,
pH减小 ②(10-3-10-11)
(4)①a ②c(Na+)>c(S)>c(N)>c(OH-)=c(H+)
③N+OH-NH3·H2O
5.(2023·广东汕头模拟)下列说法正确的有( A )
①pH=0的溶液中Fe3+与S2-因发生相互促进的水解而不共存
②MgCl2溶液蒸干后得MgO固体,如果想要得到MgCl2固体应通入HCl气流
③将0.1 mol的Na2CO3溶于水中,形成溶液中阴离子总数小于0.1NA
④HC和Al在溶液中因为互相抑制水解而大量共存
⑤将I2加入NaHSO3溶液中发生反应:HS+I2+3OH-S+2I-+2H2O
⑥相等体积的pH=2的盐酸和醋酸,均稀释到pH=5,醋酸加水量大
⑦NaHSO3溶液中加入少量NaOH固体,将增大
A.2个 B.4个 C.5个 D.7个
解析:①Fe3+与S2-因发生氧化还原反应而不共存,错误;②MgCl2中的Mg2+易水解,加热溶液促进水解,所以MgCl2溶液蒸干后得Mg(OH)2固体,错误;③Na2CO3在溶液中水解生成OH-和HC,阴离子数目增加,错误;④HC和Al在溶液中会反应生成Al(OH)3沉淀和C,所以HC和Al不能大量共存,故错误;⑤NaHSO3溶液显酸性,离子方程式中不能用氢氧根离子,所以将I2加入NaHSO3溶液中发生反应HS+I2+H2OS+2I-+3H+,故错误;⑥盐酸是强酸,完全电离,将pH=2的盐酸稀释到pH=5时,稀释后溶液的体积是原来体积的 1 000倍;而CH3COOH是弱酸,加水稀释时CH3COOH的电离被促进,故同样是稀释至溶液的体积是原来体积的 1 000倍的时候,溶液的pH小于5,故要稀释至pH=5,醋酸加水量大,故正确;⑦NaHSO3溶液中加入少量NaOH固体,NaHSO3与NaOH反应生成Na2SO3,所以NaHSO3溶液中加入少量NaOH固体,将增大,正确。
6.(2022·河北模拟改编)室温下,通过下列实验探究NH4HCO3的性质:
实验 | 实验操作和现象 |
1 | 用pH试纸测定0.1 mol·L-1 NH4HCO3溶液的pH,测得pH约为10 |
2 | 向浓度为0.1 mol·L-1 NH4HCO3溶液中加入足量NaOH,有刺激性气味气体产生 |
3 | 浓度均为2.0 mol·L-1 NH4HCO3溶液和NaCl溶液等体积混合,有晶体析出,过滤 |
下列说法不正确的是( C )
A.0.1 mol·L-1 NH4HCO3溶液中存在:c(H+)+c(H2CO3)=c(C)+c(OH-)+c(NH3·H2O)
B.由实验1可得:Kb(NH3·H2O)>Ka1(H2CO3)
C.实验2中发生反应的离子方程式:N+OH-NH3↑+H2O
D.实验3中所得滤液中存在:c(N)+c(NH3·H2O)>c(H2CO3)+c(HC)+
c(C)
解析:由质子守恒知A项正确;由实验1溶液呈碱性可知,水解程度N<HC,故可得 Kb(NH3·H2O)>Ka1(H2CO3),B项正确;实验2中发生反应的离子方程式为HC+OH-C+H2O,N+OH-NH3↑+H2O,C项错误;析出晶体为NaHCO3,根据物料守恒,实验3中所得滤液中存在c(N)+c(NH3·H2O)=c(Cl-),c(Na+)=c(H2CO3)+c(HC)+c(C),
c(Na+)<c(Cl-),故c(N)+c(NH3·H2O)>c(H2CO3)+c(HC)+c(C),
D项正确。
7.(2022·黑龙江实验中学模拟)实验测得等物质的量浓度的NaHCO3和Na2CO3溶液的pH随温度变化如图所示。下列说法正确的是( D )
A.Na2CO3的水解是放热反应
B.M点之前,升高温度溶液的pH减小,原因是水解平衡逆向移动
C.N点时NaHCO3已完全分解
D.若将N点溶液恢复到25 ℃,pH>8.62
解析:Na2CO3的水解是吸热反应,故A错误;NaHCO3溶液中,HCH++C、HC+H2OH2CO3+OH-,M点之前,升高温度溶液的pH减小,原因是电离程度大于水解程度,故B错误;碳酸钠溶液的pH随温度升高而降低,N点后溶液的pH随温度升高而升高,所以N点时NaHCO3没有完全分解,故C错误;N点溶液中含有碳酸钠,若将N点溶液恢复到25 ℃,pH>8.62,故D正确。
8.(2022·安徽淮北二模)H2A为二元弱酸,在 25 ℃ 时,溶液中A2-及HA-浓度的负对数pc随溶液pH变化的关系如图所示[已知:溶液中始终保持c(H2A)+c(HA-)+c(A2-)=0.1 mol/L]。下列有关叙述错误的是( D )
A.H2A的Ka1为1.0×10-3
B.b点:c(HA-)>c(A2-)>c(OH-)
C.由a点到c点的过程中,水的电离程度一直增大
D.NaHA溶液呈碱性
解析:pH为0时,溶液中主要是H2A,以H2A的一级电离为主,故c(HA-)=10-4 mol/L,ab所在曲线为HA-的曲线,另一条线为A2-的曲线,
c(H2A)近似为0.1 mol/L,Ka1===10-3,A正确;b点溶液显酸性,c(OH-)很小,根据图知,c(HA-)>c(A2-),故c(HA-)>c(A2-)>c(OH-),
B正确;由a点经b点到c点的过程中,溶液一直呈酸性,且酸性越来越弱,酸抑制水电离程度越来越弱,故水的电离程度一直增大,C正确;
pH=4.4时,c(HA-)=c(A2-),故Ka2==c(H+)=10-4.4,HA-的水解平衡常数Kh===10-11<Ka2,故NaHA溶液显酸性,D错误。
9.(不定项)室温下,将0.10 mol·L-1 NaOH溶液滴到0.10 mol·L-1 HA溶液中,溶液的pH与粒子浓度比值的对数[lg ]关系如图所示。下列叙述正确的是( BD )
A.溶液中水的电离程度:N>P>Q
B.P点溶液中:c(Na+)=c(OH-)+c(HA)-c(H+)
C.Q点溶液中:c(Na+)>c(A-)>c(HA)
D.室温下,NaA的水解平衡常数Kh=10-9.25
解析:N、P、Q三点的pH都小于7,水的电离受到抑制,且pH越小,
水的电离程度越小,故溶液中水的电离程度为N<P<Q,A错误;P点
lg =0,即c(A-)=c(HA),根据电荷守恒分析,c(Na+)+c(H+)=
c(OH-)+c(A-),则有 c(Na+)+c(H+)=c(OH-)+c(HA),B正确;Q点
lg =1,pH小于7,c(H+)>c(OH-),则根据电荷守恒分析,c(Na+)+
c(H+)=c(OH-)+c(A-),则有c(A-)>c(Na+),C错误;由N、Q两点的坐标可以计算P点坐标(0,4.75),lg =0,c(H+)=10-4.75 mol·L-1,根据电离平衡常数K=分析,K=10-4.75,则室温下,NaA的水解平衡常数Kh===10-9.25,D正确。
10.(不定项)(2022·山东泰安三轮验收)氨基酸在水溶液中可通过得到或失去H+发生如下反应:
常温下,0.001 mol·L-1的甘氨酸(H2NCH2COOH)溶液中各物种浓度对数值与pH的关系如图所示:
下列说法错误的是( D )
A.曲线①为H3N+CH2COOH的浓度与pH的关系图
B.pH=7时,c(H3N+CH2COO-)>c(H2NCH2COO-)>c(H3N+CH2COOH)
C.B点时,pH=
D.在Cl-H3N+CH2COOH溶液中c(H+)=c(H3N+CH2COO-)+c(H2NCH2COO-)+c(OH-)
解析:由氨基酸在水溶液中可通过得到或失去H+发生反应可知,c(H+)增大,H3N+CH2COOH含量增大,c(H+)减小,H2NCH2COO-含量增大;故曲线①②③分别为H3N+CH2COOH、H3N+CH2COO-、H2NCH2COO-的浓度与pH的关系图,A正确,由图可知,pH=7时,c(H3N+CH2COO-)>c(H2NCH2COO-)>
c(H3N+CH2COOH),B正确;B点时 c(H3N+CH2COOH)=c(H2NCH2COO-),
===-lg c(H+)=pH,
C正确;在 Cl-H3N+CH2COOH 溶液中存在质子守恒c(H+)=c(H3N+CH2COO-)+
2c(H2NCH2COO-)+c(OH-),D错误。
11.(1)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOHNaNO3+
NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(N)、c(N)和c(CH3COO-)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4,CH3COOH的电离常数Ka=1.7×10-5)。可使溶液A和溶液B的pH相等的方法是 (填字母)。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH固体
c.向溶液B中加适量水
d.向溶液B中加适量NaOH固体
(2)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液(NaOH溶液)吸收SO2的过程中,pH随 n(S)∶n(HS)的变化如下表:
n(S)∶n(HS) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断NaHSO3溶液显 性,用化学平衡原理解释:
。
②当吸收液呈中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(Na+)=2c(S)+c(HS)
b.c(Na+)>c(HS)>c(S)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(S)+c(HS)+c(OH-)
解析:(1)根据盐类水解规律,CH3COOH的电离常数小于亚硝酸的电离常数,故CH3COO-的水解程度大于N的水解程度,故离子浓度大小关系为 c(N)>c(N)>c(CH3COO-)。溶液A的pH小于溶液B的pH,为使两者的pH相等,可以采取向溶液A中加适量NaOH固体,使A的pH增大;向溶液B中加适量水,使溶液B的pH减小。(2)根据表中数据可知,HS的含量越高,溶液的pH越小,故HS的电离程度大于其水解程度。根据电荷守恒,c(Na+)+c(H+)=c(HS)+2c(S)+c(OH-),溶液呈中性,c(H+)=c(OH-),故c(Na+)=c(HS)+2c(S),a项正确;溶液呈中性,c(H+)=c(OH-),从表中数据可推出c(HS)>c(S),故c(Na+)>
c(HS)>c(S)>c(OH-)=c(H+),b项正确;根据电荷守恒可得c(Na+)+
c(H+)=c(HS)+2c(S)+c(OH-),c项错误。
答案:(1)c(N)>c(N)>c(CH3COO-) bc
(2)①酸 溶液中存在HS的电离平衡和水解平衡,从表中数据可以看出,HS的含量越高,溶液的pH越小,故HS的电离程度大于其水解程度 ②ab
12.在两只锥形瓶中分别加入浓度均为1 mol·L-1的盐酸和NH4Cl溶液,将温度传感器和pH传感器与溶液相连,往瓶中同时加入过量的质量、形状均相同的镁条,实验结果如图所示。关于该实验的下列说法,正确的是( A )
A.P点溶液:c(N)+2c(Mg2+)>c(Cl-)
B.反应剧烈程度:NH4Cl>HCl
C.Q点溶液显碱性是因为MgCl2发生水解
D.1 000 s后,镁与NH4Cl溶液反应停止
解析:从图中可以看出,P点溶液的pH>7,此时 c(OH-)>c(H+);依据电荷守恒可知,c(N)+2c(Mg2+)+c(H+)=c(Cl-)+c(OH-),所以 c(N)+
2c(Mg2+)>c(Cl-),A正确;镁与盐酸反应,溶液温度迅速升高,并达最高点,反应放出的热量多,所以反应剧烈程度HCl>NH4Cl,B不正确;MgCl2水解时,溶液显酸性,所以Q点溶液显碱性不是MgCl2发生水解所致,
C不正确;1 000 s 后,镁与NH4Cl溶液反应温度仍在缓慢上升,溶液的pH仍在缓慢增大,说明反应仍在正向进行,D不正确。
13.电位滴定是利用溶液电位突变指示终点的滴定法。常温下,
用c mol·L-1 HCl标准溶液测定 V mL 某生活用品中Na2CO3的含量
(假设其他物质均不反应且不含碳、钠元素),得到滴定过程中溶液电位与V(HCl)的关系如图所示。已知:两个滴定终点时消耗盐酸的体积差可计算出Na2CO3的量。下列说法正确的是( D )
A.a至c点对应溶液中逐渐增大
B.水的电离程度:a>b>d>c
C.a溶液中存在:c(Na+)+c(H+)=c(HC)+2c(C)+c(OH-)
D.V mL该生活用品中含有Na2CO3的质量为 0.106c(V2-V1) g
解析:根据H2CO3的二级电离常数Ka2(H2CO3)=,推出=,温度不变,Ka2(H2CO3)不变,但随着盐酸的加入,c(H+)逐渐增大,则逐渐减小,即逐渐减小,故A错误;未加盐酸前,溶液中溶质主要为Na2CO3,对水的电离起促进作用,随着盐酸的加入,溶质逐步转化为NaHCO3、H2CO3,水的电离程度逐步减小,则水的电离程度a>b>c>d,故B错误;a点发生的反应为Na2CO3+HClNaHCO3+NaCl,Na2CO3过量,即a点溶液中溶质为NaHCO3、NaCl、Na2CO3,电荷守恒为c(Na+)+c(H+)=c(HC)+2c(C)+c(OH-)+c(Cl-),故C错误;V1→V2表示发生反应NaHCO3+HClNaCl+H2CO3,根据碳元素守恒,有n(Na2CO3)=n(NaHCO3)=c(V2-V1)×10-3 mol,Na2CO3的质量为m(Na2CO3)=
c(V2-V1)×10-3 mol×106 g·mol-1=0.106c(V2-V1)g,故D正确。
2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第3讲 盐类的水解课件PPT: 这是一份2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第3讲 盐类的水解课件PPT,共60页。PPT课件主要包含了水解规律,答案A,答案D,答案10,NaHCO3,CH3COONa,2外因,盐类水解的应用,答案C,答案B等内容,欢迎下载使用。
新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第25讲盐类的水解课件: 这是一份新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第25讲盐类的水解课件,共60页。PPT课件主要包含了第25讲盐类的水解,考点一,考点二,考点三,必备知识·梳理夯实,盐类的水解,NH3·H2O+H+,pH=7,pH7,2盐类水解规律等内容,欢迎下载使用。
2024届高考化学一轮复习课件 第八章 水溶液中的离子反应与平衡 第4讲 沉淀溶解平衡: 这是一份2024届高考化学一轮复习课件 第八章 水溶液中的离子反应与平衡 第4讲 沉淀溶解平衡,文件包含第4讲沉淀溶解平衡pptx、第4讲沉淀溶解平衡docx、第4讲沉淀溶解平衡课后作业docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












