







2024届高考化学一轮复习课件 第十章 化学实验 热点强化练15 物质的分离与提纯在实验、流程中的应用
展开热点强化练15 物质的分离与提纯在实验、流程中的应用
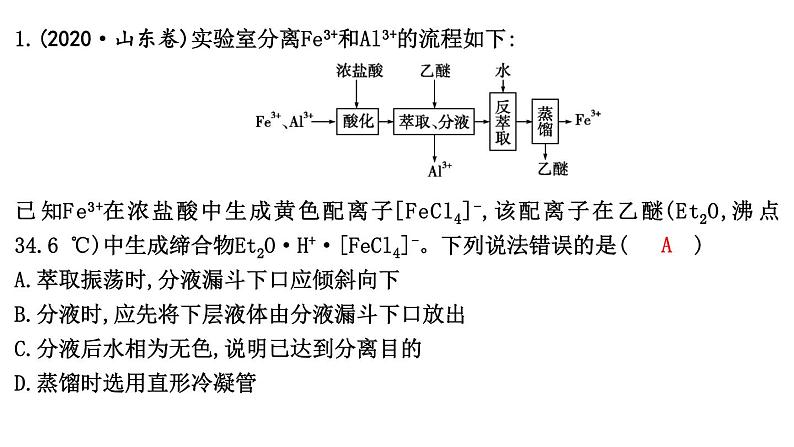
1.(2020·山东卷)实验室分离Fe3+和Al3+的流程如下:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( A )
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
解析:萃取振荡时,应盖上分液漏斗上口的塞子,关闭旋塞,将分液漏斗下口倾斜向上,A项错误;液体分层后,先将下层液体由分液漏斗下口放出,关闭旋塞,再从上口倒出上层液体,B项正确;加入乙醚萃取后,Fe3+完全转化为Et2O·H+·[FeCl4]-,则分液后水相为无色,说明已达到分离目的,C项正确;蒸馏时选用直形冷凝管,便于馏分流出,D项正确。
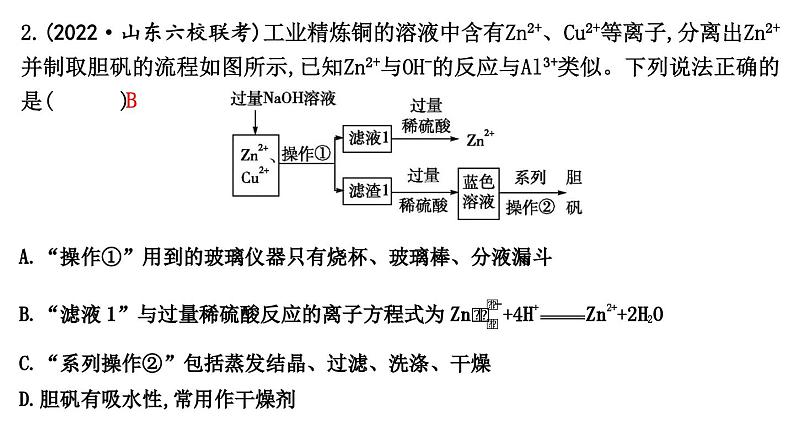
2.(2022·山东六校联考)工业精炼铜的溶液中含有Zn2+、Cu2+等离子,分离出Zn2+并制取胆矾的流程如图所示,已知Zn2+与OH-的反应与Al3+类似。下列说法正确的是( B )
A.“操作①”用到的玻璃仪器只有烧杯、玻璃棒、分液漏斗
B.“滤液1”与过量稀硫酸反应的离子方程式为Zn+4H+Zn2++2H2O
C.“系列操作②”包括蒸发结晶、过滤、洗涤、干燥
D.胆矾有吸水性,常用作干燥剂
解析:加入过量NaOH溶液所得滤液1中主要含Zn,加入过量稀硫酸生成Zn2+;滤渣1为Cu(OH)2,加入过量稀硫酸生成CuSO4,溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到胆矾。“操作①”为过滤,用到的玻璃仪器是烧杯、玻璃棒、漏斗,A错误;滤液1中Zn与过量稀硫酸反应的离子方程式为Zn+4H+Zn2++2H2O,B正确;结合上述分析,因为胆矾含有结晶水,故不能使用蒸发结晶,C错误;胆矾自身含结晶水,不具有吸水性,不能用作干燥剂,D错误。
3.(2022·北大附中三模)在实验室中以含镍废料(主要成分为NiO,含少量FeO、Fe2O3、CoO、BaO和SiO2)为原料制备NixOy和CoCO3的工艺流程如图。
下列说法不正确的是( B )
A.“滤渣Ⅰ”中含BaSO4和SiO2
B.该过程中包含2次过滤操作
C.“沉钴”过程发生的反应为Co2++2HCCoCO3↓+CO2↑+H2O
D.“沉钴”时,若c(Co2+)=0.02 mol/L,为了防止沉钴时生成Co(OH)2,常温下应控制溶液pH<7.5{已知Ksp[Co(OH)2]=2×10-15}
解析:含镍废料中加入稀硫酸酸浸,过滤分离出滤渣Ⅰ主要成分为SiO2、BaSO4,A正确;结合图示流程可知得到滤渣Ⅰ、滤渣Ⅱ、CoCO3和NiSO4·6H2O晶体,包含4次过滤操作,B错误;“沉钴”时溶液中Co2+与HC发生反应,其离子方程式为Co2++2HCCoCO3↓+CO2↑+H2O,C正确;当恰好刚生成Co(OH)2时c(OH-)==mol/L=1×10-6.5 mol/L,常温下 c(H+)==mol/L=1×10-7.5 mol/L,即pH=7.5,则为了防止生成Co(OH)2,常温下应控制溶液pH<7.5,D正确。
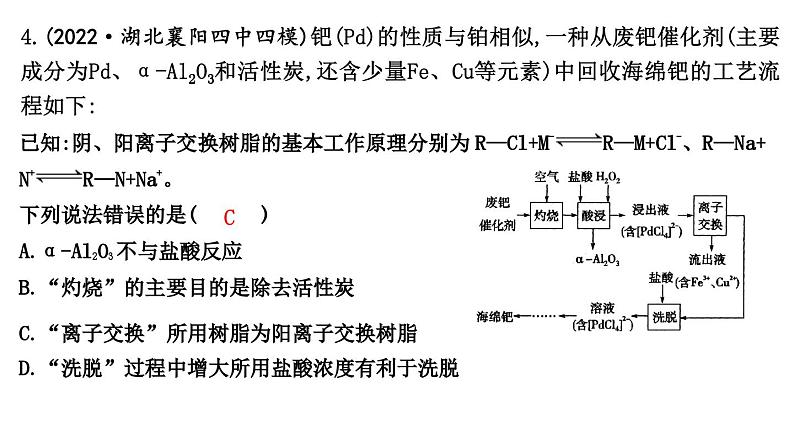
4.(2022·湖北襄阳四中四模)钯(Pd)的性质与铂相似,一种从废钯催化剂(主要成分为Pd、α-Al2O3和活性炭,还含少量Fe、Cu等元素)中回收海绵钯的工艺流程如下:
已知:阴、阳离子交换树脂的基本工作原理分别为R—Cl+M-R—M+Cl-、R—Na+N+R—N+Na+。
下列说法错误的是( C )
A.α-Al2O3不与盐酸反应
B.“灼烧”的主要目的是除去活性炭
C.“离子交换”所用树脂为阳离子交换树脂
D.“洗脱”过程中增大所用盐酸浓度有利于洗脱
解析:由流程图可知,酸浸时αAl2O3是滤渣,故 αAl2O3 不与盐酸反应,A正确;灼烧时活性炭参与反应,变成CO2气体,所以“灼烧”的目的是除去活性炭,B正确;依据R—Cl+M-R—M+Cl-,可知“离子交换”所用树脂应为阴离子交换树脂,从而使得Fe3+和Cu2+以离子形式在流出液中除去,C错误;“洗脱”过程中增大盐酸浓度,使得Cl-浓度也增大,R—Cl+M-R—M+Cl-平衡逆向移动,有利于洗脱,D正确。
5.(不定项)(2022·湖南明德中学二模)溴乙烷是无色油状液体,是制造巴比妥的原料,工业上可用海水制备溴乙烷,部分工艺流程如图:
下列说法错误的是( CD )
A.粗盐(含Ca2+、Mg2+、S杂质离子)提纯时,加入沉淀剂的顺序可以是BaCl2、NaOH和Na2CO3
B.向“母液”中通入热空气,利用溴的易挥发性,将溴吹出
C.“制备”时氧化剂和还原剂的物质的量之比为 3∶2
D.“精制”时所用的玻璃仪器有分液漏斗、烧杯
解析:粗盐的提纯过程中,Ca2+、Mg2+、S分别用Na2CO3、NaOH、BaCl2溶液沉淀,并且BaCl2必须在Na2CO3前加入,故加入沉淀剂的顺序可以是BaCl2、NaOH和Na2CO3,A正确;利用溴的易挥发性,向“母液”中通入热空气,将溴吹出,B正确;“制备”时发生S+3Br2+6C2H5OH6C2H5Br+H2SO4+2H2O,其中S是还原剂,Br2是氧化剂,即氧化剂和还原剂的物质的量之比为3∶1,C错误;溴乙烷易溶于乙醇,用蒸馏法精制溴乙烷,“精制”时所用玻璃仪器有蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶、酒精灯等,D错误。
6.(不定项)(2022·山东济宁三模)对废催化剂进行回收可有效利用金属资源,某含银废催化剂主要含Ag、α-Al2O3(α-Al2O3为载体,不溶于硝酸)及少量MgO、SiO2、K2O、Fe2O3等,一种回收制备高纯银粉工艺的部分流程如图。下列说法正确的是( AD )
A.滤渣A中含SiO2、α-Al2O3
B.气体B可以通入NaOH溶液除去
C.“溶解”过程主要发生了复分解反应
D.“还原”过程中生成无毒气体,B与C的物质的量的理论比值为
4∶3
解析:含银废催化剂中加入稀硝酸,αAl2O3、SiO2因不溶而成为滤渣,即滤渣A中含SiO2、αAl2O3,A正确;Ag与稀硝酸发生反应3Ag+4HNO3(稀)3AgNO3+NO↑+2H2O,故气体B为NO,与NaOH溶液不反应,不能通入NaOH溶液除去,B错误;“溶解”过程中,加入氨水溶解AgCl,生成[Ag(NH3)2]+等,发生的反应不是复分解反应,C错误;“还原”过程中生成的无毒气体为N2,设Ag的物质的量为12 mol,则生成NO(B) 4 mol,生成N2(C) 3 mol,故B与C的物质的量的理论比值为4∶3,D正确。
7.(2022·山东日照三模)五氧化二钒常用于生产硫酸或石油精炼的催化剂。某化工厂从废钒催化剂中(含有K2SO4、V2O5、V2O4、SiO2、Fe2O3、Al2O3等)回收V2O5和K2SO4,既能避免环境污染,又能节约资源。回收工艺流程如下:
已知:①“酸浸”时,V2O5和V2O4先与稀硫酸反应分别生成V和VO2+;
②有机萃取剂萃取VO2+的能力比萃取V的能力强;
③NH4VO3微溶于冷水、易溶于热水、难溶于乙醇;
④溶液中V与V可相互转化:V+H2OV+2H+。
回答下列问题。
(1)滤渣2的成分主要有 (填化学式)。
(2)“酸浸”时,FeSO4参与反应的离子方程式为 。
(3)“萃取”和“反萃取”时,将发生R2(SO4)n(水层)+2nHA(有机层)2RAn(有机层)+nH2SO4(水层)(其中R表示VO2+,HA表示有机萃取剂)。
①“反萃取”操作加入的试剂是 (填化学式)。
②假设“滤液2”中c(VO2+)=a mol/L,“萃取”和“反萃取”每进行一次,VO2+萃取率为90%,5次操作后,“滤液2”中残留的c(VO2+)=
mol/L(萃取率=×100%)。
(4)“氧化”过程中发生反应的离子方程式为 。
(5)①“沉钒”时生成NH4VO3,通入NH3的作用是 。
②实验发现,温度超过80 ℃以后沉钒率下降,可能的原因是
。
解析:结合已知①“酸浸”时,V2O5和V2O4先与稀硫酸反应分别生成V和VO2+,然后V与FeSO4发生氧化还原反应生成Fe3+和VO2+,滤液1中主要有H+、S、K+、Al3+、Fe3+、Fe2+和VO2+,滤渣1为SiO2,滤液1加H2O2氧化后,Fe2+被氧化为Fe3+,用KOH调pH除去Al3+、Fe3+,滤渣2主要成分为Al(OH)3和Fe(OH)3;用有机萃取剂萃取后VO2+进入有机相1中,经过反萃取进入水相2,氧化后生成V,通入NH3使V转化为V,加NH4Cl沉钒得到NH4VO3,煅烧得到V2O5;水相1中为K2SO4,结晶得到K2SO4固体。(1)结合上述分析可知,滤渣2的主要成分是Al(OH)3和Fe(OH)3。(2)“酸浸”时V与Fe2+反应生成VO2+和Fe3+,其离子方程式为V+Fe2++2H+VO2++Fe3++H2O。(3)①结合分析和涉及的反应可知,反萃取时加入H2SO4可使平衡逆向移动,进行反萃取操作。②5次操作后,“滤液2”中残留的c(VO2+)=a mol/L×(1-90%)5=a×10-5mol/L。(4)结合分析,用有机萃取剂萃取后VO2+进入有机相1中,经过反萃取进入水相2,氧化后生成V,其离子方程式为6VO2++Cl+3H2O6V+Cl-+6H+。
答案:(1)Fe(OH)3、Al(OH)3
(2)V+Fe2++2H+VO2++Fe3++H2O
(3)①H2SO4 ②a×10-5
(4)6VO2++Cl+3H2O6V+Cl-+6H+
(5)①使V+H2OV+2H+平衡正向移动,将V转化为V;同时增大N浓度,生成晶体析出 ②a.温度升高,NH4VO3溶解度增大,沉钒率下降;b.温度升高,一水合氨受热分解逸出NH3,使N浓度下降,沉钒率下降;c.温度升高,一水合氨受热分解逸出NH3,使V+H2OV+2H+平衡逆向移动,V浓度下降,沉钒率下降;d.可能平衡V+H2OV+2H+ ΔH<0,温度升高,平衡逆向移动,V浓度下降,沉钒率下降
8.(2022·广东珠海二中模拟)废旧锂电池的有效回收,可以减少环境污染,也能缓解贵金属资源危机。一种高效处理三元锂电池正极活性物质(其中金属元素的质量分数为Li-6.78%、Mn-16.94%、Co-11.88%、Ni-30.37%),回收贵金属元素的工艺如图。
已知:金属离子开始沉淀和完全沉淀的pH如下表所示。
金属离子 | Co2+ | Mn2+ | Ni2+ |
开始沉淀的pH | 6.6 | 7.8 | 6.7 |
完全沉淀的pH | 9.2 | 10.4 | 9.5 |
回答下列问题。
(1)在一定条件下“酸浸”时,金属离子的浸出率与硫酸浓度的关系如图所示,此条件下,硫酸最合适的浓度为 mol/L。为提高金属离子的浸出率,除硫酸浓度外,还可以研究 、 等条件与金属离子的浸出率的关系。
(2)“调pH”的最佳pH为5,原因是①pH过低,丁二酮肟不易与Ni2+络合生成丁二酮肟镍沉淀,不利于Ni2+的除去;②pH过高, 。
(3)“沉锰”的离子方程式为 。
(4)“还原煅烧”时,生成的Li2CO3溶解度较小。“水浸”时,通入过量CO2有利于Li2CO3溶解为Li+,从而与其他金属元素分离,从平衡移动的角度分析其原理: 。
(5)金属离子的电化学沉积法清洁环保且成本较低。其原理是通过电解装置将金属离子从溶液中逐一还原析出,生成的金属单质应附着
在 极。
电解时,各金属离子还原为单质的电压如下表:
金属离子 | Co2+ | Mn2+ | Ni2+ |
还原为单质的电压/V | 0.280 | 1.185 | 0.257 |
若要改进工艺,更好分离金属离子,应在 (填字母)流程后开始使用电化学沉积法。最后析出的金属单质为 。
A.“酸浸” B.“调pH”
C.“沉镍” D.“沉锰”
解析:(1)结合图示可知,硫酸浓度为2.5 mol/L时金属离子的浸出率较高,为减少原料浪费,最合适的硫酸浓度为2.5 mol/L;为提高金属离子的浸出率,除硫酸浓度外,还可以研究酸浸时间、温度、搅拌速率、液固投料比等条件与金属离子浸出率的关系。(2)由金属离子沉淀的pH表可知,若“调pH”时pH过高,Co2+和Mn2+形成氢氧化物沉淀,不能与镍盐沉淀分离。(3)“沉锰”时KMnO4和Mn2+发生归中反应生成MnO2,其离子方程式为2Mn+3Mn2++2H2O5MnO2↓+4H+。(5)电解池的阴极发生还原反应,则生成的金属单质附着在阴极;由于Ni2+与Co2+还原为单质的电压相差不大,较难分离,则应在“沉镍”流程后开始使用电化学沉积法,故选C。Mn2+还原为金属Mn的电压较高,通电后最晚析出,则最后析出的金属单质为锰。
答案:(1)2.5 酸浸时间 温度(或其他影响速率的因素,合理即可)
(2)Co2+和Mn2+形成氢氧化物沉淀,不能与镍盐沉淀分离
(3)2Mn+3Mn2++2H2O5MnO2↓+4H+
(4)体系中存在Li2CO3的沉淀溶解平衡 Li2CO3(s)2Li+(aq)+C(aq),通入过量CO2与C结合生成HC,降低了C的浓度,使Li2CO3的沉淀溶解平衡向溶解的方向移动,因此有利于Li+进入溶液
(5)阴 C 锰
2024届高考化学一轮复习课件 第十章 化学实验 第2讲 物质的分离与提纯: 这是一份2024届高考化学一轮复习课件 第十章 化学实验 第2讲 物质的分离与提纯,文件包含第2讲物质的分离与提纯pptx、第2讲物质的分离与提纯docx、第2讲物质的分离与提纯课后作业docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
新高考化学一轮复习课件 第4章 第22讲 热点强化8 喷泉实验及拓展应用: 这是一份新高考化学一轮复习课件 第4章 第22讲 热点强化8 喷泉实验及拓展应用,共20页。PPT课件主要包含了高考化学一轮复习策略,喷泉实验及拓展应用等内容,欢迎下载使用。
人教版高考化学一轮复习第1章化学计量在实验中的应用第2讲物质的量在化学实验中的应用课件: 这是一份人教版高考化学一轮复习第1章化学计量在实验中的应用第2讲物质的量在化学实验中的应用课件












