

所属成套资源:2022-2023学年高二化学下学期期末知识点精讲+训练学案+期末模拟卷(沪科版2020选择性必修2
专题03 晶体结构与性质——2022-2023学年高一化学下学期期末知识点精讲+训练学案+期末模拟卷(沪科版2020选择性必修2)
展开
这是一份专题03 晶体结构与性质——2022-2023学年高一化学下学期期末知识点精讲+训练学案+期末模拟卷(沪科版2020选择性必修2),文件包含专题03晶体结构与性质原卷版docx、专题03晶体结构与性质解析版docx等2份学案配套教学资源,其中学案共24页, 欢迎下载使用。
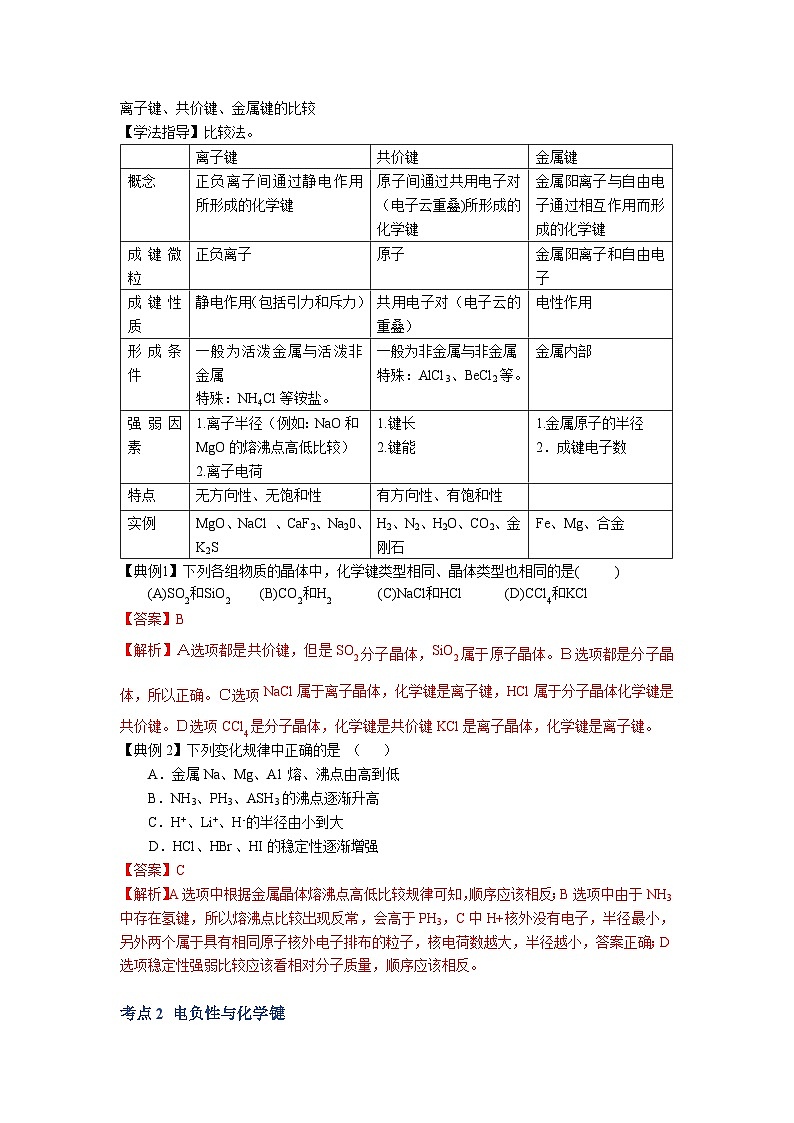
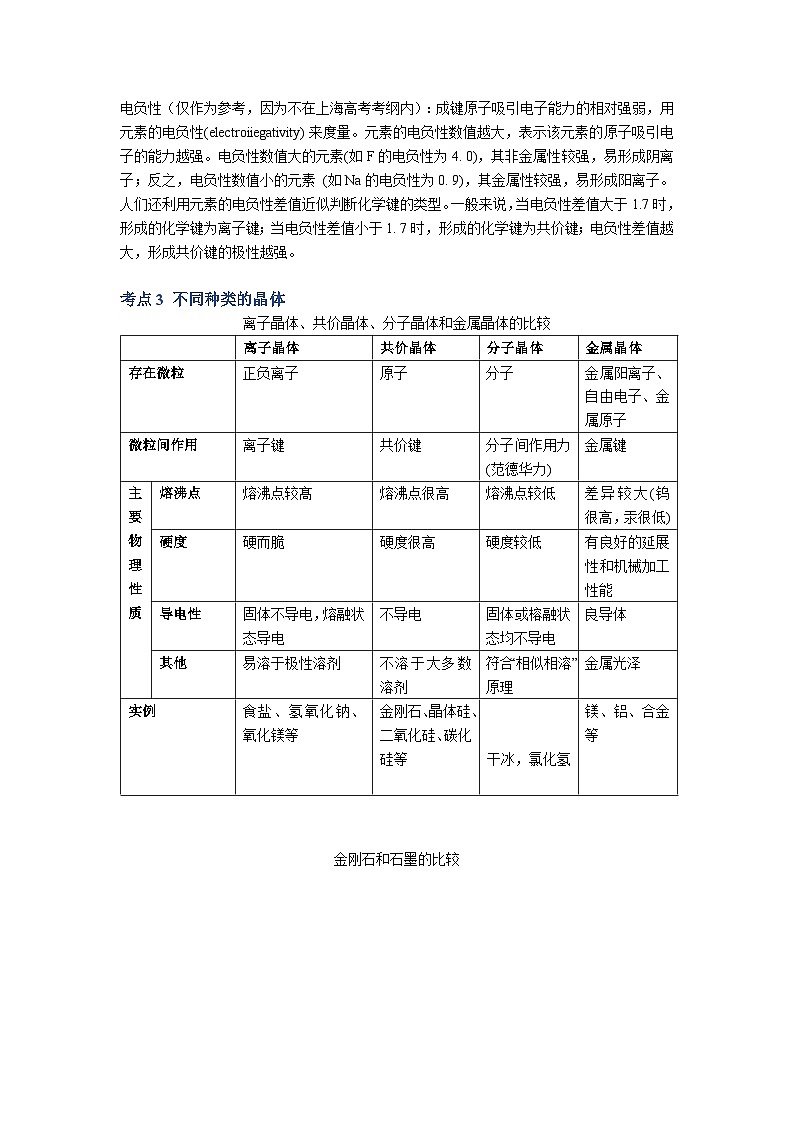
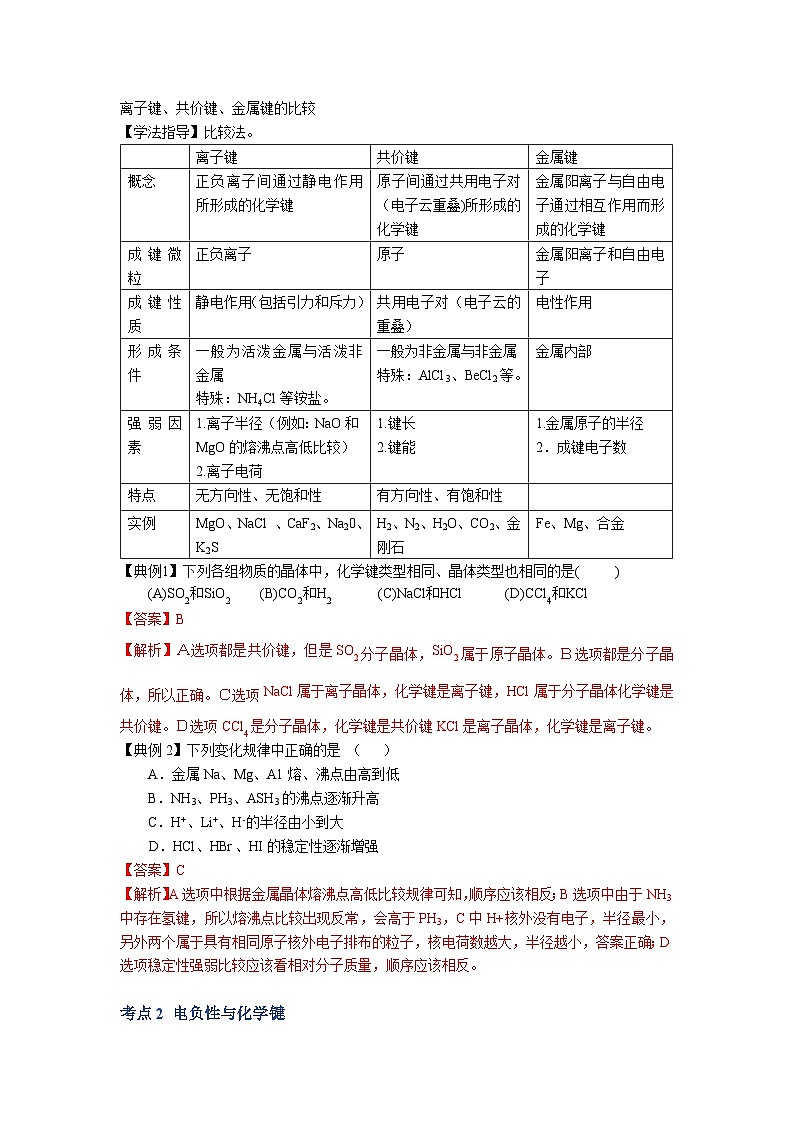
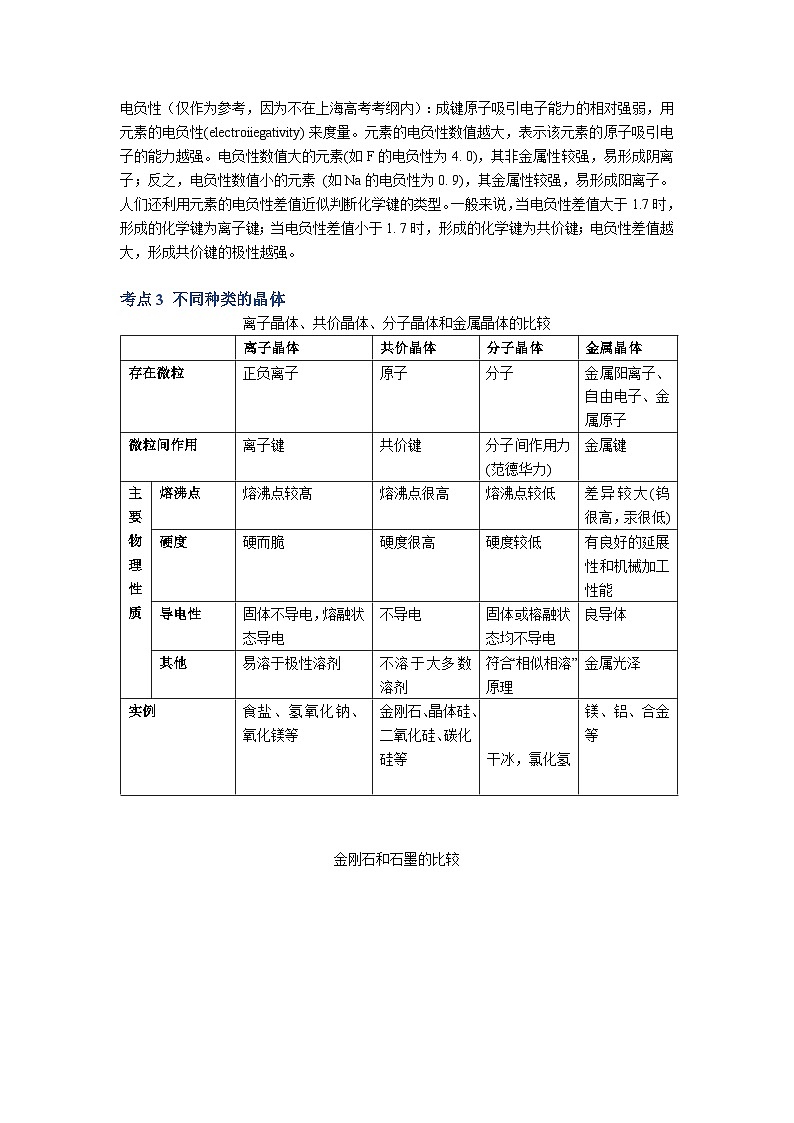
专题03 晶体结构与性质 考点1 晶体及其定义1.晶体的定义:自然界的固态物质可分为晶体和非晶体两大类。原子、离子、分子等微粒在空间有规则地排列成具有一定几何形状的固体物质叫做晶体。我们周围常见的食盐、石英、云母片、冰、金属铝等都是晶体。2.晶体物质的物理性质:熔点、硬度、导热性等,主要跟组成晶体微粒的种类以及微粒之间的作用力有关。3.晶体和非晶体物质相比有以下三个特征: (1)晶体具有一定的几何外形。 (2)晶体有固定的熔点。 (3)晶体有各向异性的特点。【注意】(1)晶体的特性是它内部结构的反映,晶体内的微粒之间靠一定的作用力紧密联系着,以确定的位置在空间作有规则的排列,这是晶体具有一定几何外形的内在原因。 (2)晶体加热到一定温度时开始熔化,这时外界提供的能量全部用来熔化晶体,使温度不再上升。只有当晶体全部熔化后,温度才继续上升,这就是晶体具有固定熔点的原因。 (3)晶体在各个方向上常具有不同的性质(如导热、导电、光学性质和机械强度等),这叫各向异性。一、化学键之间的比较离子键、共价键、金属键的比较【学法指导】比较法。 离子键共价键金属键概念正负离子间通过静电作用所形成的化学键原子间通过共用电子对(电子云重叠)所形成的化学键金属阳离子与自由电子通过相互作用而形成的化学键成键微粒正负离子原子金属阳离子和自由电子成键性质静电作用(包括引力和斥力)共用电子对(电子云的重叠)电性作用形成条件一般为活泼金属与活泼非金属特殊:NH4Cl等铵盐。一般为非金属与非金属特殊:AlCl3、BeCl2等。金属内部强弱因素1.离子半径(例如:NaO和MgO的熔沸点高低比较)2.离子电荷1.键长2.键能1.金属原子的半径2.成键电子数特点无方向性、无饱和性有方向性、有饱和性 实例MgO、NaCl 、CaF2、Na20、 K2SH2、N2、H2O、CO2、金刚石Fe、Mg、合金【典例1】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )(A)SO2和SiO2 (B)CO2和H2 (C)NaCl和HCl (D)CCl4和KCl【答案】B【解析】A选项都是共价键,但是SO2分子晶体,SiO2属于原子晶体。B选项都是分子晶体,所以正确。C选项NaCl属于离子晶体,化学键是离子键,HCl属于分子晶体化学键是共价键。D选项CCl4是分子晶体,化学键是共价键KCl是离子晶体,化学键是离子键。【典例2】下列变化规律中正确的是 ( ) A.金属Na、Mg、A1熔、沸点由高到低 B.NH3、PH3、ASH3的沸点逐渐升高 C.H+、Li+、H-的半径由小到大D.HCl、HBr、HI的稳定性逐渐增强【答案】C【解析】A选项中根据金属晶体熔沸点高低比较规律可知,顺序应该相反;B选项中由于NH3中存在氢键,所以熔沸点比较出现反常,会高于PH3,C中H+核外没有电子,半径最小,另外两个属于具有相同原子核外电子排布的粒子,核电荷数越大,半径越小,答案正确;D选项稳定性强弱比较应该看相对分子质量,顺序应该相反。 考点2 电负性与化学键电负性(仅作为参考,因为不在上海高考考纲内):成键原子吸引电子能力的相对强弱,用元素的电负性(electroiiegativity)来度量。元素的电负性数值越大,表示该元素的原子吸引电子的能力越强。电负性数值大的元素(如F的电负性为4. 0),其非金属性较强,易形成阴离子;反之,电负性数值小的元素 (如Na的电负性为0. 9),其金属性较强,易形成阳离子。人们还利用元素的电负性差值近似判断化学键的类型。一般来说,当电负性差值大于1.7时,形成的化学键为离子键;当电负性差值小于1. 7时,形成的化学键为共价键;电负性差值越大,形成共价键的极性越强。 考点3 不同种类的晶体离子晶体、共价晶体、分子晶体和金属晶体的比较 离子晶体共价晶体分子晶体金属晶体存在微粒正负离子原子分子金属阳离子、自由电子、金属原子微粒间作用离子键共价键分子间作用力(范德华力)金属键主要物理性质熔沸点熔沸点较髙熔沸点很高熔沸点较低差异较大(钨很高,汞很低)硬度硬而脆硬度很高硬度较低有良好的延展性和机械加工性能导电性固体不导电,熔融状态导电不导电固体或榕融状态均不导电良导体其他易溶于极性溶剂不溶于大多数溶剂符合“相似相溶”原理金属光泽实例食盐、氢氧化钠、 氧化镁等金刚石、晶体硅、二氧化硅、碳化硅等 干冰,氯化氢 镁、铝、合金等 金刚石和石墨的比较【典例1】下列各组物质中,按熔点由低到高排列正确的是( )A O2 I2 Hg B、CO2 KCl SiO2 C、Na K Rb D、SiC NaCl SO2【答案】B【解析】A选项中O2是气体、I2是固体、Hg是液体,所以应该是O2 Hg I2 。B选项正确,分子晶体<离子晶体<原子晶体。C选项金属晶体对应离子所带电荷相同,所以离子半径越小,熔沸点越高,顺序应为Rb K Na。D选项中顺序颠倒,应该为分子晶体<离子晶体<原子晶体。考点4 晶体性质的比较1、不同类型晶体:一般情况下,共价晶体〉离子晶体〉分子晶体。例:SiO2>NaCl>SO22、 同种类型晶体:构成晶体微粒间的作用大,则熔沸点高,反之则小。(1) 离子晶体:离子所带的电荷数越高,离子半径越小,则其熔沸点就越高。例:AlCl3>MgCl2>NaCl(2) 分子晶体:对于同类分子晶体,式量越大,则熔沸点越高。例:HI>HBr>HCl(3) 共价晶体:键长越小、键能越大,则熔沸点越高。例:C(金刚石)>SiC>Si3、 常温常压下状态(1) 熔点:固态物质〉液态物质(2) 沸点:液态物质〉气态物质4、一般来说合金的熔沸点比各种金属的都低,硬度都大。 【典例1】碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是( ) A. ①③② B. ②③① C. ③①② D. ②①③【答案】A【解析】本题考查原子晶体熔沸点的比较,原子半径越小,键长越短,熔沸点越高,碳碳键键长<碳硅键键长<硅硅键键长,所以答案为A。 【典例2】在通常条件下,下列各组物质的性质排列正确的是 ( )A.熔点:CO2>KCl>SiO2 B.水溶性:HCl>H2S>SO2C.沸点:乙烷>戊烷>丁烷 D.沸点:H2O>H2S>H2Se【答案】D【解析】A选项中根据各晶体类型熔沸点高低比较的依据可知,顺序应该相反;B选项中的HCl的溶解度为1:500,H2S的溶解度为1:2.6,SO2的溶解度为1:40,故H2S和SO2的顺序错了;C选项为分子晶体熔沸点高低的比较,直接比较相对分子质量的大小;D选项考察氧族元素氢化物熔沸点高低比较,但由于H2O中存在氢键,故熔沸点反而高于H2S。 下列有关晶体的叙述错误的是 ( )A. 离子晶体熔化时离子键被破坏,而分子晶体熔化时化学键未被破坏
B. 白磷晶体中,结构粒子之间通过共价键相结合
C. 石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体
D. 构成分子晶体的粒子中不一定存在共价键【答案】B 【解析】本题主要考查晶体类型的判断和晶体的结构等,意在培养同学们宏观辨识与微观探析的化学学科核心素养。
离子晶体熔化时离子键被破坏,而分子晶体熔化时化学键不被破坏,破坏的是分子间作用力,项正确;
白磷是分子晶体,结构粒子之间通过分子间作用力相结合,项错误;
石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体,项正确;
构成分子晶体的结构粒子中不一定存在共价键,如稀有气体元素对应的晶体中不含任何化学键,项正确。 下列各组物质中,化学键类型与晶体类型均相同的是( )A. 、 B. 、
C. 、 D. 、【答案】C 【解析】A.都为离子晶体,但中含有离子键和共价键、氯化钠中只含离子键,二者所含化学键类型不相同,故A错误;
B.二者都只含极性键,但是前者为原子晶体、后者为分子晶体,晶体类型不同,故B错误;
C.二者都含有离子键和极性键,且都属于离子晶体,所以化学键类型和晶体类型完全相同,故C正确;
D.中含有极性键和非极性键,属于分子晶体,过氧化钠中含有离子键和非极性键,属于离子晶体,所以所含化学键不相同,晶体类型不同,故D错误。
下列有关晶体的说法中一定正确的是 ( )共价晶体中只存在非极性共价键稀有气体形成的晶体属于共价晶体干冰晶体升华时,分子内共价键会发生断裂金属元素和非金属元素形成的化合物一定是离子化合物分子晶体的堆积方式均为分子密堆积离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键金属晶体和离子晶体都能导电 A. B. 只有 C. D. 【答案】B 【解析】共价晶体中也可能存在极性键,如为共价晶体,晶体中存在极性共价键,不存在非极性共价键,错误;稀有气体分子属于单原子分子,形成的晶体属于分子晶体,错误;干冰属于分子晶体,升华时破坏的是分子间作用力,不是共价键,错误;金属元素与非金属元素形成的化合物不一定是离子化合物,如氯化铝是共价化合物,错误;分子晶体的堆积方式不一定均为分子密堆积,如冰融化变成水时体积变小,错误;离子晶体是由正负离子通过离子键结合形成的晶体,金属晶体是金属阳离子和自由电子通过金属键结合而成的晶体,所以金属晶体中不存在离子键,正确;离子晶体中没有自由移动的离子,不能导电,金属晶体中存在自由移动的电子,能导电,错误。答案选B。 下列关于晶体的说法正确的组合是( )在晶体中只要有阳离子就一定有阴离子金刚石、、、、、晶体的熔点依次降低晶体中晶胞结构如图所示每个和个相紧邻
晶体中每个硅原子与两个氧原子以共价键相结合晶体中分子间作用力越大,分子越稳定氯化钠熔化时离子键被破坏 A. B. C. D. 【答案】D 【解析】金属晶体中是金属阳离子和自由电子,故错误;
晶体中熔点高低一般顺序是:原子晶体离子晶体分子晶体;在原子晶体中,原子半径越大熔点越低;在离子晶体中,离子半径越大,熔点越低,电荷越多,熔点越高;在分子晶体中,物质的熔点与相对分子质量成正比含有氢键的物质除外,所以这几种物质的熔点高低顺序是:金刚石、、、、、,故正确;
晶体中每个和个相紧邻,故正确;
晶体中每个硅原子能形成个共价键,则每个与个氧原子以共价键相结合,故错误;
分子的稳定性属于化学性质,与共价键有关,分子间作用力与稳定性无关,故错误;
氯化钠晶体中只有离子键,则氯化钠熔化时离子键被破坏,故正确;
故选D。 下列说法中正确的是( )A. 金属晶体由金属阳离子和自由电子构成,它们都位于晶胞的一定位置上
B. 范德华力实质上是一种静电作用,所以范德华力是一种特殊的化学键
C. 配位键属于共价键,氢键不属于化学键
D. 共价晶体中只存在非极性共价键【答案】C 【解析】A.金属晶体是由金属阳离子和自由电子构成的,其中金属离子占据在晶胞的一定位置上,自由电子随意移动,故A错误;
B.范德华力不是化学键,故B错误;
C.配位键属于共价键,氢键是分子间作用力,不是化学键,故C正确;
D.共价晶体中可以存在极性共价键,如二氧化硅,故D错误。
下列关于晶体的说法正确的是( )A. 分子晶体中一定含共价键
B. 晶体中的配位数为
C. 晶体中每个原子与个原子以单键结合
D. 金属晶体的熔点一定比原子晶体低,一定比分子晶体高【答案】C 【解析】解:分子晶体中的每个分子内不一定含有共价键,如稀有气体形成的分子晶体中不存在化学键,故A错误;
B.属于简单立方晶胞,个或位于立方体的八个顶点,立方体中心为或,所以每个的周围,有个,每个周围有个;即正负离子的配位数均为,故B错误;
C.晶体中每个原子与个原子以共价键结合,故C正确;
D.金属钨的熔点高于原子晶体硅的熔点;分子晶体碘常温下为固态,而金属汞为液态,故D错误;
故选C。
本题考查化学键、晶体类型、熔沸点的比较,熟悉常见物质中的化学键并能举例即可解答,题目难度不大。
下列关于晶体的说法正确的组合是( )
分子晶体中都存在共价键
在晶体中只要有阳离子就一定有阴离子
金刚石、、、、、晶体的熔点依次降低
离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
晶体中晶胞结构如图所示每个和个相紧邻
晶体中每个硅原子与两个氧原子以共价键相结合
晶体中分子间作用力越大,分子越稳定
氯化钠熔化时离子键被破坏A. B. C. D. 【答案】D 【解析】稀有气体属于分子晶体,其中不存在共价键,只有分子间作用力,故错误;
晶体只要有阴离子就一定有阳离子,但含有阳离子的不一定有阴离子,如金属晶体,故错误;
晶体中熔点高低一般顺序是:原子晶体离子晶体分子晶体;在原子晶体中,原子半径越大熔点越低;在离子晶体中,离子半径越大,熔点越低,电荷越多,熔点越高;在分子晶体中,物质的熔点与相对分子质量成正比含有氢键的物质除外,所以这几种物质的熔点高低顺序是:金刚石、、、、、,故正确;
离子晶体中一定含有离子键,可能含有共价键,如等,分子晶体的构成微粒是分子,分子晶体中只含共价键不含离子键,故错误;
晶体中处在顶点处,处于面心处,处于体心处,故每个和个相紧邻,故正确;
原子晶体中非金属原子之间的作用力为共价键,则晶体中每个硅原子能形成个共价键,则每个与个氧原子以共价键相结合,故错误;
分子的稳定性属于化学性质,与共价键有关,分子间作用力与稳定性无关,故错误;
氯化钠晶体中只有离子键,则氯化钠熔化时离子键被破坏,故正确;
正确的有,故D正确。
故选D。 高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为价,部分为价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是 ( )A. 超氧化钾的化学式为,每个晶胞含有个和个
B. 晶体中每个周围有个紧邻,每个周围有个紧邻
C. 晶体中与每个距离最近的有个
D. 晶体中与每个距离最近的有个【答案】A 【解析】由晶胞图可知,的个数为,的个数为,故化学式为,故A正确;
由晶胞图可知,晶体中每个周围有个,每个周围有个,故B错误;
由晶胞图可知,与顶点距离最近的分别位于相邻三个面的面心,则晶体中与每个距离最近的有个个,故C错误;
由晶胞图可知,晶体中与每个距离最近的有个,故D错误。
下列有说法不正确的是( )A. 离子晶体的晶格能是气态离子形成晶胞时放出的能量
B. 固体不导电,熔融状态下能导电的化合物中一定存在离子键
C. 钠晶胞结构如图,钠晶胞中每个钠原子的配位数为
D. 温度升高,金属的导电性将变弱【答案】A 【解析】A.晶格能是标准状况下,气态离子形成离子晶体释放的能量,注意必须是气态离子,形成晶体而非晶胞,故A错误;
B.固体不导电、熔融状态下能导电的化合物一定是离子化合物,离子化合物中一定存在离子键,故B正确;
C.根据钠晶胞的结构图可知,为体心立方堆积,每个钠原子周围距离最近的钠原子有个,则钠晶胞中每个钠原子的配位数为,故C正确;
D.温度升高,金属离子与电子之间碰撞加剧,金属导电性变弱,故D正确.
故选A。 已知的晶胞和类似,如图所示,其中与距离最近的围成的图形的体积为,表示阿伏伽德罗常数,则晶体的密度为
A. B. C. D. 【答案】C 【解析】其中与距离最近的围成的图形的体积为,表示阿伏伽德罗常数,根据公式,,根据均摊法计算,代入数据,则,故C正确。
故选C。 根据所学知识,回答下列问题:硅与氢结合能形成一系列的二元化合物、等,与氯、溴结合能形成、,、、三种物质的沸点由高到低顺序为_________,丁硅烯中键与键个数之比为_________。、、都是半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化的原因____________________________。物质熔点的晶胞结构如图所示。已知六棱柱底边边长为,设阿伏加德罗常数的值为。从晶胞中“分割”出的平行六面体如图所示。若该平行六面体的体积为,则晶体的密度为_________。用含、的式子表示【答案】 原子半径:,键长:,键能:,故熔点依次降低 【解析】、、均为分子晶体,组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,沸点越高,故沸点:。丁硅烯与丁烯结构类似,分子中有个键,个键、个键,则分子中键与键个数之比为。
原子半径:,键长:,键能:,故熔点依次降低。
晶胞中原子个数为,原子个数为,所以该晶胞的质量为,由平行六面体的体积可知,该晶胞的体积为,晶体的密度为。
相关学案
这是一份专题02 分子结构与性质——2022-2023学年高一化学下学期期末知识点精讲+训练学案+期末模拟卷(沪科版2020选择性必修2),文件包含专题02分子结构与性质解析版docx、专题02分子结构与性质原卷版docx等2份学案配套教学资源,其中学案共34页, 欢迎下载使用。
这是一份专题01 原子结构与性质 ——2022-2023学年高一化学下学期期末知识点精讲+训练学案+期末模拟卷(沪科版2020选择性必修2),文件包含专题01原子结构与性质解析版docx、专题01原子结构与性质原卷版docx等2份学案配套教学资源,其中学案共37页, 欢迎下载使用。
这是一份期末模拟题(二)——2022-2023学年高一化学下学期期末知识点精讲+训练学案+期末模拟卷(沪科版2020必修第二册),文件包含期末模拟题二2022-2023学年高一化学下学期期末知识点精讲+训练学案+期末模拟卷沪科版2020必修第二册解析版docx、期末模拟题二2022-2023学年高一化学下学期期末知识点精讲+训练学案+期末模拟卷沪科版2020必修第二册原卷版docx等2份学案配套教学资源,其中学案共27页, 欢迎下载使用。









