
北京市高一下学期化学期末考前专项练习-03判断、推断题
展开北京市高一下学期化学期末考前专项练习-03判断、推断题
一、判断题
1.(北京市怀柔区2021-2022学年高一下学期期末化学试题)阅读短文,回答问题。
2022年冬奥会在北京举行,2022年北京冬奥会“飞扬”火炬主要分为外飘带、内飘带和氢气燃烧装置3个部分。
火炬“飞扬”的外飘带用碳纤维从经向、纬向、法向三个维度编织,然后与耐高温的第三代聚硅氮烷树脂形成碳纤维复合材料。专家评价“飞扬”具备轻、固、美的特点。
碳纤维还被应用于北京冬奥会的其他方面。雪车被称为“冰上F1”,是名副其实的冬奥会“速度之王”。为了让雪车车身材料质量更轻,强度更高,本次参会的中国选手驾驶的“中国红”国产雪车应用宇航级别的碳纤维复合材料。此外,碳纤维还被成功应用于奥运雪车头盔制作等。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)
(1)火炬“飞扬”外飘带使用了复合材料。_______
(2)碳纤维复合材料密度小、强度高。_______
(3)冬奥会火炬使用的燃料为甲烷。_______
(4)火炬“飞扬”“固”的特点与使用三个维度编织法相关。_______
2.(北京市海淀区2021-2022学年高一下学期适应性模拟测试化学试题)北京是世界首个“双奥之城”。(____)
3.(北京市海淀区2021-2022学年高一下学期适应性模拟测试化学试题)丙烷、氢气燃烧都会产生二氧化碳。(____)
4.(北京市海淀区2021-2022学年高一下学期适应性模拟测试化学试题)碳纤维复合材料的火炬外壳有“轻、固、美”的特点。(____)
二、有机推断题
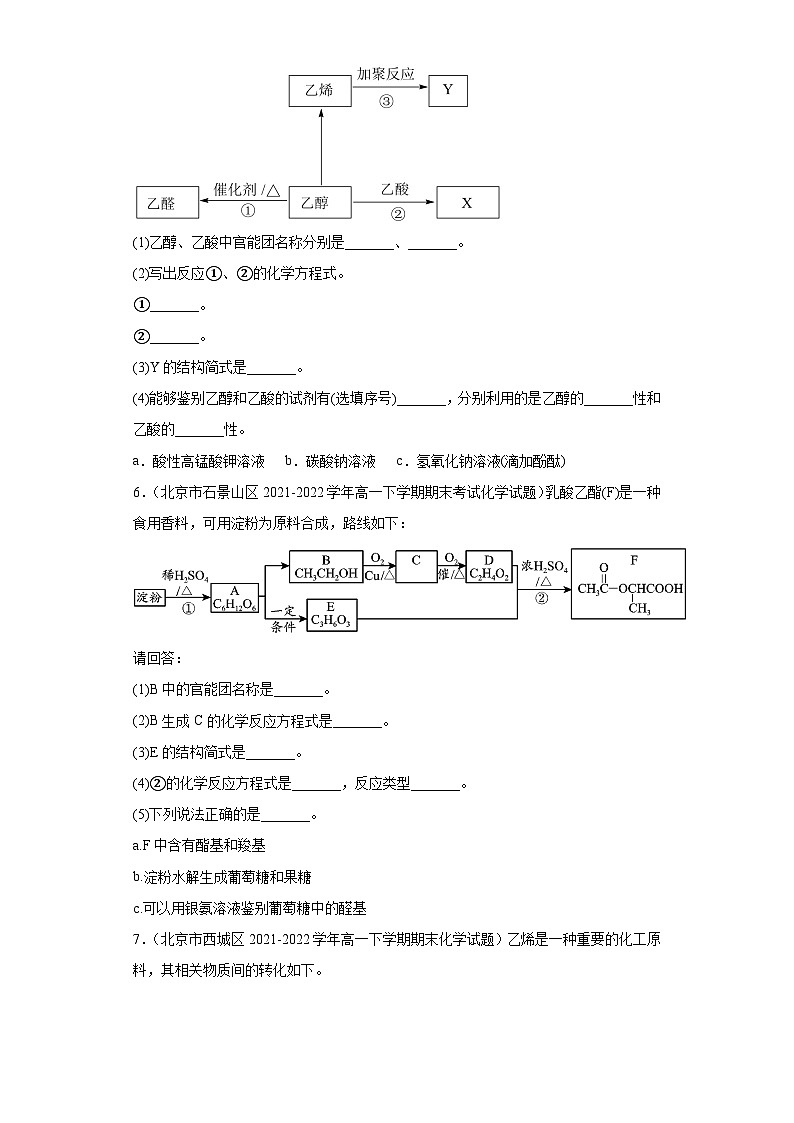
5.(北京市昌平区2021-2022学年高一下学期期末质量抽测化学试题)乙醇和乙酸是生活中的两种常见物质,有以下反应。
(1)乙醇、乙酸中官能团名称分别是_______、_______。
(2)写出反应①、②的化学方程式。
①_______。
②_______。
(3)Y的结构简式是_______。
(4)能够鉴别乙醇和乙酸的试剂有(选填序号)_______,分别利用的是乙醇的_______性和乙酸的_______性。
a.酸性高锰酸钾溶液 b.碳酸钠溶液 c.氢氧化钠溶液(滴加酚酞)
6.(北京市石景山区2021-2022学年高一下学期期末考试化学试题)乳酸乙酯(F)是一种食用香料,可用淀粉为原料合成,路线如下:
请回答:
(1)B中的官能团名称是_______。
(2)B生成C的化学反应方程式是_______。
(3)E的结构简式是_______。
(4)②的化学反应方程式是_______,反应类型_______。
(5)下列说法正确的是_______。
a.F中含有酯基和羧基
b.淀粉水解生成葡萄糖和果糖
c.可以用银氨溶液鉴别葡萄糖中的醛基
7.(北京市西城区2021-2022学年高一下学期期末化学试题)乙烯是一种重要的化工原料,其相关物质间的转化如下。
(1)CH2=CH2→B的反应类型是_______。
(2)C→D的化学方程式是_______。
(3)D中含有的官能团的名称是_______。
(4)C和E生成C4H8O2的化学方程式是_______。
(5)CH2=CH2在一定条件下发生聚合反应生成A,化学方程式是_______。
8.(北京朝阳区2021-2022学年高一下学期期末考试化学试题)丙烯酸丙酯是一种常见的化工原料,可用于制备聚合物防水涂料,一定条件下的转化关系如下图。
(1)丙烯→A的反应类型是_______。
(2)B的官能团有_______。
(3)区分A、B两种物质的方法是_______。
(4)A与B反应的化学方程式是_______。
(5)D的结构简式是_______。
(6)推测D可能的物理性质和化学性质:_______(物理性质和化学性质各1条)。
三、元素或物质推断题
9.(北京市昌平区2021-2022学年高一下学期期末质量抽测化学试题)元素周期律、表的学习具有重要意义。
Ⅰ.下表是元素周期表的一部分,请参照元素①~⑦在表中的位置,回答下列问题:
族周期 | I |
|
|
|
|
|
| 0 |
1 |
| II | III | IV | VA | VI | VII |
|
2 |
|
|
|
| ① | ② |
|
|
3 | ③ | ④ |
|
|
| ⑤ | ⑥ |
|
4 | ⑦ |
|
|
|
|
|
|
|
(1)①的氢化物的电子式是是_______,⑦的原子结构示意图是_______。
(2)③和④的金属性强弱关系是(用元素符号表示)_______,从原子结构角度解释原因_______,以下事实能反映其强弱关系的是(选填字母)_______。
a.常温下单质与水反应置换出氢气的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
d.单质还原性强弱
(3)任意写出一种②和⑤形成的化合物的化学式_______,其中化合价为正的元素是(写元素符号)_______,原因是_______。
(4)⑥的最高价氧化物的化学式是_______,写出其与水反应的化学方程式_______。
(5)硒(Se)位于第四周期,与②同主族。下列推断正确的是_______。
a.SeO2只具有还原性
b.Se的最低负化合价是价
c.Se的气态氢化物的稳定性比⑥的强
Ⅱ.碘及其化合物广泛用于医药、染料等方面。从含I-废水中可提取碘单质,其主要工艺流程如下:
(6)碘元素在周期表中的位置是第五周期、_______族。
(7)已知:AgI难溶于水。写出AgNO3溶液与废水中I-反应的离子方程式_______。
(8)Fe与悬浊液反应时,采用铁粉可增大化学反应速率,其原因是_______。
(9)Fe与悬浊液反应后,溶液Y中的溶质主要是FeI2,写出该反应的化学方程式_______。
(10)试剂ⅰ可能是_______
a.Zn b.H2O2 c.CCl4
10.(北京市房山区2021-2022学年高一下学期期末考试化学试题)下图是元素①~⑤在元素周期表中的位置。
|
|
|
|
|
|
|
|
① |
|
|
|
| ③ | ④ |
|
② |
|
|
|
|
| ⑤ |
|
(1)③在周期表中的位置是_______。
(2)②与③可形成一种淡黄色的化合物,该化合物与CO2反应的化学方程式是_______。
(3)比较④和⑤的非金属性,并从原子结构角度解释其原因_______。
(4)下列关于①的说法正确的是_______。
a.原子结构示意图为
b.其单质可以和水反应生成H2
c.在同主族的元素中,①的金属性最强
参考答案:
1.(1)正确
(2)正确
(3)错误
(4)正确
【解析】(1)火炬“飞扬”外飘带使用了碳纤维与树脂的复合材料,故正确。
(2)碳纤维复合材料是密度小、硬度大,具有轻巧又牢固的无机非金属材料,即碳纤维复合材料密度小、强度高。故正确。
(3)冬奥会火炬使用的燃料为氢气,故错误。
(4)火炬“飞扬”的外飘带用碳纤维从经向、纬向、法向三个维度编织,然后与耐高温的第三代聚硅氮烷树脂形成碳纤维复合材料,则火炬“飞扬”“固”的特点与使用三个维度编织法相关,故正确。
2.正确
【详解】北京是世界首个“双奥之城”,同时举办了夏季奥运会和冬季奥运会,故正确。
3.错误
【详解】丙烷燃烧产生二氧化碳和水,氢气燃烧只产生水,故错误。
4.正确
【详解】碳纤维是一种力学性能优异的新材料,它的比重不到钢的四分之一、抗拉强度一般是钢的7~9倍,而火炬外壳的形状很美,故正确。
5.(1) 羟基 羧基
(2) 2C2H5OH+O22CH3CHO+2H2O CH3COOH+C2H5OHCH3COOC2H5+H2O
(3)
(4) abc 还原 酸
【分析】乙醇与O2在Cu催化下加热,发生催化氧化反应产生乙醛和水;乙醇与乙酸在浓硫酸催化下加热发生酯化反应产生X是乙酸乙酯,同时产生水;乙醇与浓硫酸混合加热170℃,发生消去反应产生乙烯和水,乙烯分子中含有不饱和的碳碳双键,在一定条件下发生加聚反应产生Y是聚乙烯。
(1)
乙醇结构简式是C2H5OH,官能团-OH的名称是羟基;乙酸结构简式是CH3COOH,官能团-COOH的名称为羧基;
(2)
反应①是乙醇与O2在Cu催化下加热,发生催化氧化反应产生乙醛和水,该反应的化学方程式为2C2H5OH+O22CH3CHO+2H2O;
反应②是乙醇与乙酸在浓硫酸催化下加热发生酯化反应产生乙酸乙酯和水,该反应为可逆反应,反应方程式为:CH3COOH+C2H5OHCH3COOC2H5+H2O;
(3)
乙烯分子中含有不饱和的碳碳双键,在一定条件下发生加聚反应产生Y是聚乙烯就,其结构简式是;
(4)
a.乙醇具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙酸和酸性高锰酸钾溶液不反应,所以可以用酸性高锰酸钾溶液鉴别乙醇、乙酸;
b.碳酸钠溶液和乙醇不反应,和乙酸反应生成二氧化碳气体,所以可以用碳酸钠溶液鉴别乙醇和乙酸;
c.氢氧化钠溶液(滴加酚酞)和乙醇不反应,和乙酸发生中和反应而使溶液褪色,所以可以用NaOH溶液(滴加酚酞)鉴别乙醇和乙酸;
则能够鉴别乙醇和乙酸的试剂有abc;分别利用的是乙醇的还原性和乙酸的酸性。
6.(1)羟基
(2)2CH3CH2OH+O22CH3CHO+2H2O
(3)
(4) CH3COOH++H2O 酯化或取代
(5)ac
【分析】由图可知乙醇发生催化氧化生成C为CH3CHO,C进一步发生氧化反应生成D为CH3COOH,D和E发生酯化反应生成F,结合D和F可以知道E为:,淀粉水解生成A为葡萄糖,葡萄糖一定条件转化为乙醇和物质E,以此解题。
(1)
由图可知,B为乙醇,含有的官能团名称为:羟基;
(2)
物质B生成C的反应为乙醇的催化氧化,方程式为:2CH3CH2OH+O22CH3CHO+2H2O;
(3)
由分析可知,E为;
(4)
由分析可知,反应②为酯化反应,方程式为:CH3COOH++H2O;反应类型为:酯化反应或者取代反应;
(5)
a.由结构可知,F中含有酯基和羧基,故a正确;
b.淀粉水解生成葡萄糖,故b错误;
c.葡萄糖是多羟基醛,能与银氨溶液发生银镜反应,可以用银氨溶液鉴别葡萄糖中的醛基,故c正确;
故答案为ac。
7.(1)加成反应
(2)
(3)醛基
(4)
(5)n CH2=CH2
【分析】CH2=CH2在一定条件下发生聚合反应生成A为聚乙烯,乙烯与氢气发生加成反应生成为B乙烷,乙烯与水发生催化加成生成C为乙醇,乙醇催化氧化生成D为乙醛,乙醛氧化生成E为乙酸,乙酸与乙醇发生酯化反应(也属于取代反应)生成乙酸乙酯。
(1)CH2=CH2→B是乙烯与氢气发生加成反应生成乙烷,反应类型是加成反应;
(2)C→D是乙醇催化氧化生成乙醛和水,反应的化学方程式是 ;
(3)D为乙醛,含有的官能团的名称是醛基;
(4)C和E生成C4H8O2的化学方程式是;
(5)CH2=CH2在一定条件下发生聚合反应生成A,化学方程式是n CH2=CH2 。
8.(1)加成反应
(2)碳碳双键、羧基
(3)取A、B两种物质于试管中,分别加入NaHCO3溶液,产生无色无味气体的是B,无现象的是A
(4)CH2=CHCOOH+CH3CH2CH2OHCH2=CHCOOCH2CH2CH3+H2O
(5)
(6)难溶于水、可以水解
【分析】由有机物的转化关系可知,在催化剂作用下,CH3CH=CH2与水发生加成反应生成CH3CH2CH2OH,则A为CH3CH2CH2OH;在催化剂作用下,CH3CH=CH2与氧气发生氧化反应生成CH2=CHCOOH,则B为CH2=CHCOOH;在浓硫酸作用下CH2=CHCOOH与CH3CH2CH2OH共热发生酯化反应生成CH2=CHCOOCH2CH2CH3,催化剂作用下CH2=CHCOOCH2CH2CH3共热发生加聚反应生成,则D为。
(1)
由分析可知,丙烯→A的反应为在催化剂作用下,CH3CH=CH2与水发生加成反应生成CH3CH2CH2OH,故答案为:加成反应;
(2)
由分析可知,B的结构简式为CH2=CHCOOH,官能团为碳碳双键、羧基,故答案为:碳碳双键、羧基;
(3)
由分析可知,A、B的结构简式分别为CH3CH2CH2OH、CH2=CHCOOH,CH3CH2CH2OH不能与碳酸氢钠溶液反应,CH2=CHCOOH能与碳酸氢钠溶液反应生成二氧化碳,所以区分A、B两种物质的方法是取A、B两种物质于试管中,分别加入NaHCO3溶液,产生无色无味气体的是B,无现象的是A,故答案为:取A、B两种物质于试管中,分别加入NaHCO3溶液,产生无色无味气体的是B,无现象的是A;
(4)
由分析可知,A与B的反应为在浓硫酸作用下CH2=CHCOOH与CH3CH2CH2OH共热发生酯化反应生成CH2=CHCOOCH2CH2CH3和水,反应的化学方程式为CH2=CHCOOH+CH3CH2CH2OHCH2=CHCOOCH2CH2CH3+H2O,故答案为:CH2=CHCOOH+CH3CH2CH2OHCH2=CHCOOCH2CH2CH3+H2O;
(5)
由分析可知,D的结构简式为,故答案为:;
(6)
由分析可知,D为合成高分子化合物,结构简式为,该有机物难溶于水能起到防水的作用,分子中含有的酯基能发生水解反应,故答案为:难溶于水、可以水解。
9.(1)
(2) Na>Mg 元素的金属性:Na>Mg,原子半径:Na>Mg,原子序数越大,原子半径越小,原子核吸引电子的能力逐渐增强,原子最外层电子失去的能力越弱,元素的金属性就越弱 abd
(3) SO2或SO3 S 元素的非金属性:O>S,吸引电子的能力:O>S
(4) Cl2O7 Cl2O7+H2O=2HClO4
(5)b
(6)第ⅦA
(7)Ag++I-=AgI↓
(8)用铁粉增大反应物的接触面积
(9)Fe+2AgI=FeI2+2Ag
(10)b
【分析】Ⅰ.根据元素在周期表的位置关系可知:①是N,②是O,③是Na,④是Mg,⑤是S,⑥是Cl,⑦是K元素,然后根据元素原子结构与位置关系和元素周期律分析;
Ⅱ.含有I-的废液与AgNO3溶液发生复分解反应:Ag++I-=AgI↓,产生AgI沉淀,然后向AgI悬浊液中加入Fe,发生置换反应产生FeI2和Ag单质,沉淀X中含有过量Fe及反应产生的Ag,溶液Y中含有FeI2,过滤,向滤液Y中加入加入试剂i、稀硫酸,得到I2,i应该具有氧化性,据此分析解答。
(1)
①是N,其简单氢化物是NH3,该物质分子中N原子与3个H原子形成3个N-H共价键,使物质分子中各个原子都达到稳定结构,其电子式为:;
⑦是K元素,原子核外电子排布是2、8、8、1,因此其原子结构示意图是;
(2)
③是Na,④是Mg,二者是同一周期元素,原子核外电子层数相同。由于同一周期元素,原子序数越大,原子半径越小,原子失去电子的能力越弱,元素的金属性就越弱,故Na、Mg两种元素中金属性强弱关系为:Na>Mg;
a.元素的金属性越强,在常温下其单质与H2O反应置换出氢气就越容易,故可以常温下单质与水反应置换出氢气的难易程度判断元素金属性的强弱,a正确;
b.元素的金属性越强,其最高价氧化物的水化物碱性越强,所以可以根据最高价氧化物对应的水化物的碱性强弱判断金属性强弱,b正确;
c.相同温度下,最高价氧化物对应的水化物的溶解度大小,与金属性强弱无关,不能据此判断元素金属性强弱,c错误;
d.元素的金属性越强,其单质的还原性越强,所以可以根据单质还原性强弱判断金属性强弱,d正确;
故合理选项是abd;
(3)
②和⑤形成的化合物有SO2、SO3,元素的吸引电子能力越强,该元素化合物中就呈负化合价,吸引电子能力弱的元素,其在化合物中呈现正化合价。由于元素的非金属性O>S,吸引电子的能力:O>S,所以化合价为正的元素是S、化合价为负的元素是O;
(4)
⑥是Cl,原子最外层有7个电子,则⑥的最高价正化合价为+7价。O元素化合价为-2价,据此书写其最高价氧化物的化学式为Cl2O7,该物质与水反应生成HClO4,反应方程式为:Cl2O7+H2O=2HClO4;
(5)
a.SeO2中Se元素化合价为+4价,处于Se元素的中间价态,既有氧化性又有还原性,a错误;
b.Se和S位于同一主族,原子最外层电子数相同,其最低负化合价相同,所以Se的最低负化合价是-2价,b正确;
c.Se、Cl是同一周期元素,元素的非金属性:Se<Cl,元素的非金属性越强,其简单氢化物的稳定性就越强,所以Se的气态氢化物的稳定性比⑥的弱,c错误;
故合理选项是b;
(6)
I是53号元素,原子核外电子排布是2、8、18、18、7,在元素周期表中位于第五周期第ⅦA族;
(7)
Ag+和I-反应生成难溶性的AgI,离子方程式为:Ag++I-=AgI↓;
(8)
反应物的接触面积越大,反应速率越快,用铁粉能增大反应物的接触面积,所以加快化学反应速率;
(9)
Fe与悬浊液反应后,溶液Y中的溶质主要是FeI2,根据反应物和生成物书写化学方程式为:Fe+2AgI=FeI2+2Ag;
(10)
试剂i具有氧化性,能氧化碘离子生成碘单质,在题目已知的这几种物质中,只有H2O2能氧化I-生成I2,故合理选项是b。
10.(1)第2周期VIA族
(2)2Na2O2+2CO2=2Na2CO3+ O2
(3)④>⑤ 两种元素位于同一主族,最外层电子数相同,电子层数F小于Cl,原子半径F小于Cl,得电子能力F大于Cl,非金属性F大于Cl
(4)ab
【分析】根据元素在元素周期表中的位置,以及②与③可形成一种淡黄色的化合物可知,①为Li,②为Na,③为O,④为F,⑤为Cl,据此分析来解题。
(1)③为O,在与周期表中的位置是第2周期第ⅥA族,故答案为第2周期第ⅥA族;
(2)②与③可形成一种淡黄色的化合物,该化合物为Na2O2,与CO2反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+ O2,故答案为2Na2O2+2CO2=2Na2CO3+ O2;
(3)非金属强弱与得电子的难易程度有关,⑤氯元素与④氟元素相比,两种元素位于同一主族,最外层电子数相同,电子层数多,原子半径大,故原子核对最外层电子的吸引能力比较弱,所以非金属性氯比氟弱,故答案为:④>⑤,两种元素位于同一主族,最外层电子数相同,电子层数F小于Cl,原子半径F小于Cl,得电子能力F大于Cl,非金属性F大于Cl金属性比氟弱;
(4)a.①为Li,核电荷数为3,其原子结构示意图为,a项正确;b.Li为活泼碱金属元素,其单质可以和水反应生成H2,同时生成LiOH,b项正确;c.同主族元素从上到下金属性逐渐增强,则在同主族的元素中,①的金属性不是最强的,c项错误;故答案为:ab;
浙江省高一下学期化学期末考前专项练习-01非选择题1(填空题、有机推断): 这是一份浙江省高一下学期化学期末考前专项练习-01非选择题1(填空题、有机推断),共18页。试卷主要包含了填空题,有机推断题等内容,欢迎下载使用。
广西高一下学期化学期末考前专项练习-非选择题2: 这是一份广西高一下学期化学期末考前专项练习-非选择题2,共26页。试卷主要包含了实验题,工业流程题,原理综合题,有机推断题,元素或物质推断题,填空题等内容,欢迎下载使用。
广西高一下学期化学期末考前专项练习-非选择题1: 这是一份广西高一下学期化学期末考前专项练习-非选择题1,共31页。试卷主要包含了填空题,实验题,元素或物质推断题,有机推断题,工业流程题,原理综合题等内容,欢迎下载使用。