
2021北京十一学校高二(上)期末III课程化学
展开
这是一份2021北京十一学校高二(上)期末III课程化学,共10页。试卷主要包含了下列过程中,水的电离被抑制的是等内容,欢迎下载使用。
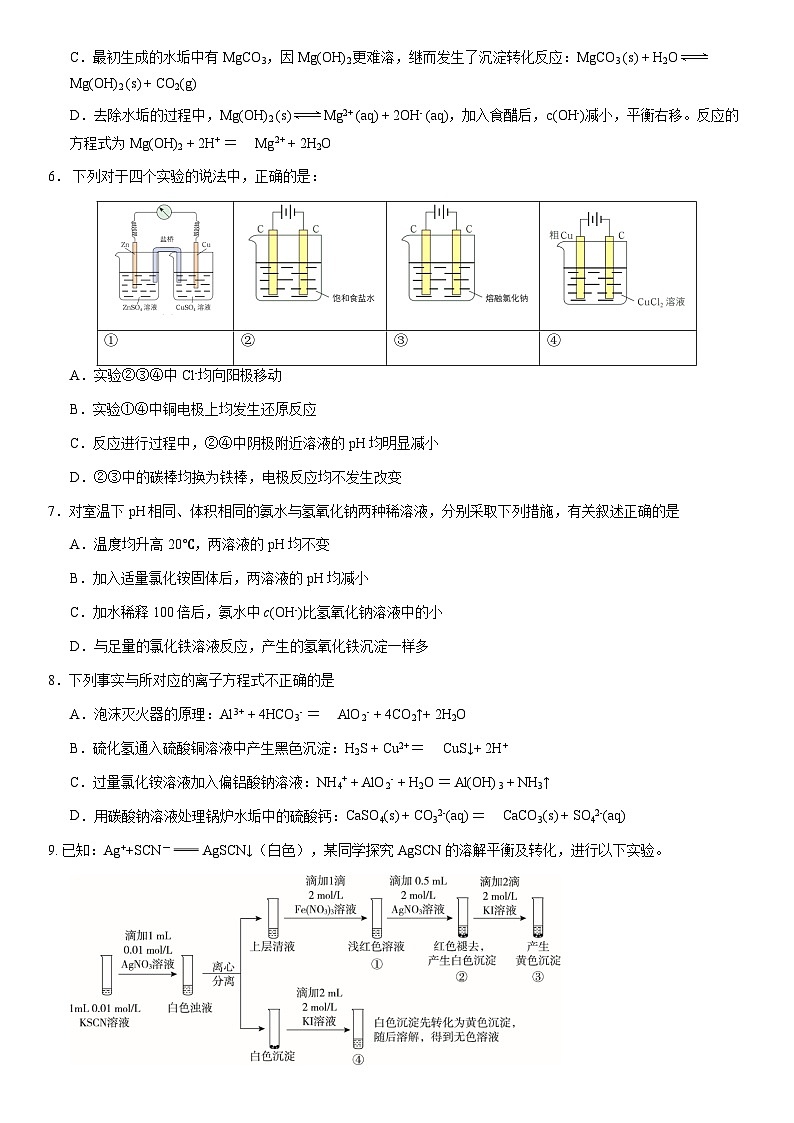
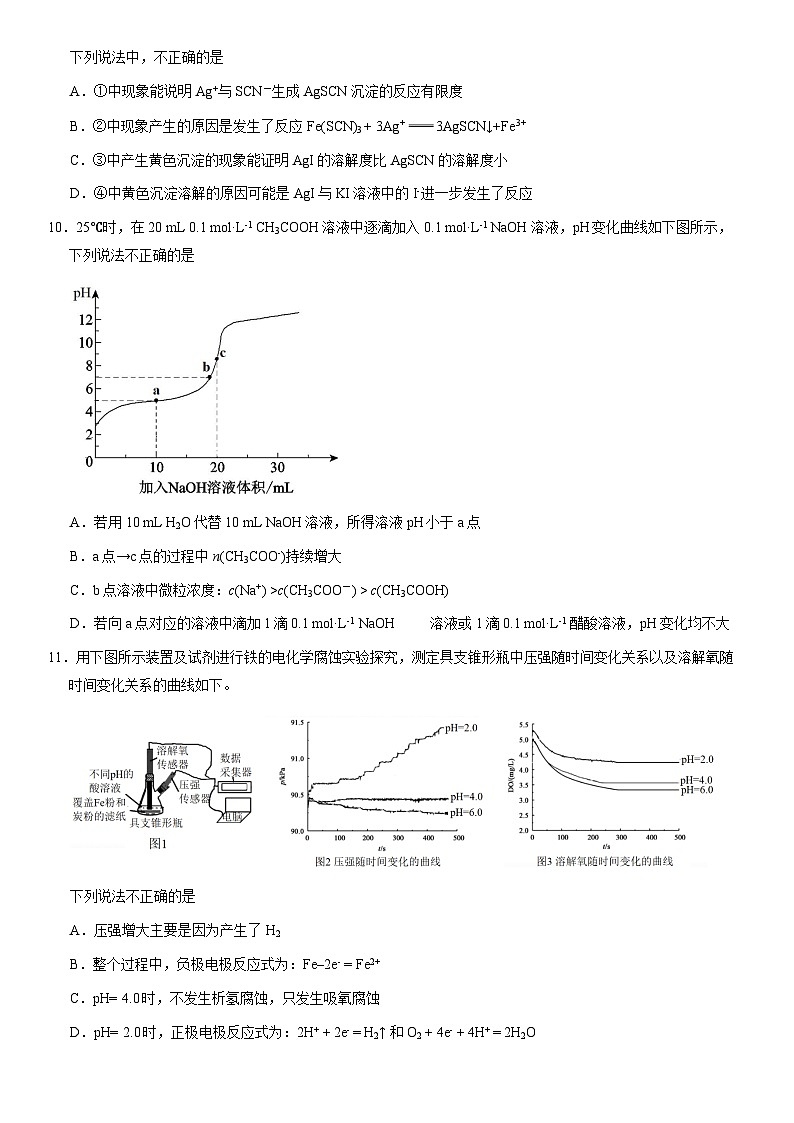
2021北京十一学校高二(上)期末III课程化 学总分:100分 时间:90分钟 诊断设计者:孙龙第一部分本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一项。1.下列化学应用中,不包含化学能向其他能量形式转化的是A.用炸药炸开山体采矿B.多晶硅组成的太阳能电池板 C.氧化银、锌粉、氢氧化钾组成的纽扣电池D.铁粉、蛭石、活性炭、无机盐组成的“暖宝宝”2.下列方法中,没有利用盐类水解原理的是A.保存硫酸亚铁溶液时加入铁粉B.用氯化铵溶液清洗铁器表面的铁锈C.用热纯碱溶液清洗厨房油污D.饱和氯化铁溶液滴入沸水中制备氢氧化铁胶体3.下列过程中,水的电离被抑制的是:A.电解饱和食盐水制备Cl2B.将Na投入水中,反应得到NaOH溶液C.将浓硫酸注入蒸馏水中稀释,得到稀硫酸D.常温下,在蒸馏水中加入醋酸铵固体,得到pH = 7的溶液4.下列各离子组在指定的溶液中一定能够大量共存的是A.无色溶液中:Cu2+、K+、SCN−、Cl− B.含有NO3−的溶液中:I−、SO32−、SO42−、H+ C.由水电离出的c(H+)=1.0×10−13 mol·L−1的溶液中:Na+、NH4+、SO42−、HCO3−D.pH=11的NaOH溶液中:CO32−、K+、NO3−、SO42− 5.硬水煮沸后水垢的产生以及用食醋去除水垢的过程中涉及多个转化及平衡,对整个过程分析不正确的是:A.硬水煮沸的过程中,HCO3-H+ + CO32-,HCO3- + H2O H2CO3 + OH-,两个平衡均被促进B.加热过程中,c(CO32-)增大,当满足c(CO32-)·c(Ca2+) > Ksp(CaCO3)时,产生CaCO3沉淀C.最初生成的水垢中有MgCO3,因Mg(OH)2更难溶,继而发生了沉淀转化反应:MgCO3 (s) + H2OMg(OH)2 (s) + CO2(g)D.去除水垢的过程中,Mg(OH)2 (s)Mg2+ (aq) + 2OH- (aq),加入食醋后,c(OH-)减小,平衡右移。反应的方程式为Mg(OH)2 + 2H+ = Mg2+ + 2H2O6. 下列对于四个实验的说法中,正确的是:①②③④A.实验②③④中Cl-均向阳极移动B.实验①④中铜电极上均发生还原反应C.反应进行过程中,②④中阴极附近溶液的pH均明显减小D.②③中的碳棒均换为铁棒,电极反应均不发生改变7.对室温下pH相同、体积相同的氨水与氢氧化钠两种稀溶液,分别采取下列措施,有关叙述正确的是A.温度均升高20℃,两溶液的pH均不变 B.加入适量氯化铵固体后,两溶液的pH均减小 C.加水稀释100倍后,氨水中c(OH-)比氢氧化钠溶液中的小D.与足量的氯化铁溶液反应,产生的氢氧化铁沉淀一样多8.下列事实与所对应的离子方程式不正确的是A.泡沫灭火器的原理:Al3+ + 4HCO3- = AlO2- + 4CO2↑+ 2H2OB.硫化氢通入硫酸铜溶液中产生黑色沉淀:H2S + Cu2+ = CuS↓+ 2H+C.过量氯化铵溶液加入偏铝酸钠溶液:NH4+ + AlO2- + H2O = Al(OH)3 + NH3↑D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s) + CO32-(aq) = CaCO3(s) + SO42-(aq)9. 已知:Ag++SCN- AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。下列说法中,不正确的是A.①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度B.②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ 3AgSCN↓+Fe3+C.③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小D.④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应10.25℃时,在20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,pH变化曲线如下图所示,下列说法不正确的是A.若用10 mL H2O代替10 mL NaOH溶液,所得溶液pH小于a点B.a点→c点的过程中n(CH3COO-)持续增大C.b点溶液中微粒浓度:c(Na+) >c(CH3COO-) > c(CH3COOH)D.若向a点对应的溶液中滴加1滴0.1 mol·L-1 NaOH 溶液或1滴0.1 mol·L-1 醋酸溶液,pH变化均不大11.用下图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。下列说法不正确的是A.压强增大主要是因为产生了H2B.整个过程中,负极电极反应式为:Fe–2e- = Fe2+C.pH= 4.0时,不发生析氢腐蚀,只发生吸氧腐蚀D.pH= 2.0时,正极电极反应式为:2H+ + 2e- = H2↑ 和 O2 + 4e- + 4H+ = 2H2O12.利用小粒径零价铁(ZVI)的电化学腐蚀处理Cr2O72-,进行水体修复的过程如图所示。H+、O2、NO3_ 等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法不正确的是A.反应①②③④均在正极发生B.④的电极反应式为NO3_ + 10H+ + 8e_ = NH4+ + 3H2OC.增大单位体积水体中小微粒ZVI的投入量,可使nt增大D.单位时间内,处理 a mol Cr2O72- 时ne = 3a mol13.已知[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色,NO3-不与Co2+形成配合物。现将一定物质的量的CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2+ + 4Cl- [CoCl4]2- + 6H2O 用该溶液做实验,溶液的颜色变化如下:以下结论和解释不正确的是A.由实验①可推知△H > 0B.实验②稀释过程中平衡逆向移动,可以由Q < K做出判断C.由实验③可知配离子的稳定性:[ZnCl4]2- > [CoCl4]2-D.若向蓝色溶液中加入少量AgNO3固体,可以看到形成白色沉淀,溶液变为粉红色14.加热MnO2和4 mol·L-1稀盐酸混合物无明显现象,实验小组设计了实验I和实验II进行探究。实验I:如下图所示实验II:用右图装置(a、b均为石墨电极)进行实验:ⅰ.K闭合时,指针向左偏转ⅱ.向右管中滴加浓H2SO4至c(H+)≥7 mol·L-1,指针偏转幅度变化不大ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7 mol·L-1,指针向左偏转幅度增大依据实验结果,下列说法不正确的是:A.通过实验I,可以说明增大Cl-和H+浓度都可以促进Cl2的产生B.通过对比实验I中的i和ii,可知MnO2氧化盐酸的反应中c(H+)变化的影响小于c(Cl-)C.通过对比实验II中的i、ii、iii,可知Cl-的还原性与c(H+)无关;MnO2的氧化性随c(H+)增大而增强D.若在实验II装置右管中滴入少量AgNO3固体,则指针向左偏转幅度减小 (考生务必将答案填涂在答题卡上,在试卷上作答无效)
第二部分本部分共 5 题,共 58 分。15.(11分)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径≤2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。对PM2.5、SO2、NOx等进行研究对解决大气污染具有重要意义。(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:离子K+Na+NHSONOCl-浓度(mol·L-1)4×10-66×10-62×10-54×10-53×10-52×10-5根据表中数据计算溶液中c(H+) = ________,试样的pH = ________。(2)已知电离常数:Ka(HNO2) = 7.1×10-4, K a(CH3COOH) = 1.8×10-5。据此数据写出一个强酸制弱酸的离子方程式________,浓度均为0.1 mol/L的NaNO2溶液和CH3COONa溶液,碱性较大的是________。 (3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3。①NaHSO3的水溶液呈酸性,结合化学用语解释原因:________。②相同条件下,同浓度的NaHSO3、NH4HSO3两种酸式盐的水溶液中c(SO32-)较小的是________。③向NaHSO3溶液中加入少量的I2,发生反应的离子方程式为________,溶液中将________(填“增大”“减小”或“不变”)。16.(11分)甲烷(CH4)燃料电池使用O2作氧化剂。(1)以30%的KOH溶液为电解质溶液,设计甲烷燃料电池,画出电池的装置图,标明正负极、电极材料及所使用的试剂名称。(2)请写出不同电解质体系中的负极的电极反应方程式。① 以30%的KOH溶液为电解质:________。②以稀硫酸为电解质:________。③以熔融态Li2CO3-Na2CO3 混合熔盐为电解质(正极气体为O2+CO2):________。④以ZrO2为固体电解质(O2-离子迁移导电):________。17. (11分)Na2CO3和NaHCO3在生产和生活中有广泛应用,结合它们的性质回答下列问题。(1)将0.2 mol/L的Na2CO3溶液和0.3 mol/L 的NaHCO3溶液等体积混合,下列关系正确的是________。(填序号)①c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)②5c(Na+)=7c(H2CO3)+7c(HCO3-)+7c(CO32-)③c(Na+) > c(CO32-) > c(HCO3-) > c(OH-) > c(H+)
(2)我国化学家侯德榜发明的“侯氏制碱法”联合合成氨工业生产纯碱和氮肥,工艺流程图如下。碳酸化塔中的反应:NaCl + NH3 + CO2 + H2O == NaHCO3↓ + NH4Cl。盐的溶解度(g/100gH2O)随温度变化的数据溶解度/g0 ℃10 ℃20 ℃30 ℃40 ℃NaCl35.735.835.936.336.6NH4Cl29.433.237.241.445.8NaHCO378.19.611.112.7NH4HCO311.916.121.728.436.6①结合物质性质和平衡原理,解释NaCl溶液中先吸氨,再碳酸化的原因 。②卢沟桥事变后,范旭东、侯德榜等将工厂从天津塘沽迁至四川。四川没有廉价的海盐,只能使用从深井中吊上来的低浓度的“井盐水”,因此提高NaCl的利用率成为生产过程中的关键问题。碱母液储罐中存在的离子有Cl-、Na+、CO32-、H+、OH-、 、 。③侯德榜先生通过依次向碱母液储罐中通NH3、降温“冷析”、加NaCl“盐析”三步达到对母液中NaCl的循环利用及获得氯化铵产物的目的。i. 向碱母液储罐中通NH3,目的是①降低HCO3-的浓度,② 。ii. 如果先降温“冷析”或加NaCl“盐析”,后通入NH3,会出现的问题是 。iii. 回转焙烧炉中发生反应的化学方程式是 。iv. 结合平衡移动原理解释降温“冷析”和加NaCl“盐析”的作用 。18.(11分)某实验小组同学依据资料深入探究Fe3+在水溶液中的一些变化。资料:i.Fe3+ 在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;[Fe(H2O)6]3+ 发生如下水解:[Fe(H2O)6]3+(近无色) + nH2O [Fe(H2O)6-n(OH)n](3-n)+(棕黄色) + nH3O+(n = 1~6);ii. [FeCl4(H2O)2]-为黄色。【实验I】见图1图1(1)实验I中,试管②溶液变无色的原因是________。(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是________。【实验II】分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。图2:Fe(NO3)3溶液透光率随温度变化曲线 图3:FeCl3溶液透光率随温度变化曲线(3)用平衡移动原理解释图2中开始加热后,溶液透光率减小的原因________。(4)对比图2、图3可知,升高相同温度时,________(填“Fe(NO3)3”或“FeCl3”)溶液的颜色变深更明显。该溶液中浓度增大的离子是H+、________、________。(5)分析上述现象可推知:FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]- + 4H2O [Fe(H2O)6]3+ + 4Cl-,做出判断的理由是________。(6) 实验小组同学另外设计了一个实验证实了FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]- + 4H2O [Fe(H2O)6]3+ + 4Cl-。实验方案:________,则说明该可逆反应存在。
19.(14分)(1)某实验小组利用石墨作电极完成图1和图2的实验:按照图1进行实验,发现:a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化。① a、d处的电极反应式为_________。② 用化学用语解释b处产生的现象:_________,_________。③ 小组同学猜测c处的电极反应式为Fe − 2e− = Fe2+。为了证实猜想,他们进行如下实验:将铁丝移除后,在c处滴加________(填试剂),观察到________(填现象),说明猜测正确。图1图2在图1所示实验的基础上,实验小组改用图2的装置进行实验。实验过程可以观察到两个石墨电极a、b附近有气泡产生;n侧有气泡产生。④ 石墨电极b的电极反应式为________。⑤ 结合图1实验中的结果,写出图2实验中铜珠x、y侧的电极反应式:________。⑥ 结合上述分析过程,推测m处的实验现象是开始产生气泡,一段时间后________。(2)电解质溶液导电的本质是阴阳离子在电场作用下迁移。某实验小组通过实验探究同一溶液中不同离子的迁移速率对总电流贡献的差异。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验。a、b、c、d均为石墨电极,电极间距4.0 cm。电解电流0.20 mA。时间试纸I试纸II1 mina极附近试纸变红,b极附近试纸变蓝。c极附近试纸变红,d极附近试纸变蓝。10 min红色区和蓝色区不断向中间扩展,相遇时红色区约2.7 cm,蓝色区约1.3 cm。两极颜色范围扩大不明显,试纸大部分仍为黄色。① 试纸I、II构成串联电路,目的是保证________相同。② 对比试纸I、II的实验现象,指出导致试纸I、II现象不同的因素是______。③ 相同浓度时,H+的导电能力________OH–的导电能力(填“<”或“>”),判断依据为:________。④ 预测10 min后试纸I的现象:________。 (考生务必将答案答在答题卡上,在试卷上作答无效)
相关试卷
这是一份北京市十一学校2022-2023高二下学期期末化学试卷及答案,共10页。
这是一份2021北京三十一中高二(上)期中化学(教师版),共17页。试卷主要包含了5 Cu 64, 下列对化学反应的认识错误的是, 下列热化学方程式书写正确的是,6 kJ/ml,4kJ/ml,则含20,33 kJ/ml,9kJ·ml-1D等内容,欢迎下载使用。
这是一份2021北京海淀高二(上)期末化学(教师版),共12页。试卷主要包含了01等内容,欢迎下载使用。









