

所属成套资源:2023版新教材高中化学苏教版选择性必修1全册训练题
- 2023版新教材高中化学专题3水溶液中的离子反应第一单元弱电解质的电离平衡第1课时强电解质和弱电解质课时作业苏教版选择性必修1 试卷 0 次下载
- 2023版新教材高中化学专题3水溶液中的离子反应第一单元弱电解质的电离平衡第2课时弱电解质的电离平衡课时作业苏教版选择性必修1 试卷 0 次下载
- 2023版新教材高中化学专题3水溶液中的离子反应第三单元盐类的水解第1课时盐类水解的原理课时作业苏教版选择性必修1 试卷 0 次下载
- 2023版新教材高中化学专题3水溶液中的离子反应第三单元盐类的水解第2课时盐类水解的影响因素及应用课时作业苏教版选择性必修1 试卷 0 次下载
- 2023版新教材高中化学专题3水溶液中的离子反应第二单元溶液的酸碱性第1课时溶液的酸碱性课时作业苏教版选择性必修1 试卷 0 次下载
苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡第3课时当堂达标检测题
展开
这是一份苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡第3课时当堂达标检测题,共6页。试卷主要包含了25 ℃时,水的电离达到平衡,87等内容,欢迎下载使用。
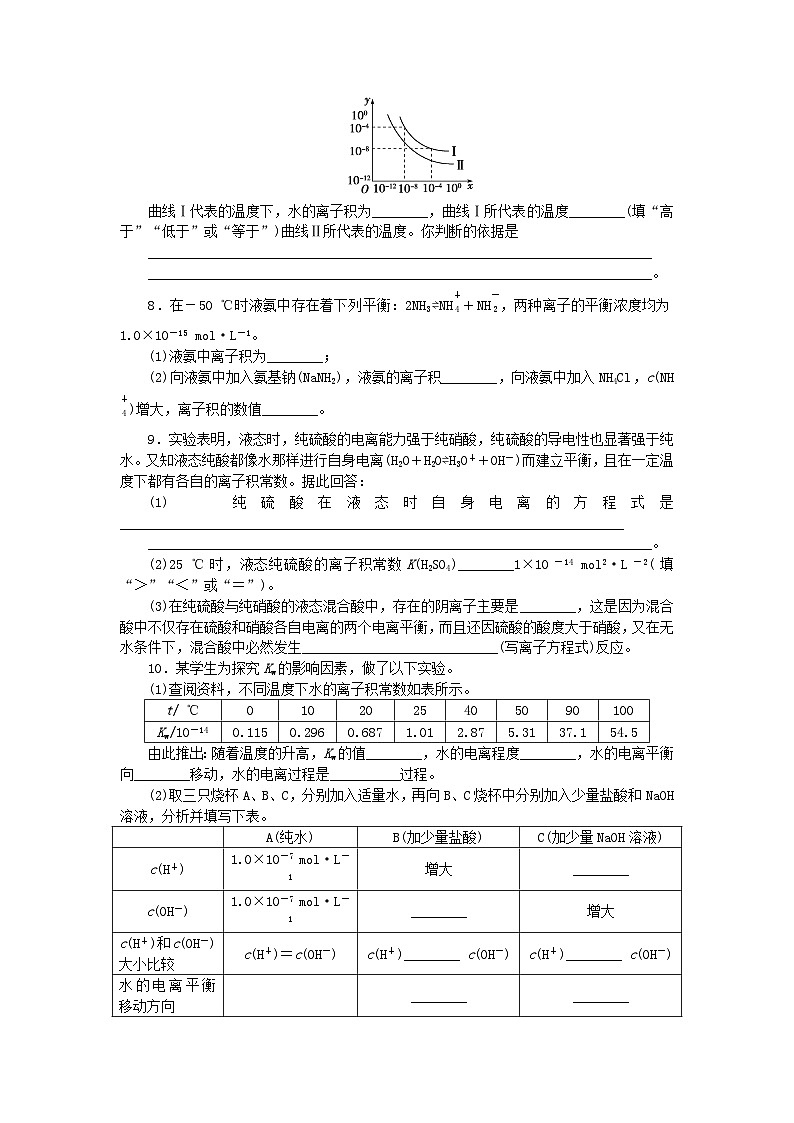
第3课时 水的电离平衡必备知识基础练进阶训练第一层知识点一水的离子积1.关于水的离子积常数,下列说法不正确的是( )A.100 ℃水中,c(H+)·c(OH-)=1×10-14B.纯水中,25 ℃时,c(H+)·c(OH-)=1×10-14C.25 ℃时,任何以水为溶剂的稀溶液中c(H+)·c(OH-)=1×10-14D.Kw值随温度升高而增大2.关于水的离子积常数Kw与水的电离平衡常数Kc的叙述中,正确的是( )A.Kw和Kc都随温度的升高而减小B.Kw和Kc数值不同,但单位相同C.Kw和Kc数值相同,但单位不同D.Kw和Kc数值和单位都不同 知识点二根据离子积常数进行计算3.常温下,某溶液中由水电离的c(H+)=1×10-13 mol·L-1,该溶液可能是( )①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液A.①④ B.①②C.②③ D.③④4.在相同温度下,0.01 mol·L-1的NaOH溶液和0.01 mol·L-1的盐酸相比,下列说法正确的是( )A.由水电离出的c(H+)相等B.由水电离出的c(H+)都是1.0×10-12 mol·L-1C.由水电离出的c(OH-)都是0.01 mol·L-1D.两者都促进了水的电离 知识点三水的电离平衡5.25 ℃时,水的电离达到平衡:H2O⇌H++OH-。下列叙述错误的是( )A.向水中通入氨气,平衡逆向移动,c(OH-)增大B.向水中加入少量稀硫酸,c(H+)增大,Kw不变C.将水加热,平衡正向移动,Kw变大D.升高温度,平衡正向移动,c(H+)增大,pH不变6.相同温度下,在0.1 mol·L-1的氢氧化钠溶液和0.1 mol·L-1的盐酸中,水的电离程度( )A.前者大 B.前者小C.一样大 D.无法确定 关键能力综合练进阶训练第二层一、选择题:每小题只有一个选项符合题意。1.纯水在25 ℃和80 ℃时,c(H+)前后大小关系及酸碱性分别是( )A.大于 弱酸性 B.等于 中性C.小于 弱酸性 D.小于 中性2.25 ℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18。下列说法正确的是( )A.该溶液c(H+)可能等于1×10-7 mol·L-1B.此溶液不存在C.该溶液c(H+)可能等于1×10-9mol·L-1D.该溶液的pH可能为73.常温下,在0.01 mol·L-1H2SO4溶液中,由水电离出的氢离子浓度是( )A.5×10-13mol·L-1B.0.02 mol·L-1C.1×10-7 mol·L-1D.1×10-12 mol·L-14.向纯水中加入少量NaHSO4固体,在温度不变时,溶液中( )A.增大B.c(H+)减小C.c(H+)与c(OH-)的乘积增大D.c(OH-)增大5.常温下,下列四种溶液:①1 mol·L-1的盐酸,②0.1 mol·L-1的盐酸,③0.01 mol·L-1的NaOH溶液,④0.001 mol·L-1的NaOH溶液中,由水电离生成的H+的物质的量浓度之比为( )A.1∶10∶100∶1 000 B.0∶1∶12∶11C.14∶13∶12∶11 D.14∶13∶2∶16.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列有关说法正确的是( )A.c点对应的溶液中大量存在的离子可能为Na+、H+、Cl-、NOB.将25 ℃时的KCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到d点C.t℃<25 ℃D.ac线上的任意一点溶液均有c(H+)=c(OH-)二、非选择题7.在不同温度下的水溶液中c(H+)=x mol·L-1,c(OH-)=y mol·L-1,x与y的关系如图所示。曲线Ⅰ代表的温度下,水的离子积为________,曲线Ⅰ所代表的温度________(填“高于”“低于”或“等于”)曲线Ⅱ所代表的温度。你判断的依据是________________________________________________________________________________________________________________________________________________。8.在-50 ℃时液氨中存在着下列平衡:2NH3⇌NH+NH,两种离子的平衡浓度均为1.0×10-15 mol·L-1。(1)液氨中离子积为________;(2)向液氨中加入氨基钠(NaNH2),液氨的离子积________,向液氨中加入NH4Cl,c(NH)增大,离子积的数值________。9.实验表明,液态时,纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都像水那样进行自身电离(H2O+H2O⇌H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:(1)纯硫酸在液态时自身电离的方程式是________________________________________________________________________________________________________________________________________________。(2)25 ℃时,液态纯硫酸的离子积常数K(H2SO4)________1×10-14 mol2·L-2(填“>”“<”或“=”)。(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是________,这是因为混合酸中不仅存在硫酸和硝酸各自电离的两个电离平衡,而且还因硫酸的酸度大于硝酸,又在无水条件下,混合酸中必然发生____________________________(写离子方程式)反应。10.某学生为探究Kw的影响因素,做了以下实验。(1)查阅资料,不同温度下水的离子积常数如表所示。t/ ℃0102025405090100Kw/10-140.1150.2960.6871.012.875.3137.154.5由此推出:随着温度的升高,Kw的值________,水的电离程度________,水的电离平衡向________移动,水的电离过程是__________过程。(2)取三只烧杯A、B、C,分别加入适量水,再向B、C烧杯中分别加入少量盐酸和NaOH溶液,分析并填写下表。 A(纯水)B(加少量盐酸)C(加少量NaOH溶液)c(H+)1.0×10-7 mol·L-1增大________c(OH-)1.0×10-7 mol·L-1________增大c(H+)和c(OH-) 大小比较c(H+)=c(OH-)c(H+)________ c(OH-)c(H+)________ c(OH-)水的电离平衡移动方向 ________________Kw1.0×10-14________________综上所述,可得出如下结论:①温度、________、________均能影响水的电离平衡。②Kw只受________的影响,而与其他因素无关。 第3课时 水的电离平衡必备知识基础练1.答案:A解析:Kw只与温度有关,升高温度,Kw增大,25 ℃时,纯水和任何物质的水溶液中Kw=c(H+)·c(OH-)=1×10-14。2.答案:D解析:由于水的电离是吸热的,所以升高温度,向电离程度增大的方向移动,H+和OH-浓度增大,故电离平衡常数Kc=增大。而Kw=c(H+)·c(OH-)也增大;Kw的单位为 mol2·L-2,Kc的单位为 mol·L-1,所以二者的单位不同;而Kw=Kc·c(H2O),所以二者的数值也不同。3.答案:A解析:由水电离的c(H+)=1×10-13 mol·L-1<1×10-7 mol·L-1,即该溶液中的溶质抑制了水的电离,因此要么加碱抑制,要么加酸抑制,故①④正确。4.答案:A解析:若该温度下水的离子积常数为Kw(这里没有说是25 ℃),则在0.01 mol·L-1的NaOH溶液中,由水电离的c(H+)== mol·L-1。在0.01 mol·L-1的HCl溶液中,由水电离出的c(H+)=c(OH-)水电离= mol·L-1。5.答案:D解析:向水中通入NH3,c(OH-)增大,平衡逆向移动,A项正确;向水中加入少量稀H2SO4,c(H+)增大,但温度不变,Kw不变,B项正确;将水加热,水的电离平衡正向移动,Kw变大,C项正确;升高温度,能促进水的电离,c(H+)增大,pH减小,D项错误。6.答案:C解析:两种溶液中,c(NaOH)=0.1 mol·L-1,c(OH-)=0.1 mol·L-1;c(HCl)=0.1 mol·L-1,c(H+)=0.1 mol·L-1。因此,两溶液中酸和碱对水电离的抑制程度相同。关键能力综合练1.答案:D解析:Kw随温度升高而增大,纯水中c(H+)也随温度升高而增大,但仍等于c(OH-),显中性。2.答案:C解析:由题意可知,该溶液中由水电离产生的c(H+)=c(OH-)=1×10-9mol·L-1,水的电离受到抑制,可能是酸性溶液,也可能是碱性溶液。若为酸性溶液,c(H+)可能等于1×10-5mol·L-1;若为碱性溶液,c(H+)可能等于1×10-9mol·L-1,故C正确。3.答案:A解析:H2SO4电离出的c(H+)=0.02 mol·L-1,常温下,由Kw=1.0×10-14可知c(OH-)=5×10-13mol·L-1,OH-是由水电离产生的,则水电离产生的c(H+)=c(OH-)=5×10-13 mol·L-1。4.答案:A解析:水存在电离平衡:H2O⇌H++OH-,加入NaHSO4固体,溶液中c(H+)增大,c(OH-)减小,c(H+)·c(OH-)不变,增大。5.答案:A解析:在盐酸中,由水电离产生的c(H+)等于溶液中的c(OH-):①c(H+)水=c(OH-)=1×10-14 mol·L-1,②c(H+)水=c(OH-)=1×10-13 mol·L-1;③在NaOH溶液中,由水电离产生的c(H+)等于溶液中的c(H+),c(H+)=1×10-12 mol·L-1,④c(H+)=1×10-11 mol·L-1。因此,四种溶液中由水电离出的H+的浓度之比为10-14∶10-13∶10-12∶10-11=1∶10∶100∶1 000。6.答案:D解析:c点对应的溶液中,满足c(H+)=c(OH-)=10-6 mol·L-1,不可能大量存在H+,A错误;将25 ℃时的KCl溶液加热到t℃,H+、OH-的浓度同等程度增大,则该溶液中的c(OH-)由a点变化到c点,B错误;t℃,Kw较大,因为温度越高,水的电离程度越大,所以t℃>25 ℃,C错误;根据图像,ac线上的任意一点溶液均有c(H+)=c(OH-),D正确。7.答案:1×10-12 高于 曲线Ⅱ所代表的离子积比曲线Ⅰ的小,由于水的电离过程是吸热过程,温度越高,离子积越大,故曲线Ⅱ代表的温度低解析:根据曲线中的数据,可以知道曲线Ⅰ代表的温度下水的离子积为1×10-12,水的电离过程是吸热过程,温度越高,水的离子积就越大,曲线Ⅰ所代表的离子积比曲线Ⅱ的大,所以,曲线Ⅰ代表的温度高。8.答案:(1)1.0×10-30 (2)不变 不变解析:应用知识迁移,将水的离子积迁移应用到液氨中。只要温度不变离子积就不变。9.答案:(1)2H2SO4⇌H3SO+HSO(2)> (3)HSO H++NO===HNO3解析:已知液态纯酸都能像水那样进行自身电离(H2O+H2O⇌H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数,这些信息告诉我们纯硫酸存在着电离平衡,且电离程度强于纯硝酸和纯水,仿照纯水的电离方式,可以推知纯硫酸的电离方程式为2H2SO4⇌H3SO+HSO。在25 ℃时,液态纯H2SO4的离子积常数K(H2SO4)比1×10-14 mol2·L-2大。由于在纯硫酸和纯硝酸的液态混合酸中2H2SO4⇌H3SO+HSO为主要的电离方式,而纯硝酸电离受到纯硫酸电离出的H+的抑制,因此,在纯硫酸和纯硝酸的液态混合酸中,存在的阴离子主要是HSO。同时,无水条件下,混合酸中必然发生H++NO===HNO3的反应。10.答案:(1)增大 增大 右 吸热(2)减小 减小 > < 向左 向左 1.0×10-14 1.0×10-14 ①酸 碱 ②温度
相关试卷
这是一份化学选择性必修1专题3 水溶液中的离子反应第一单元 弱电解质的电离平衡第三课时同步训练题,共8页。试卷主要包含了 时水的电离达到平衡等内容,欢迎下载使用。
这是一份化学选择性必修1第一单元 弱电解质的电离平衡第二课时同步训练题,共11页。试卷主要包含了 已知等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡第一课时综合训练题,共8页。试卷主要包含了 下列说法正确的是等内容,欢迎下载使用。










