








所属成套资源:新人教版化学选择性必修1课件PPT+教案全册
- 《沉淀溶解平衡》第二课时课件PPT+教学设计 课件 25 次下载
- 《原电池》第一课时课件PPT+教学设计 课件 30 次下载
- 《电解池》第一课时课件PPT+教学设计 课件 28 次下载
- 《电解池》第二课时课件PPT+教学设计 课件 31 次下载
- 《金属的腐蚀和防护》课件PPT+教学设计 课件 30 次下载
小学科学大象版 (2017)六年级下册2 设计获奖教学课件ppt
展开
这是一份小学科学大象版 (2017)六年级下册2 设计获奖教学课件ppt,文件包含《原电池》第二课时课件pptx、《原电池》第二课时教学设计docx等2份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
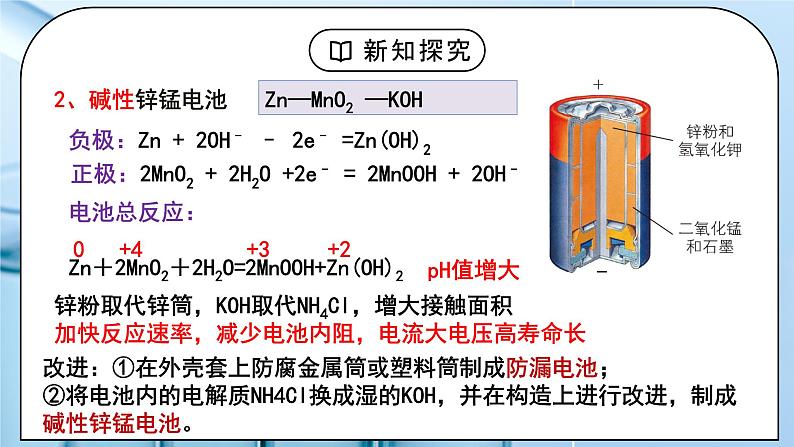
(人教版高中化学选择性必修1)《原电池》第二课时 教学设计课题名《原电池》第二课时教材分析本节内容是在必修第二册的化学电源的基础上,进一步要求学生理解原电池的工作原理,学会书写三种类型的电池电极反应的书写。学好本节内容对后面电解池的学习有重要作用。教学目标宏观辨识与微观探析:掌握一次电池、二次电池、燃料电池的反应原理,会书写电极反应式。证据推理与模型认知:通过对常见化学电池的分析,培养证据推理与模型认知的能力。科学探究与创新意识:了解化学电源的种类及工作原理,知道化学电源在生产、生活和国防中的实际应用。科学精神与社会责任:通过认识新型化学电源的作用及废旧电池对环境的危害,形成科学态度与社会责任意识。教学重点电池反应的方程式和电极反应式的书写。 教学难点电池反应的方程式和电极反应式的书写。 教学方法讲解、举例法教学准备教师准备:PPT学生准备:预习课本教学过程一、新课导入1.用途广泛的各种化学电池教师:介绍生活中的各种电池学生:回顾电池的工作原理[设计意图]激发学生学习兴趣,引入讲解电极反应的的书写。二、探究新知1.一、化学电池的分类教师:思考:1、为什么电池的用途如此广泛呢?2、电池优劣的判断标准是什么?一、一次电池一次电池放电后不可再充电,一次电池中电解质溶液制成胶状,不流动,也叫做干电池。1、普通锌锰电池负极:Zn-2e-=Zn2+正极:2NH4++2e-+2MnO2=2NH3↑+Mn2O3+H2O总反应Zn+2MnO2 + 2NH4Cl =ZnCl2+Mn2O3+2NH3↑+H2O优点:制作简单,便于携带,价格便宜;缺点:会发生自放电,放电时间短,电压下降快;容易漏液(锌外壳变薄糊状NH4Cl显酸性)2、碱性锌锰电池负极:Zn + 2OH– – 2e– =Zn(OH)2 正极:2MnO2 + 2H2O +2e– = 2MnOOH + 2OH– 电池总反应:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2 锌粉取代锌筒,KOH取代NH4Cl,增大接触面积加快反应速率,减少电池内阻,电流大电压高寿命长改进:①在外壳套上防腐金属筒或塑料筒制成防漏电池;②将电池内的电解质NH4Cl换成湿的KOH,并在构造上进行改进,制成碱性锌锰电池。二、二次电池充电电池又称二次电池,放电时所进行的氧化还原反应,在充电时又逆向进行,使电池恢复到放电前的状态。1.铅酸蓄电池(1)构造:(2)组成: Pb/30%H2SO4溶液/PbO2优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉。缺点:比能量低、笨重、废弃电池污染环境(3) 工作原理:放电:化学能转化为电能充电:电能转化为化学能①放电过程:负极:Pb -2e- + SO42- =PbSO4 正极:PbO2 +2e- + 4H++SO42-=PbSO4 +2H2O总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O ②充电过程:正接正作阳极,负接负作阴极阴极(接负极):PbSO4 +2e- =Pb + SO42-阳极(接正极):PbSO4 -2e- +2H2O = PbO2 + 4H++ SO42-总反应:2PbSO4+2H2O=Pb+PbO2+2H2SO4充放电过程:Pb+PbO2+2H2SO4 2PbSO4+2H2O2.镍氢电池优点:能量密度高;无镉污染,是一种绿色电池;可大电流快速充放电;电池工作电压为1.2V;在小型便携电子器件、电动工具、电动车辆和混合动力车上逐步得到应用。放电:负极:H2 - 2e- + 2OH- = 2H2O 正极:2NiOOH +2 e- + 2H2O = 2Ni(OH)2 +2 OH-充电:阴极:2H2O +2 e- = H2 + 2OH- 阳极:2 Ni(OH)2 -2 e- + 2OH-= 2NiOOH +2 H2O 总反应:H2 + 2NiOOH 2Ni(OH)2 3.锂离子电池负极材料:嵌锂层状石墨(LixC6 )正极材料:钴酸锂(Li1-xCoO2)电解液:LLiPF6的碳酸酯溶液放电:负极:LixCy - xe-= Cy+xLi+正极:Li1-xCoO2+xe-+xLi =LiCoO2充电:阴极:Cy+xe-+xLi+=LixCy 阳极:LiCoO2-xe- =Li1-xCoO2+xLi+ 总反应:LixCy +Li1-xCoO2 LiCoO2+Cy石油焦炭和石墨作负极材料无毒,且资源充足,锂嵌入碳中(Li看作0价),克服了锂的高活性放电时,Li+从石墨中脱嵌移向正极,嵌入钴酸锂晶体中。充电时,Li+从钴酸锂晶体中脱嵌,由正极回到负极,嵌入石墨中。这样在放电、充电时,锂离子往返于电池的正极、负极之间完成化学能与电能的相互转化。优点:能量密度大,没有记忆效应。循环性能优越、可快速充放电。使用寿命长。不含有毒有害物质,被称为绿色电池。缺点:价格较昂贵。用途:广泛用于手机、笔记本电脑、数码相机等便携式电子设备。三、燃料电池原理:利用原电池的工作原理,燃料和氧化剂分别放在两个电极上发生氧化还原反应,将化学能直接转化为电能。与其他电池的区别:反应物不储存在电池内部,由外设设备提供燃料和氧化剂,生成物不断被排出。优点:高效(能量转化率可以达到80%以上), 环境友好。1、氢氧燃料电池氢氧燃料电池:(酸性)负极:2H2 -4e— =4H+(氧化反应)正极:O2+4H++4e—=2H2O(还原反应)总反应:2H2+O2=2H2O氢氧燃料电池:(碱性)负极:2H2+4OH— -4e— =4H2O(氧化反应)正极:O2+4H2O+4e—=4OH—(还原反应)总反应:2H2+O2=2H2O2、甲烷燃料电池 (1)已知酸性条件下①总反应式:CH4+2O2=CO2+2H2O ②正极反应式:O2+4H++4e-= 2H2O 则负极反应式为 CH4-8e-+2H2O = CO2+8H+(2)已知碱性条件下①总反应式:CH4+2O2+2OH-=CO32-+3H2O ②正极反应式:O2+2H2O+4e-=4OH- 则负极反应式:CH4+10OH--8e- = CO32-+7H2O3、非水溶剂的电极反应在固体电解质(高温下能传导O2-)中-: 2H2 - 4e- + 2O2- = 2H2O+: O2 + 4e- = 2O2-总:2H2 + O2 = 2H2O在熔融碳酸盐(如熔融K2CO3)环境下-: 2H2 - 4e- + 2CO32- = 2CO2 + 2H2O+: O2 + 4e- + 2CO2 = 2CO32-总: 2H2+O2=2H2O在固体电解质(高温下能传导O2-)中①总反应式: CH4+2O2=CO2+2H2O ②正极反应式:O2+4e- = 2O2-则负极反应式: CH4+4O2--8e- = CO2+2H2O在熔融碳酸盐(如熔融K2CO3)环境下①总反应式:CH4+2O2=CO2+2H2O ②正极反应式:O2+2CO2+4e-=2CO32-则负极反应式:CH4+4CO32--8e- = 5CO2+2H2O小结:电极反应式的书写学生:练习1:书写甲醇(CH3OH)燃料电池的酸性、碱性环境下的电极反应式总反应:2CH3OH + 3O2 = 2CO2 + 4H2O正极:3O2 + 12e—+12H+ = 6H2O负极:2CH3OH - 12e— +2H2O = 12H+ + 2CO2总反应:2CH3OH + 3O2 +4OH-= 2CO32-+ 6H2O正极:3O2 + 12e—+6H2O = 12OH-负极:2CH3OH - 12e— +16OH- = 2CO32-+ 12H2O 练习2:乙醇燃料电池,酸作电解质总反应:C2H5OH+3O2=2CO2+3H2O正:3O2+12H++12e-= 6H2O负:C2H5OH+ 3H2O - 12e-=2CO2+ 12H+ 乙醇燃料电池,碱溶作电解质总反应:C2H5OH+3O2+4KOH=2K2CO3+5H2O正:3O2+12e-+6H2O=12OH-负:C2H5OH+16OH--12e-=2CO32-+11H2O练习3:如图为肼燃料电池示意图,请写出正、负极电极反应式及总反应式正极:O2+4e-+2H2O=4OH-负极:N2H4-4e-+4OH-=4H2O+N2总反应:N2H4+O2=N2+2H2O练习4、银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法中不正确的是( )A.工作时,正极上发生反应的物质是Ag2O B.负极发生的反应是Zn+2OH--2e-=Zn(OH)2C.工作时,负极区溶液c(OH-)减小 D.溶液中OH-向正极移动,K+、H+向负极移动练习5、氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是 H2+2NiO(OH) 2Ni(OH)2。根据此反应式判断,下列叙述中正确的是( ) A.电池放电时,电池负极周围溶液的pH不断增大B.电池放电时,镍元素被氧化C.电池充电时,氢元素被还原D.电池放电时,H2在负极上反应练习6、 锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li +MnO2=LiMnO2,下列说法正确的是( )A、Li是正极,电极反应为 Li-e- =Li+B、Li是负极,电极反应为 Li-e- =Li+C、Li是负极,电极反应为 MnO2 +e-=MnO2 –D、Li是负极,电极反应为 Li-2e- = Li2+练习7、一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是( )A.正极反应为14H2O+7O2+28e-=28OH-B.放电一段时间后,负极周围的pH升高C.每消耗1 mol C2H6 ,则电路上转移的电子为28 molD.放电过程中KOH的物质的量浓度不变 练习8、一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( ) A.电池的总反应是:2C4H10+13O2→8CO2+10H2O B.在熔融电解质中,O2-由负极移向正极 C.通入空气一极是正极,电极反应为:O2+4e-=2O2- D.通入丁烷一极是正极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O[设计意图]让学生掌握电极反应的书写。板书设计一、一次电池1、普通锌锰电池2、碱性锌锰电池二、二次电池1.铅酸蓄电池2.镍氢电池3.锂离子电池三、燃料电池1、氢氧燃料电池2、甲烷燃料电池 3、非水溶剂的电极反应课后作业 练习册上相关习题教学反思亮点:本节课详细讲解了一次电池,二次电池,燃料电池的工作原理和电极反应的书写。课堂教学建议:本节课应根据学生的情况对学生作要求,电极反应的书写是本节课的重难点,掌握好后对电解池的学习有重要作用。
相关课件
这是一份苏教版 (2017)五年级上册7 热辐射评优课教学课件ppt,文件包含27《热辐射》教学PPTpptx、27《热辐射》教案设计docx等2份课件配套教学资源,其中PPT共11页, 欢迎下载使用。
这是一份苏教版 (2017)五年级上册第1单元 光与色彩1 光源优秀教学课件ppt,文件包含11《光源》教学PPTpptx、11《光源》教案设计docx等2份课件配套教学资源,其中PPT共7页, 欢迎下载使用。
这是一份苏教版 (2017)四年级上册9 弹力试讲课教学ppt课件,文件包含39《弹力》教学PPTpptx、39《弹力》教案设计docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。











