





2024年高考化学一轮总复习 第10单元 第2讲 元素周期表 元素周期律 课件
展开
这是一份2024年高考化学一轮总复习 第10单元 第2讲 元素周期表 元素周期律 课件,共60页。PPT课件主要包含了考点一元素周期表,核电荷数,质子数,核外电子数,电子层数目,原子序数,最外层电子数,电子层数,He2s22p6,Ne3s23p6等内容,欢迎下载使用。
第2讲 元素周期表 元素周期律
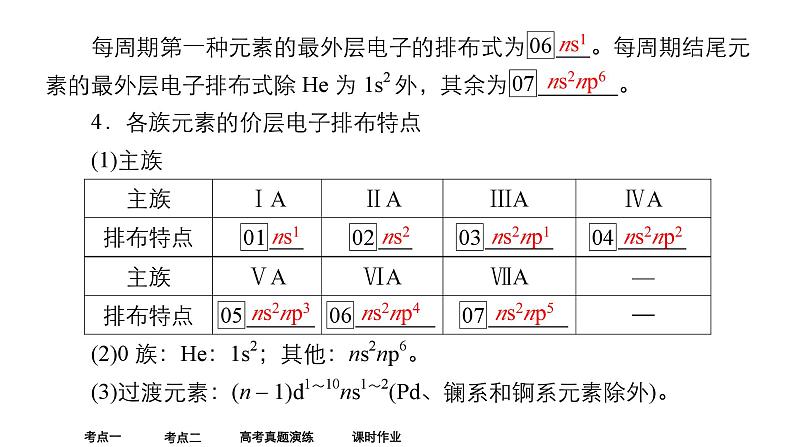
复习目标1.了解元素周期表的结构及应用。2.根据原子核外电子排布规律认识元素周期表的结构与分区。3.掌握元素周期律的实质。4.了解电离能、电负性的概念,并能掌握其递变规律与应用。5.掌握同周期、同主族元素金属性、非金属性的递变规律,并能对陌生元素性质进行简单预测。
3.原子核外电子排布与周期表的关系
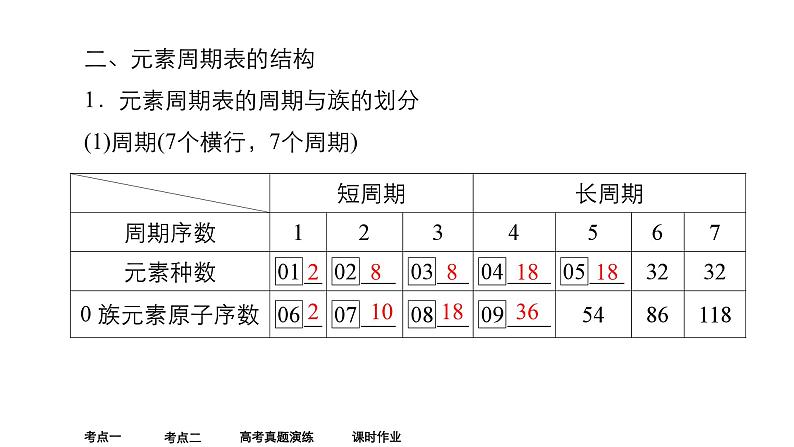
二、元素周期表的结构1.元素周期表的周期与族的划分(1)周期(7个横行,7个周期)
短周期元素和长周期元素
(2)按核外电子排布特点分区①周期表的分区
②各区元素原子价层电子排布特点
3.元素周期表的应用(1)为新元素的发现及预测它们的原子结构和性质提供线索。(2)启发人们在一定区域内寻找新物质
请指出下列各说法的错因(1)最外层电子数是2的元素,都是第ⅡA族元素。错因: __________________________________________(2)价层电子排布为5s25p3的元素位于第五周期第ⅢA族,是p区元素。错因: ______________________________________________(3)包含元素种类最多的族是ⅠA族。错因: __________________________________________
He是最外层电子数为2的元素,但属于零族。
价层电子排布为5s25p3的元素位于第五周期第ⅤA族。
含元素种类最多的族是ⅢB族,共有32种元素。
(4)每个周期都是从碱金属开始到稀有气体结束。错因: _____________________(5)元素周期表中镧系、锕系都占据同一格,它们都是同位素。错因: __________________________________________________________________________________
第一周期从H元素开始。
同位素是同种元素的不同原子,要求质子数相同而质量数不同,显然,镧系、锕系不符合。
2.同主族元素的原子序数差的关系(1)位于过渡元素左侧的主族元素,即第ⅠA族、第ⅡA族,同主族、邻周期元素原子序数之差为上一周期元素所在周期所含元素种数。(2)位于过渡元素右侧的主族元素,即第ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。例如,氯和溴的原子序数之差为35-17=18(溴所在第四周期所含元素的种数)。3.同周期两相邻主族元素的原子序数差可能为1或11(第四、五周期的第ⅡA族和第ⅢA族)或25(第六、七周期的第ⅡA族和第ⅢA族)。4.含元素种类最多的族是第ⅢB族,共有32种元素,所含元素形成化合物种类最多的族为第ⅣA族。
角度一 原子结构与周期表的关系1.若某原子处于能量最低状态时,价层电子排布为4d15s2,则下列说法正确的是( )A.该元素原子处于能量最低状态时,原子中共有3个未成对电子B.该元素位于周期表的第五周期第ⅢB族C.该元素原子的M能层共有8个电子D.该元素原子最外层共有1个电子,位于ds区
2.具有下列电子层结构的原子,其对应元素一定属于同一周期的是( )A.两种原子的电子层上全部都是s电子B.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子C.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子D.原子核外M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种原子
对价层电子认识的误区(1)价层电子不一定是最外层电子,只有主族元素的价层电子才是最外层电子。对于过渡元素还包括部分内层电子。(2)同一族元素的价层电子排布不一定相同,如过渡元素中的镧系元素和锕系元素就不相同,在第Ⅷ族中部分元素的价层电子排布也不相同。
角度二 元素周期表的结构3.下列有关元素周期表分区的说法正确的是( )A.s区全部是金属元素B.p区全部是非金属元素C.d区内元素原子的价层电子排布必为(n-1)d1~10ns2D.除ds区外,以最后填入电子的能级符号作为区的名称
解析由于X、Y、Z均为主族元素,结合其位置关系和元素周期表的结构,可推断Y元素一定不在第一周期,即X、Y、Z不可能都在短周期,D错误。
4.已知X、Y、Z三种主族元素在元素周期表中的位置如图所示,设X的原子序数为a。则下列说法不正确的是( )A.Y与Z的原子序数之和可能为2aB.Y的原子序数可能为a-17C.Z的原子序数可能为a+31D.X、Y、Z一定为短周期元素
5.下列有关元素周期表结构的说法中正确的是( )A.原子最外层电子数为2的元素一定处于周期表第ⅡA族B.同周期两相邻主族元素的原子序数之差一定为1C.某元素原子核外的电子数为63,则它是第六周期副族元素D.除短周期外,其他周期均为18种元素,副族没有非金属元素
直接相邻的“┳”型、“┻”型、“+”型原子序数关系
考点二 元素周期律
4.主族元素性质的周期性变化规律
5.元素周期律的应用(1)预测同主族元素的性质:如碱金属元素的一般性质。
请指出下列各说法的错因(1)同周期主族元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小。错因: ________________________________________________________________(2)根据最高正化合价与族序数的关系可知,氧元素的最高正价为+6价。错因: ___________________(3)第三周期非金属元素含氧酸的酸性从左到右依次增强。错因: ___________________________________________________
同周期主族元素的阴离子半径大于阳离子半径,如:r(N3-)>r(Li+)。
第三周期非金属元素最高价含氧酸的酸性从左到右依次增强。
(4)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强。错因: ___________________________________________________________________________(5)两元素原子电负性差值大于1.7时,一定形成离子键。错因: __________________________________________________________________________________
非金属性、金属性强弱与原子得失电子数目无关,只与得失电子的难易程度有关。
两元素原子电负性差值大于1.7时,一般形成离子键,也可能形成共价键,如HF。
(6)根据元素周期律,氮与氧、镁与铝相比,都是后者的第一电离能大。错因: ___________________________________________________________________________(7)主族元素的电负性越大,元素原子的第一电离能一定越大。错因: _________________________________________________________________________
N的3p轨道半充满,Mg的3s轨道全充满,与同周期相邻元素比,第一电离能较大。
元素的电负性大,第一电离能不一定大。如电负性:NO。
1.元素金属性、非金属性的比较
2.电离能的应用(1)判断元素金属性的强弱第一电离能越小,金属越容易失去电子,金属性越强;反之越弱。(2)判断元素的化合价(I1、I2……表示各级电离能)如果某元素的In+1≫In,则该元素的常见化合价为+n。如钠元素I2≫I1,所以钠元素的化合价为+1。(3)判断核外电子的分层排布情况多电子原子中,元素的各级电离能逐级增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
(4)反映元素原子的核外电子排布特点同周期元素从左向右,元素的第一电离能并不是逐渐增大的,当元素原子的核外电子排布是全空、半充满和全充满状态时,第一电离能就会反常的大。3.电负性的应用(1)一般来说,若两成键元素原子间的电负性差值大于1.7,原子之间通常形成离子键;若两成键元素原子间的电负性差值小于1.7,原子之间通常形成共价键。共价化合物中,两种元素电负性差值越大,它们形成共价键的极性就越强。
(2)电负性大的元素在化合物中易呈现负价,电负性小的元素在化合物中易呈现正价。4.对角线规则在元素周期表中,某些主族元素与右下方的主族元素有些性质是相似的,如:
角度一 元素性质递变规律1.已知短周期主族元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( )A.原子序数:D>C>B>AB.原子半径:B>A>C>DC.离子半径:C3->D->A2+>B+D.氧化性:A2+>B+,还原性:C3-NaOHD.原子半径由小到大的顺序:Mg、Si、N、F
粒子半径大小的比较方法(1)先比较电子层数,电子层数越多,微粒半径越大。(2)若电子层数相同,则原子序数越大,微粒半径越小(序大径小)。(3)若电子层数、原子序数都相同,则电子数多的微粒半径大。
角度二 元素金属性、非金属性强弱的判断3.下列关于元素金属性和非金属性强弱比较的说法不正确的是( )A.将大理石加入稀盐酸中,能产生CO2气体,说明Cl的非金属性强于CB.Si与H2化合所需温度远高于S与H2化合所需温度,说明S的非金属性强于SiC.Na与冷水反应剧烈,而Mg与冷水反应缓慢,说明Na的金属性强于MgD.Fe投入CuSO4溶液中,能置换出Cu,说明Fe的金属性比Cu的强
4.元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )A.非金属性:ZY>ZC.离子半径:X2->Y+>Z-D.原子序数:X>Y>Z
8.下列四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5则下列有关比较中正确的是( )A.第一电离能:④>③>②>①B.原子半径:②>①>④>③C.电负性:④>③>②>①D.最高正化合价:④>③=②>①
解析设W的最外层电子数目为a,则有a+(a+1)+(a+2)=18,解得a=5,结合四种元素在周期表中的相对位置可知,W、X、Y、Z分别为氮元素、硫元素、氯元素、锗元素。
9.元素W、X、Y和Z在周期表中的相对位置如图所示,其中元素Z位于第四周期,W、X、Y原子的最外层电子数之和为18,下列说法正确的是( )A.最简单氢化物沸点:Y>WB.原子半径的大小:Z>Y>XC.氧化物的水化物的酸性:WS,所以最高价氧化物对应水化物的酸性:HClO4>H2SO4,但Cl还有HClO等含氧酸,HClO的酸性弱于H2SO4,D错误。
11.第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,常温下,0.01 ml/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法不正确的是( )A.简单离子半径:Y>Z>W>XB.W的单质在常温下是黄绿色气体C.气态氢化物的稳定性:W>Z>YD.X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有4种
解析常温下,第三周期元素中,X的最高价氧化物水化物的溶液pH为12,氢氧根离子浓度为0.01 ml/L,故为一元强碱,则X为Na元素;Y、W、Z的最高价氧化物对应水化物的溶液pH均小于7,均为酸,W的最高价含氧酸溶液中氢离子浓度为0.01 ml/L,故为一元强酸,则W为Cl元素;相同浓度的最高价含氧酸溶液中,Z对应的酸性比W的强、Y对应的酸性比W的弱,而原子半径:Y>Z>Cl,SiO2不溶于水,故Z为S元素,Y为P元素。
12.(2022·山东烟台、德州高三一模)一种由短周期主族元素组成的抗病毒化合物的结构如图所示,其中Q、W、X、Y、Z的原子序数依次增大,Q为元素周期表中原子半径最小的,Y原子最外层电子数是Z原子电子层数的三倍。下列说法正确的是( )A.第一电离能:X>Y>WB.Y的氢化物只含有极性键C.Q、X、Y只能形成共价化合物D.W、X、Y、Z四种元素形成的简单氢化物中Z的沸点最高
解析Q为元素周期表中原子半径最小的,故Q为H,Y原子最外层电子数是Z原子电子层数的三倍,Z只能含有2个电子层,则Y的最外层电子数为6,由原子序数Y<Z及成键数目可得Y为O、Z为F,根据题图可知W形成4个共价键,且原子序数小于O,则W为C元素,X形成3个共价键,且原子序数介于C、O之间,则X为N元素。
有五种短周期元素,它们的结构、性质等信息如下表所示:
相关课件
这是一份【备战2023高考】化学总复习——第16讲《元素周期律和元素周期表》练习,文件包含备战2023高考化学总复习第16讲《元素周期律和元素周期表》练习解析版docx、备战2023高考化学总复习第16讲《元素周期律和元素周期表》练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份人教版高考化学一轮复习第5章物质结构元素周期律第2讲元素周期表元素周期律课件
这是一份鲁科版高考化学一轮总复习第4章第2节元素周期律和元素周期表课件,共60页。PPT课件主要包含了环节1课前自主复习,基础1,基础2,基础3,核外电子排布,环节2高考热点突破,考点1,考点2,环节3新情境专项练,点击右图进入等内容,欢迎下载使用。









