
福建省百校联盟2023届高三下学期第三次模拟考试化学试题(含解析)
展开
这是一份福建省百校联盟2023届高三下学期第三次模拟考试化学试题(含解析),共23页。试卷主要包含了单选题,工业流程题,实验题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。
福建省百校联盟2023届高三下学期第三次模拟考试化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学与生产、生活、科技密切相关。下列说法错误的是
A.用于火箭发动机的碳化硅陶瓷是一种新型无机非金属材料
B.船体上镶嵌的锌块是利用牺牲阳极法来避免船体遭受腐蚀
C.马家窑文化遗址出土的单刃青铜刀属于青铜制品,青铜是一种合金
D.“一带一路”是现代版的“丝绸之路”,丝绸的主要成分是纤维素
2.苯炔不对称芳基化反应如下:
下列说法错误的是
A.箭头b所示C-H键比箭头a所示C-H键活泼
B.苯炔不能使酸性高锰酸钾溶液褪色,也不与溴水反应
C.有机物X分子、有机物Y分子均含有1个手性碳原子
D.有机物Y分子中苯环上的一氯代物有三种
3.为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L NO和11.2 L 在密闭容器中混合,容器内气体分子数为
B.4.6 g乙醇和二甲醚()组成的混合物中,含有0.2个杂化的碳原子
C.在反应中,每生成3 mol 转移的电子数为6
D.标准状况下,11.2 L苯中含有6个键
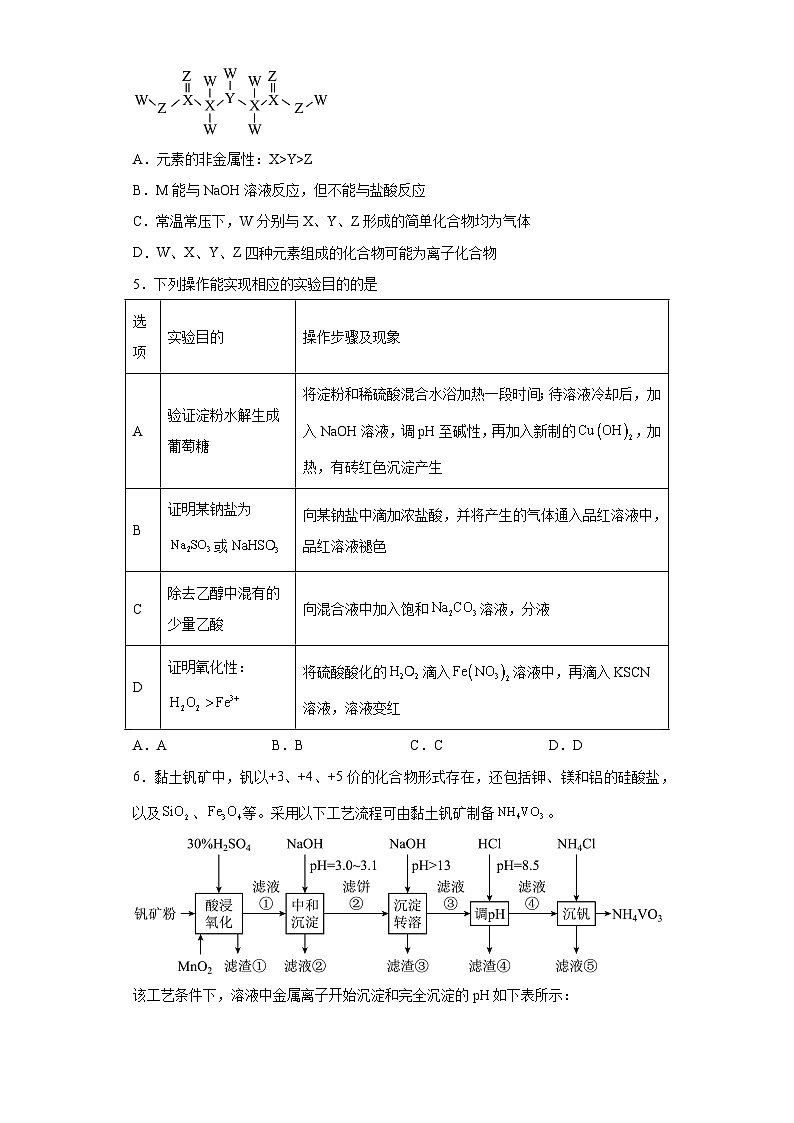
4.短周期主族元素W、X、Y、Z的原子序数依次增大,X、Y、Z同周期,X原子核外有三个能级且各能级电子数相等。四种元素形成的一种化合物M(结构式如图所示)可用于合成离子交换树脂。下列说法正确的是
A.元素的非金属性:X>Y>Z
B.M能与NaOH溶液反应,但不能与盐酸反应
C.常温常压下,W分别与X、Y、Z形成的简单化合物均为气体
D.W、X、Y、Z四种元素组成的化合物可能为离子化合物
5.下列操作能实现相应的实验目的的是
选项
实验目的
操作步骤及现象
A
验证淀粉水解生成葡萄糖
将淀粉和稀硫酸混合水浴加热一段时间;待溶液冷却后,加入NaOH溶液,调pH至碱性,再加入新制的,加热,有砖红色沉淀产生
B
证明某钠盐为或
向某钠盐中滴加浓盐酸,并将产生的气体通入品红溶液中,品红溶液褪色
C
除去乙醇中混有的少量乙酸
向混合液中加入饱和溶液,分液
D
证明氧化性:
将硫酸酸化的滴入溶液中,再滴入KSCN溶液,溶液变红
A.A B.B C.C D.D
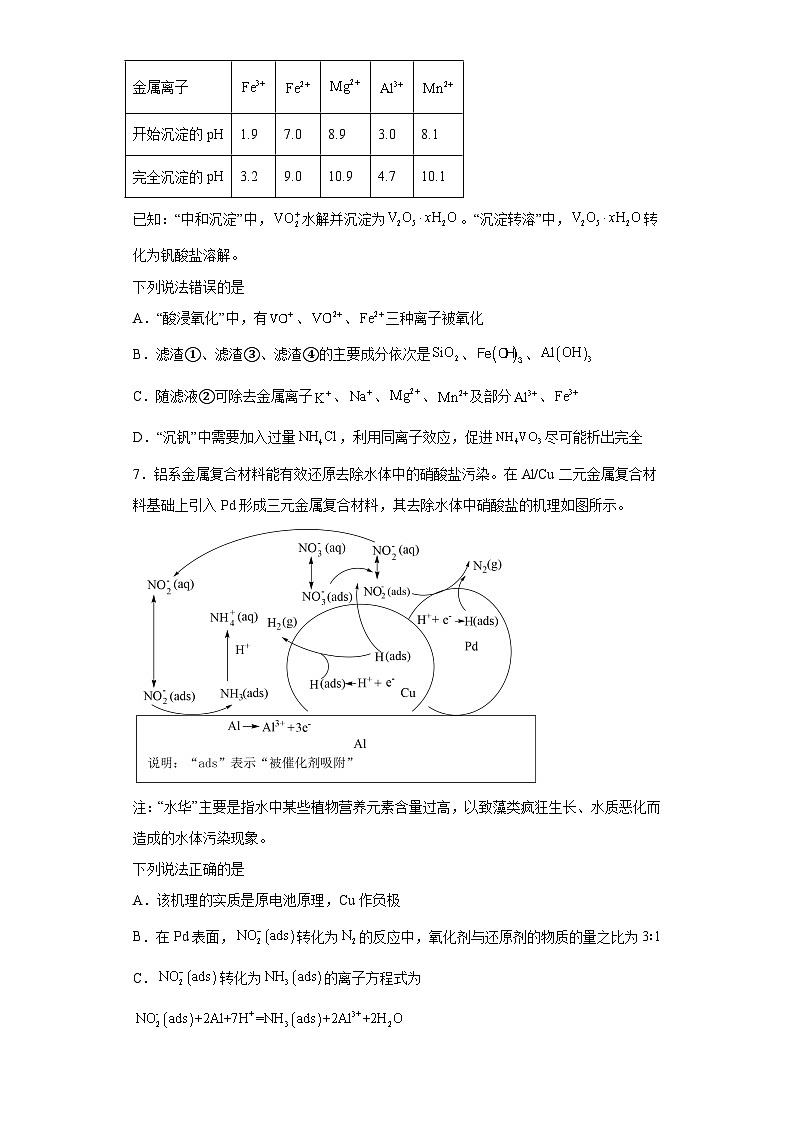
6.黏土钒矿中,钒以+3、+4、+5价的化合物形式存在,还包括钾、镁和铝的硅酸盐,以及、等。采用以下工艺流程可由黏土钒矿制备。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
开始沉淀的pH
1.9
7.0
8.9
3.0
8.1
完全沉淀的pH
3.2
9.0
10.9
4.7
10.1
已知:“中和沉淀”中,水解并沉淀为。“沉淀转溶”中,转化为钒酸盐溶解。
下列说法错误的是
A.“酸浸氧化”中,有、、三种离子被氧化
B.滤渣①、滤渣③、滤渣④的主要成分依次是、、
C.随滤液②可除去金属离子、、、及部分、
D.“沉钒”中需要加入过量,利用同离子效应,促进尽可能析出完全
7.铝系金属复合材料能有效还原去除水体中的硝酸盐污染。在Al/Cu二元金属复合材料基础上引入Pd形成三元金属复合材料,其去除水体中硝酸盐的机理如图所示。
注:“水华”主要是指水中某些植物营养元素含量过高,以致藻类疯狂生长、水质恶化而造成的水体污染现象。
下列说法正确的是
A.该机理的实质是原电池原理,Cu作负极
B.在Pd表面,转化为的反应中,氧化剂与还原剂的物质的量之比为3∶1
C.转化为的离子方程式为
D.该方法可彻底消除水体中氮元素造成的“水华”现象
8.浓差电池指利用两极电解质溶液中浓度不同引起的电势差放电。实验室利用浓差电池实现电解丙烯腈()合成己二腈[],装置如图所示(实验前,隔膜两侧溶液均为200 mL,铜电极质量均为100 g)。
下列说法正确的是
A.Cu(1)极为负极,其电极反应为
B.隔膜为阴离子交换膜,C(2)极为阴极
C.上述装置理论上可制备0.6 mol己二腈
D.当电解停止时,Cu(1)极与Cu(2)极质量相差51.2 g
9.常温下,向20 mL 0.1 mol/L H2S溶液中缓慢加入少量溶于水的MSO4粉末(已知MS难溶,忽略溶液体积变化),溶液中与变化如图所示。已知:,。下列说法错误的是
A.a点溶液的pH约为5
B.a、b、c三点溶液中由水电离产生的最大的是a点
C.b点溶液中,
D.c点溶液中,
10.以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①
②
CO2的平衡转化率(X-CO2)、的选择(S-CH3OH)随温度、压强变化如下:
已知:
下列叙述正确的是
A.
B.400℃左右,体系发生的反应主要是反应①
C.由图可知,,
D.起始、,平衡后,,若只发生反应①、②,则的平衡转化率为25%
二、工业流程题
11.金属镓被称为“电子工业脊梁”,与铝同族,性质与铝相似。氮化镓是5G技术中广泛应用的新型半导体材料。利用粉煤灰(主要成分为、、,还有少量等杂质)制备镓和氮化镓的流程如下:
常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度时,可认为已除尽。
回答下列问题:
(1)“焙烧”过程中变为,则与纯碱反应的化学方程式为____________。
(2)“碱浸”后滤渣的主要成分为___________(写化学式)。用惰性电极电解含的溶液可得到金属Ga,阴极的电极反应式为___________。
(3)常温下,反应的平衡常数_________。
(4)“碱浸”后溶液的主要成分为、、。请补充完整流程中“操作”过程的步骤(在方框内填入试剂的化学式或pH值):
滤液滤液滤渣 溶液
_______,_______,_______。
(实验中须使用的试剂:0.1 溶液、0.1 NaOH溶液)
(5)用石墨为电极电解熔融得到Ga单质,电极材料需要定期补充的是___________极(填“阴”或“阳”)。
三、实验题
12.二氧化钒()是一种新型热敏材料,实验室以为原料合成用于制备的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为},过程如下:
溶液氧钒(IV)简式碳酸铵晶体
已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)步骤ⅰ中生成同时生成的化学方程式为___________。常温下,只用浓盐酸与反应也能制备溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是___________(用化学方程式和必要的文字说明)。
(2)步骤ⅱ可用下图仪器组装完成。
①上述装置从左到右的连接顺序为___________(用各接口字母表示)。
②饱和溶液的作用是___________。
③反应结束后,将三颈烧瓶置于保护下的干燥器中,静置过滤可得到紫红色晶体,然后抽滤,先用饱和溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和溶液洗涤除去的阴离子主要是___________(填阴离子的电子式)。
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。实验步骤如下:
消耗滴定的体积如下:
实验次数
滴定前读数/mL
滴定后读数/mL
1
0.00
19.99
2
1.10
21.10
3
1.56
21.57
滴定反应为。
①滴定时,向锥形瓶中加入几滴___________(填化学式)溶液作指示剂。
②粗产品中钒的质量分数为___________%。
四、原理综合题
13.二氧化碳加氢可转化为二甲醚(),既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:
(1)加氢合成甲醇以及甲醇脱水生成二甲醚的热化学方程式如下:
则的___________。
(2)向一容积为2L的恒容密闭容器中通入2 moL 和6 mol ,一定温度下发生反应。起始总压为p Pa,20 min时达到化学平衡状态,测得的物质的量分数为12.5%。
①平衡时总压为___________Pa。
②达到化学平衡状态时,下列有关叙述正确的是___________(填标号)。
A.
B.容器内气体压强不再发生改变
C.向容器内通入少量氦气,则平衡向正反应方向移动
D.向容器内再通入1 mol 和3 mol ,重新达到平衡后,的体积分数增大
③0~20 min内,用表示的平均反应速率___________,的平衡浓度___________。该温度下,反应的平衡常数___________(用含p的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)工业上,以一定比例混合的与的混合气体以一定流速分别通过填充有催化剂I、催化剂II的反应器,发生反应。转化率与温度的关系如图所示。在催化剂II作用下,温度高于时,转化率下降的原因可能是___________。
五、结构与性质
14.乙二胺四乙酸铁钠可用于感光材料冲洗药品及漂白剂,化学式为;工业上可用EDTA与、NaOH溶液发生反应进行制备,合成路线如下:
回答下列问题:
(1)基态氯原子的价层电子排布图为___________。
(2)下列氮原子能量最高的是___________(填标号)。
A. B. C. D.
(3)EDTA的组成元素中C、N、O的第一电离能由大到小顺序为___________(填元素符号)。碳原子的杂化轨道类型为___________。
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为___________。
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为___________。
(6)在元素周期表中,铁元素位于___________区(填“s”“p”“d”或“ds”)。铁的某种晶胞沿面对角线的位置切下之后可以得到如图2所示的截面。假设铁的原子半径为a nm,则该铁晶体的密度为___________(列出计算式,设为阿伏加德罗常数的值)。
六、有机推断题
15.有机物M是一种抗癌新药,在医药工业中的一种合成方法如下:
已知:i.
ii.
iii.(R、R′为烃基)
回答下列问题:
(1)A的化学名称是___________。
(2)C中三种含氧官能团的名称是___________。
(3)E的分子式为,由F生成G的化学方程式为___________。
(4)D+G→H的反应类型是___________。
(5)L的结构简式为___________。
(6)C的六元环芳香同分异构体中,能与FeCl3溶液作用显紫色、能发生银镜反应、含有甲基,且核磁共振氢谱有四组峰的结构简式为___________(任写一种)。
(7)设计由1,3-丁二烯制备琥珀酸()的合成路线___________(无机试剂任选)。
参考答案:
1.D
【详解】A.用于火箭发动机的碳化硅陶瓷是一种新型无机非金属材料,A正确;
B.船体上镶嵌的锌块比钢铁化学性质更活泼,原电池反应中作负极,船体作正极受保护,是利用牺牲阳极法来避免船体遭受腐蚀,B正确;
C.青铜是一种合金,C正确;
D.丝绸的主要成分是蛋白质,D错误;
故选D。
2.B
【详解】A.箭头b所示C-H键和苯炔发生了加成反应,说明箭头b所示C-H键比箭头a所示C-H键活泼,A正确;
B.苯炔有碳碳三键能使酸性高锰酸钾溶液和溴水褪色,B错误;
C.有机物X分子:,有机物Y分子,均含有1个手性碳原子,C正确;
D.有机物Y分子:,苯环上的5个氢有3类等效氢,故其一氯代物有三种,D正确;
故选B。
3.B
【详解】A.标准状况下,,反应中NO、、物质的量比为2:1:2,反应前NO分子物质的量为,的物质量为,NO、物质的量比为2:1,两者恰好完全反应,生成1mol,容器内气体分子数为,但是容器中存在,所以容器内气体分子数小于,故A错误;
B.4.6 g乙醇和二甲醚()组成的混合物中,假设4.6g全部是乙醇,其物质的量为,一个乙醇分子含有两个碳原子杂化,杂化的碳原子数目为,假设4.6g全部是,其物质的量为,一个分子含有两个碳原子和一个氧原子均是杂化,杂化的碳原子数目为,所以4.6 g乙醇和二甲醚()组成的混合物中,含有0.2个杂化的碳原子,故B正确;
C.在反应中,这是归中反应,氯酸钾的氯元素从+5价降到0价,得到5个电子,1mol氯酸钾生成3mol氯气,得到5个电子,所以每生成3 mol 转移的电子数为5,故C错误;
D.标准状况下,苯为固体,不可以用气体摩尔体积进行计算,故D错误;
故选:B。
4.D
【分析】由题干信息可知,短周期主族元素W、X、Y、Z的原子序数依次增大,X、Y、Z同周期,X原子核外有三个能级且各能级电子数相等,则X为C,根据化合物M的结构式可知,Y周围形成三个共价键,则Y为N,Z周围形成2个共价键,Z为O,W周围形成1个共价键,W为H,据此分析解题。
【详解】A.由分析可知,X、Y、Z分别为C、N、O,故元素的非金属性O>N>C即Z >Y>X,A错误;
B.由分析可知,W、X、Y、Z分别为H、C、N、O,则M为HOOCCH2NHCH2COOH ,分子中含有羧基和氨基,故M能与NaOH溶液反应,也能与盐酸反应,B错误;
C.由分析可知,W、X、Y、Z分别为H、C、N、O,常温常压下,W分别与X、Y、Z形成的简单化合物CH4、NH3为气体,而H2O为液体,C错误;
D.由分析可知,W、X、Y、Z分别为H、C、N、O,W、X、Y、Z四种元素组成的化合物可能为离子化合物如NH4HCO3或者(NH4)2CO3,也可能为共价化合物CO(NH2)2,D正确;
故答案为:D。
5.A
【详解】A.葡萄糖和氢氧化铜在碱性条件下加热反应生成砖红色沉淀,将淀粉和稀硫酸混合水浴加热一段时间,待溶液冷却后,加入NaOH溶液,调pH至碱性,再加入新制的Cu(OH)2,加热,有砖红色沉淀(Cu2O)产生,证明淀粉水解生成葡萄糖,A正确;
B.氯气和二氧化硫都能使品红褪色,次氯酸钠溶液中滴加浓盐酸,产生氯气,通入品红溶液中,品红溶液褪色,故不能确定某钠盐为Na2SO3或NaHSO3,B错误;
C.乙酸和碳酸钠可以反应,生成乙酸钠溶于水,乙醇和碳酸钠不反应,但乙醇与水任意比互溶,故乙醇和乙酸的混合液中加入饱和Na2CO3溶液,不会分层,故无法用分液的方法除去乙醇中混有的少量乙酸,C错误;
D.遇到H+具有氧化性能将Fe2+氧化成Fe3+,无法证明氧化性:H2O2>Fe3+,D错误;
故答案为:A。
6.B
【分析】黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4,用30%H2SO4和MnO2 “酸浸氧化”时VO+和VO2+被氧化成,Fe3O4与硫酸反应生成的Fe2+被氧化成Fe3+,SiO2此过程中不反应,硅酸盐与硫酸反应可得到硅酸沉淀,故滤渣1含二氧化硅和硅酸,滤液①中含有、K+、Mg2+、Al3+、Fe3+、Mn2+、;滤液①中加入NaOH调节pH=3.0~3.1,钒水解并沉淀为V2O5·xH2O,根据表中提供的溶液中金属离子开始沉淀和完全沉淀的pH,此过程中Fe3+部分转化为Fe(OH)3沉淀,部分Al3+转化为Al(OH)3沉淀,滤液②中含有K+、Na+、Mg2+、Al3+、Fe3+、Mn2+、,滤饼②中含V2O5·xH2O、Fe(OH)3、Al(OH)3,滤饼②中加入NaOH使pH>13,V2O5·xH2O转化为钒酸盐溶解,Al(OH)3转化为NaAlO2,则滤渣③的主要成分为Fe(OH)3;滤液③中含钒酸盐、偏铝酸钠,加入HCl调pH=8.5,NaAlO2转化为Al(OH)3沉淀而除去;则滤渣④的主要成分是,最后向滤液④中加入NH4Cl“沉钒”得到NH4VO3。
【详解】A. 据分析,“酸浸氧化”中,有、、三种离子被氧化,A正确;
B. 据分析,滤渣①的主要成分是硅酸和,B不正确;
C. 据分析,随滤液②可除去金属离子、、、及部分、,C正确;
D.NH4VO3存在沉淀溶解平衡:NH4VO3(s) (aq)+VO (aq),“沉钒”中加入过量NH4Cl,增大c(),有利于NH4VO3结晶析出,D正确;
答案选B。
7.C
【详解】A.由题干图示信息可知,该机理的实质是原电池原理,Al比Cu活泼且Al失去电子发生氧化反应,故Al作负极,Cu作正极,A错误;
B.由题干图示信息可知,在Pd表面,转化为的反应中,该反应方程式为:2+6H(ads)+2H+=N2+3H2O,反应中为氧化剂,H(ads)是还原剂,故氧化剂与还原剂的物质的量之比为1∶3,B错误;
C.由题干图示信息可知,转化为即中N得到Al失去的电子转化为NH3,Al失去电子转化为Al3+,根据氧化还原反应配平可得该反应的离子方程式为,C正确;
D.由题干图示信息可知,该方法并不能将水体中硝酸盐全部转化为N2,还有部分转化为留在水体中,故不可彻底消除水体中氮元素造成的“水华”现象,D错误;
故答案为:C。
8.D
【分析】浓差电池中,Cu(2)失去电子,故电极为负极,电极反应式为Cu-2e-=Cu2+,Cu(1)电极为正极,电极上发生得电子的还原反应,电极反应为Cu2++2e-=Cu,则电解槽中C(1)极为阴极、C(2)极为阳极,阳极上水失电子生成氧气和氢离子,电极反应为:2H2O-4e-=O2↑+4H+,阴极上丙烯腈合成己二腈得电子,电极反应为2CH2=CHCN+2H++2e-=NC(CH2)4CN,据此分析解答。
【详解】A.由分析可知,Cu(1)极为正极,其电极反应为,A错误;
B.由分析可知,此电池为浓差电池,主要因为铜离子浓度不同形成的电势差,所以隔膜是阴离子交换膜,隔膜为阴离子交换膜,C(2)极为阳极,B错误;
C.当两电极中铜离子浓度相同时放电完毕,此时溶液中,所以转移电子的物质的量是0.8mol,由反应2CH2=CHCN+2H++2e-=NC(CH2)4CN可知,可制备0.4mol己二腈,C错误;
D.当两电极中铜离子浓度相同时放电完毕,此时溶液中,所以转移电子的物质的量是0.8mol,当电解停止时,则Cu(1)电极上析出0.4molCu,Cu(2)电极上溶解0.4molCu,故Cu(1)极与Cu(2)极质量相差0.8mol×64g/mol=51.2 g,D正确;
故答案为:D。
9.C
【详解】A.设0.1mol/L的H2S溶液中c(H+)为x,则c(H+)≈c(HS-)=xmol/L,Ka1(H2S)==≈=1.0×10-9,x=10-5mol/L,a点溶液的pH约为5,A正确;
B.随着MSO4粉末的加入发生反应MSO4+H2S=MS↓+H2SO4,随反应进行硫酸浓度增大,对水电离的抑制程度增大,a、b、c三点中由水电离产生的c(H+)最大的是a点,B正确;
C.Ka1(H2S)==1.0×10-9,Ka2(H2S)==1.0×10-13,Ka1(H2S)×Ka2(H2S)=×=1.0×10-9×1.0×10-13,得到=1.0×10-22,b点c(H+)=0.1mol/L,故有:=1.0×10-20,C错误;
D.物料守恒可知,c点除了溶液中含硫元素外,沉淀MS中也含硫元素,则c(H2S)+c(HS-)+c(S2-)<0.1mol⋅L-1,D正确;
故答案为:C。
10.C
【详解】A.反应①气体体积减小的反应,相同温度下,增大压强,平衡正向移动,CH3OH的选择性增大,由图可知,相同温度下,P1压强下CH3OH的选择性大于P2压强下CH3OH的选择性,则p1>p2,A错误;
B.400℃左右,CH3OH的选择性接近为0,说明400℃左右,体系发生的反应主要是②,B错误;
C.由图可知,相同压强下,升高温度,CH3OH的选择性减小,但CO2的平衡转化率先减小后增大,说明反应①平衡逆向移动,反应②平衡正向移动,则ΔH1<0,ΔH2>0,C正确;
D.初始n(CO2)=1mol、n(H2)=3mol,平衡后X-CO2=30%、Δn(CO2)=1mol×30%=0.3mol,S-CH3OH=80%,n(转化为CH3OH的CO2)=0.3mol×80%=0.24mol,列化学平衡三段式,,Δn(H2)=0.72mol+0.06mol=0.78mol,氢气转化率为×100%=26%,D错误;
故答案为:C。
11.(1)
(2)
(3)
(4) NaOH 3.7
(5)阳
【分析】粉煤灰与纯碱焙烧后得到Na2GeO2、Na2SiO3、Na2AlO2,加入16%的碳酸钠溶液浸取,得到氧化铁沉淀,滤液中含有Na2GeO2、Na2SiO3、Na2AlO2,通入二氧化碳后生成氢氧化铝沉淀和硅酸沉淀,通入二氧化碳二次酸化后得到氢氧化镓,将滤饼与氢氧化钠溶液应,得到[Ga(OH)4]-,电解后得到镓单质,加入一溴甲烷和氨气得到GaN,据此解答。
【详解】(1)“焙烧”的目的是将Ga2O3转化为NaGaO2,该反应的化学方程式为;
(2)氧化铁不与碱液反应,由分析可知滤渣的主要成分是Fe2O3,“电解”可得金属Ga,阴极得到电子发生还原反应,电极方程式为[Ga(OH)4]-+3e-=Ga+4OH-;
(3)由图可知,常温下当c([Ga(OH)4]-)=10-5mol/L时pH=9.4,c(OH-)=10-4.6mol/L,常温下,反应的平衡常数;
(4)加入稀硫酸生成硅酸难溶物,过滤为滤渣,滤液中加入NaOH溶液与反应生成氢氧化铝沉淀,为了防止Ga3+沉淀,由图可知当pH
相关试卷
这是一份福建省百校联盟2023届高三下学期4月联合测评(三模)化学试题答案和解析,共4页。
这是一份2023届福建省百校联盟高三下学期4月联合测评(三模)化学试题,共8页。
这是一份福建省百校联盟2023届高三下学期4月联合测评(三模)化学试题答案和解析,共4页。










