
福建省福州市八县(市)2021-2022学年高一下学期期末联考化学试卷(含答案)
展开
这是一份福建省福州市八县(市)2021-2022学年高一下学期期末联考化学试卷(含答案),共12页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
福建省福州市八县(市)2021-2022学年高一下学期期末联考化学试卷学校:___________姓名:___________班级:___________考号:___________
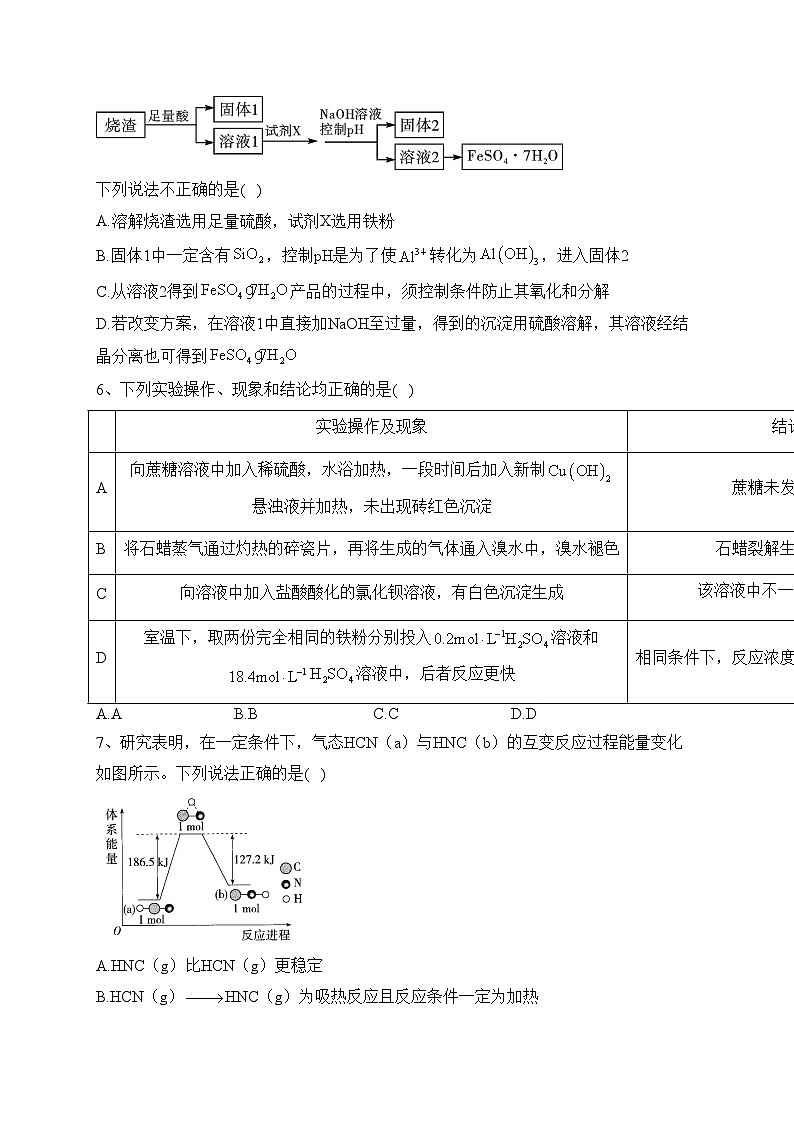
一、单选题1、陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点2、规范使用化学用语是基本学科素养的体现。下列化学用语正确的是( )A.乙烯的结构简式为: B.与是两种不同物质C.羟基的电子式: D.丙烷的球棍模型:3、设为阿伏加德罗常数的值。下列有关叙述正确的是( )A.14g乙烯和丙烯的混合气体中的氢原子数为2B.1mol与3mol反应生成的分子数为2C.1mol Fe溶于过量稀硝酸,电子转移数为2D.标准状况下,2.24L含有的共价键数为0.44、室温下,下列各组离子在指定溶液中能大量共存的是( )A.0.1溶液:B.0.1溶液:C.0.1溶液:D.0.1溶液:5、某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为,不考虑其他杂质)制取七水合硫酸亚铁(),设计了如下流程:下列说法不正确的是( )A.溶解烧渣选用足量硫酸,试剂X选用铁粉B.固体1中一定含有,控制pH是为了使转化为,进入固体2C.从溶液2得到产品的过程中,须控制条件防止其氧化和分解D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到6、下列实验操作、现象和结论均正确的是( ) 实验操作及现象结论A向蔗糖溶液中加入稀硫酸,水浴加热,一段时间后加入新制悬浊液并加热,未出现砖红色沉淀蔗糖未发生水解B将石蜡蒸气通过灼热的碎瓷片,再将生成的气体通入溴水中,溴水褪色石蜡裂解生成了乙烯C向溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成该溶液中不一定含有D室温下,取两份完全相同的铁粉分别投入溶液和溶液中,后者反应更快相同条件下,反应浓度越大,反应速率越快A.A B.B C.C D.D7、研究表明,在一定条件下,气态HCN(a)与HNC(b)的互变反应过程能量变化如图所示。下列说法正确的是( )A.HNC(g)比HCN(g)更稳定B.HCN(g)HNC(g)为吸热反应且反应条件一定为加热C.1molHCN(g)中的所有化学键全部断开需要吸收186.5kJ的热量D.1molHCN(g)转化为1molHNC(g)需要吸收59.3kJ的热量8、潜艇中使用的液氨一液氧燃料电池工作原理如图所示,电池工作时,下列说法正确的是( )A.电子由电极a流向电极b,经过溶液回到电极aB.溶液中的向电极a移动C.转移电子0.4mol,参加反应的氧气体积是2.24LD.电极a的电极反应式为9、莽草酸是一种可从中药八角茴香中提取的有机化合物,具有抗炎、镇痛作用,可用作抗病毒和抗癌药物的中间体。莽草酸的结构简式如图所示,下列说法不正确的是( )A.莽草酸的分子式为B.a对应官能团的名称为羧基C.a、c对应官能团均可与NaOH溶液反应D.b对应官能团可以与溴水、酸性溶液反应10、部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )A.a可与e反应生成bB.b既可被氧化,也可被还原C.可将e加入浓碱液中制得d的胶体D.可存在b→c→d→e→b的循环转化关系二、填空题11、氢氧化铝[]是重要的化工原料,也是用量最大和应用最广的无机阻燃添加剂,钼酸钠()具有广泛的用途,可作新型阻燃剂、水处理剂和无公害型冷却水系统的金属抑制剂等。现从某废钼催化剂(主要成分、、等)中回收和,其工艺流程如图:回答下列问题:(1)中Mo的化合价为_______。(2)已知、与相似,均能在高温下跟发生类似反应,试写出①焙烧时跟反应的化学方程式_______。(3)检验②操作后所得的滤渣中含有的方法是_______。(4)第③步操作中加入需要适量,可以通过测定溶液_______来控制的用量。该步操作中制备的离子方程式为_______。(5)从题目信息可知,如图曲线_______(填序号)为的溶解度曲线。(6)利用铝热反应可以回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得。写出发生铝热反应化学方程式_______。12、回答下列问题(1)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空: ①该反应的化学方程式为_______。②反应开始至2min,以气体Z表示的平均反应速率为_______。③若2min后反应达平衡,与初始时刻相比,此时容器内混合气体的平均相对分子质量_______(填“增大”、“减小”或“不变”,下同),混合气体密度比起始时_______。④上述反应,在第2min时,X的转化率为_______。(2)已知断裂几种化学键要吸收的能量如下:化学键C−HO=OC=OH−O断裂1mol键吸收的能量/kJ41549774546316g在中完全燃烧生成气态和气态水时_______(填“吸收”或“放出”)约_______kJ热量。(3)燃料电池是一种高效、环境友好的供电装置,如图为乙醇燃料电池的工作原理示意图,a、b均为情性电极。 ①使用时,空气从_______口通入(填“A”或“B”);②a极的电极反应为:_______。13、“价-类”二维图是学习元素化合物性质的重要方法,利用所学知识能更好的了解氮的循环。(1)“价-类”二维图中A的类别为___________; 丙为钠盐,其化学式为___________。(2)甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为___________。(3)用以下物质研究乙的性质,预测能与乙发生反应的物质为___________(填标号)。A.B.MgC.D.(4)丁主要用于染料、医药、印染、漂白等方面,且丁的焰色反应呈黄色。丁在酸性条件下,与KI按物质的量1∶1恰好完全反应,且生成能使淀粉变蓝的物质,则产物中含氮元素物质的化学式为___________。海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。(5)以上六种含氮微粒中,一共呈现了氮元素的___________种价态。(6)反应③和⑤中,若生成等量的,则转移的电子数之比为___________。14、乙烯是重要有机化工原料。结合以下路线回答:已知:(1)B的官能团名称是_______。(2)反应①的化学方程式是_______。(3)写出④的化学方程式:_______。(4)写出⑥的化学方程式:_______,该反应类型为_______。(5)F是一种高分子,可用于制作食品袋,其结构简式为_______。三、实验题15、回答下列问题。(1)下面是石蜡油在炽热碎瓷片的作用下产生并检验性质的实验,完成下列各问题。 ①B中溶液褪色的原因是_______。②在D处点燃时必须进行的操作是_______。(2)实验室制取的乙烯中常混有少量的,有人设计如图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题: ①图中a、b、c、d装置盛放的试剂依次是_______(填序号)。A.品红溶液B.NaOH溶液C.浓硫酸D.酸性高锰酸钾溶液②能说明存在的实验现象是_______。③使用装置b的目的是_______。④使用装置c的目的是_______。⑤能证明混合气体中含有乙烯的现象是_______。
参考答案1、答案:A解析:A项、氧化铁为棕红色固体,瓷器的青色不可能来自氧化铁,故A错误;B项、秦兵马俑是陶制品,陶制品是由粘土或含有粘土的混合物经混炼、成形、煅烧而制成的,故B正确;C项、陶瓷的主要原料是取之于自然界的硅酸盐矿物,陶瓷的主要成分是硅酸盐,与水泥、玻璃等同属硅酸盐产品,故C正确;D项、陶瓷的主要成分是硅酸盐,硅酸盐的化学性质不活泼,具有不与酸或碱反应、抗氧化的特点,故D正确。故选A。2、答案:D解析:A.乙烯含有碳碳双键,不能省略,其结构简式为:,故A错误;B.苯环结构不是单双键交替结构,是介于单键和双键之间的一种特殊的化学键, 与 是同种物质,故B错误;C.羟基不带电,其电子式为:,故C错误;D.烷烃的碳链呈锯齿状,丙烷的球棍模型为: ,故D正确;故选D。3、答案:A解析:乙烯和丙烯的最简式均为,故14g乙烯和丙烯混合气体中含氢原子数为2,A正确;与的反应是可逆反应,1mol与4mol反应生成的的物质的量一定小于2mol,B不正确;1 mol Fe溶于过量硝酸时生成 1 mol,转移电子数为3,C不正确;标准状况下是液体,D不正确。4、答案:A解析:5、答案:D解析:硫铁矿焙烧取硫后的烧渣(主要成分为,不考虑其他杂质),混合物中加入足量硫酸,与酸反应生成的硫酸铁、硫酸铝,二氧化硅不反应,过滤,固体1为二氧化硅;在滤液中加入铁粉将铁离子还原为亚铁离子,调节pH值使铝离子完全生成氢氧化铝沉淀,过滤,固体2为氢氧化铝,溶液2为硫酸亚铁,蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体。A.由流程分析可知,溶解烧渣选用足量硫酸,X为铁粉,故A正确; B.由流程分析可知,固体1中一定含有,调节pH值使铝离子完全生成氢氧化铝沉淀,则固体2为氢氧化铝,故B正确;C.亚铁离子易被空气中的氧气氧化,而且受热易失去结晶水,所以从溶液2得到产品的过程中,须控制条件防止其氧化和分解,故C正确; D.在溶液1中含有铁离子和铝离子,加过量的氢氧化钠,铝离子转化为偏铝酸根离子,铁离子与氢氧根离子结合生成氢氧化铁沉淀,所以最终得到的是硫酸铁而不是硫酸亚铁,故D错误。故选:D。6、答案:C解析:A.蔗糖水解后,没有加NaOH中和硫酸,操作不合理,不能证明蔗糖未水解,故A错误;B.不饱和烃与溴水发生加成反应,溴水褪色,不能证明石蜡裂解生成了乙烯,故B错误;C.白色沉淀可能为AgCl或硫酸钡,由实验及现象可知,该溶液中不一定含有,故C正确;D.常温下Fe遇浓硫酸发生钝化,Fe与稀硫酸反应生成氢气,反应原理不同,不能探究浓度对反应速率的影响,故D错误;故选:C。7、答案:D解析:物质的能量越低越稳定,根据图示可知等物质的量的HCN(g)比HNC(g)的能量低,因此HCN(g)比HNC(g)更稳定,A错误;由图示可知等物质的量的HCN(g)比HNC(g)能量低,则HCN(g)HNC(g)为吸热反应,但反应不一定在加热条件下进行,B错误;根据图示可知1molHCN(g)转化为中间状态的物质时需吸收186.5kJ的热量,但由于该中间状态的物质中仍然存在化学键,因此1molHCN(g)中的所有化学键全部断开需要吸收的热量不是186.5kJ,C错误;根据图示可知1mol HCN(g)转化为1molHNC(g)需要吸收的能量为186.5kJ-127.2kJ=59.3kJ,D正确。8、答案:D解析:A.根据原电池工作原理,电子从a电极经外电路向b电极移动,溶液中无电子移动,故A错误;B.该电池中a是负极,b是正极,工作时,溶液中的阳离子移向正极、阴离子移向负极,即电解质溶液中向b极移动,故B错误;C.气体的状态未知,未知,不能计算氧气的体积,故C错误;D.通氨气的a极为负极,碱性条件下负极反应为,故D正确;故选:D。9、答案:C解析:由结构简式可知莽草酸的分子式为,A正确;a对应官能团的名称为羧基,B正确;c对应官能团是醇羟基,不能与NaOH溶液反应,C错误;b对应官能团是碳碳双键,可以与溴水发生加成反应、与酸性溶液发生氧化反应,D正确。10、答案:C解析:A项,Fe与反应生成,推断合理。B项,亚铁盐既能被氧化为铁盐又能被还原为铁单质,推断合理。C项,氢氧化铁胶体的制备是将饱和的氯化铁溶液加入沸水中继续加热至液体呈红褐色;如果加入浓碱液中,生成的是沉淀,推断不合理。D项,可存在的循环转化关系,推断合理。11、答案:(1)+6(2)(3)将少量滤渣溶于适量硫酸后,加入几滴KSCN溶液,若溶液变红,则滤渣中含有(4)pH;(5)B(6)MoO3+2AlMo+Al2O3解析:12、答案:(1)3X(g)+Y(g)2Z(g);;增大;不变;30%(2)放出;688(3)B;解析:13、答案:(1)单质; (2)(3)BD(4)NO(5)5(6)2∶3解析:14、答案:(1)羟基(2)(3)(4);取代反应(酯化反应)(5)解析:15、答案:(1)乙烯被酸性高锰酸钾溶液氧化;检验气体纯度(2)ABAD;品红溶液褪色;除掉乙烯中的二氧化硫气体,避免干扰乙烯的检验;检验二氧化硫是否出尽;c中溶液不褪色,d中溶液褪色解析:
相关试卷
这是一份福建省福州市八县(市)一中2021-2022学年高一下学期期末联考化学试卷(含答案),共13页。
这是一份2021-2022学年福建省福州市福清市八校高二(上)期末化学试卷(含答案解析),共16页。
这是一份福建省福州市八县(市、区)一中2021-2022学年高一下学期期末联考化学试题,文件包含福建省福州市八县市区一中2021-2022学年高一下学期期末联考化学试题docx、2021-2022学年度第二学期八县市一中期末联考高一化学答案评分细则pdf等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。







